植物花青素合成酶ANS基因的研究进展

植物生理学报 Plant Physiology Journal 2016, 52 (6): 817–827 doi: 10.13592/https://www.wendangku.net/doc/0b5941051.html,ki.ppj.2016.0162817
收稿 2016-04-14 修定 2016-05-28
资助 贵州省高层次创新型人才培养计划(黔科合人才[2015]
4031号)和贵州省研究生教育创新基地建设(黔教研合CXJD 字[2014]001)项目。
* 通讯作者(E-mail: mshzhang@https://www.wendangku.net/doc/0b5941051.html,)。
植物花青素合成酶ANS 基因的研究进展
李小兰, 张明生*, 吕享
贵州大学生命科学学院, 山地植物资源保护与种质创新省部共建教育部重点实验室, 贵阳550025
摘要: 花青素合成酶ANS 是植物花青素生物合成途径末端的关键酶, 催化无色花色素转变为有色花青素。 本文通过对ANS 基因结构和功能进行综述, 旨在为更多植物ANS 基因的克隆及功能分析、花青素合成分子调控机制探索、花青素的开发利用等提供参考资料。
关键词: 花青素合成酶; 基因功能; 表达调控; 花青素; 逆境胁迫
花青素是植物次生代谢产物, 属于黄酮类水溶性天然色素, 主要以糖苷形式存在于表皮细胞的液泡中, 使植物的花、果实、种皮等器官呈现红、蓝、紫等颜色(顾林等2007; 张彬2011)。花青素具有多种生理功能, 对植物自身方面, 能吸引昆虫传粉、防止植物受紫外辐射、保护DNA 不受破坏、使细胞分化、抵御低温、防止病害以及使生命过程正常进行等; 对人类健康方面, 具有抗氧化、抗突变、预防心脑血管疾病、保护肝脏、抑制肿瘤细胞发生等多种生理功能(张彬2011)。无色花青素双加氧酶/花青素合成酶(leucoanthocyanidin dioxygenase/anthocyanidin synthase, LDOX/ANS)是植物花青素生物合成途径末端的关键酶, 催化无色花色素到有色花色素的转变(亓希武等2013; Jaakola 2013; Nakajima 等2001)。目前, 已经从多种植物中分离出了ANS 基因, 如芜菁(Brassica camp-estris ssp. rapa ) (许志茹等2009)、山药(Dioscorea spp.) (周生茂等2009)、桑树(Morus atropurputea ) (亓希武等2013)、芥蓝(Brassica albograbra ) (赵蓉蓉等2010)、金荞麦(Fagopyrum dibotrys ) (卜星星等2014)等。ANS 基因的功能研究不仅对园艺、植物保护方面有重要的价值, 对人类的健康也具有显著意义。本文对植物花青素合成酶ANS 的基因结构和功能进行介绍, 其中基因结构方面的内容可为克隆其他植物ANS 基因提供参考依据, ANS 基因的表达调控方面的内容可为ANS 基因的功能研究提供线索和途径。此外, 通过本综述可发现目前ANS 基因研究的薄弱环节, 为全面解析ANS 基因的功能及调控机制提供更多有利思路, 从而为探索花青素合成分子调控机制及进行花青素的开发利用等提供参考资料。1 ANS 基因结构
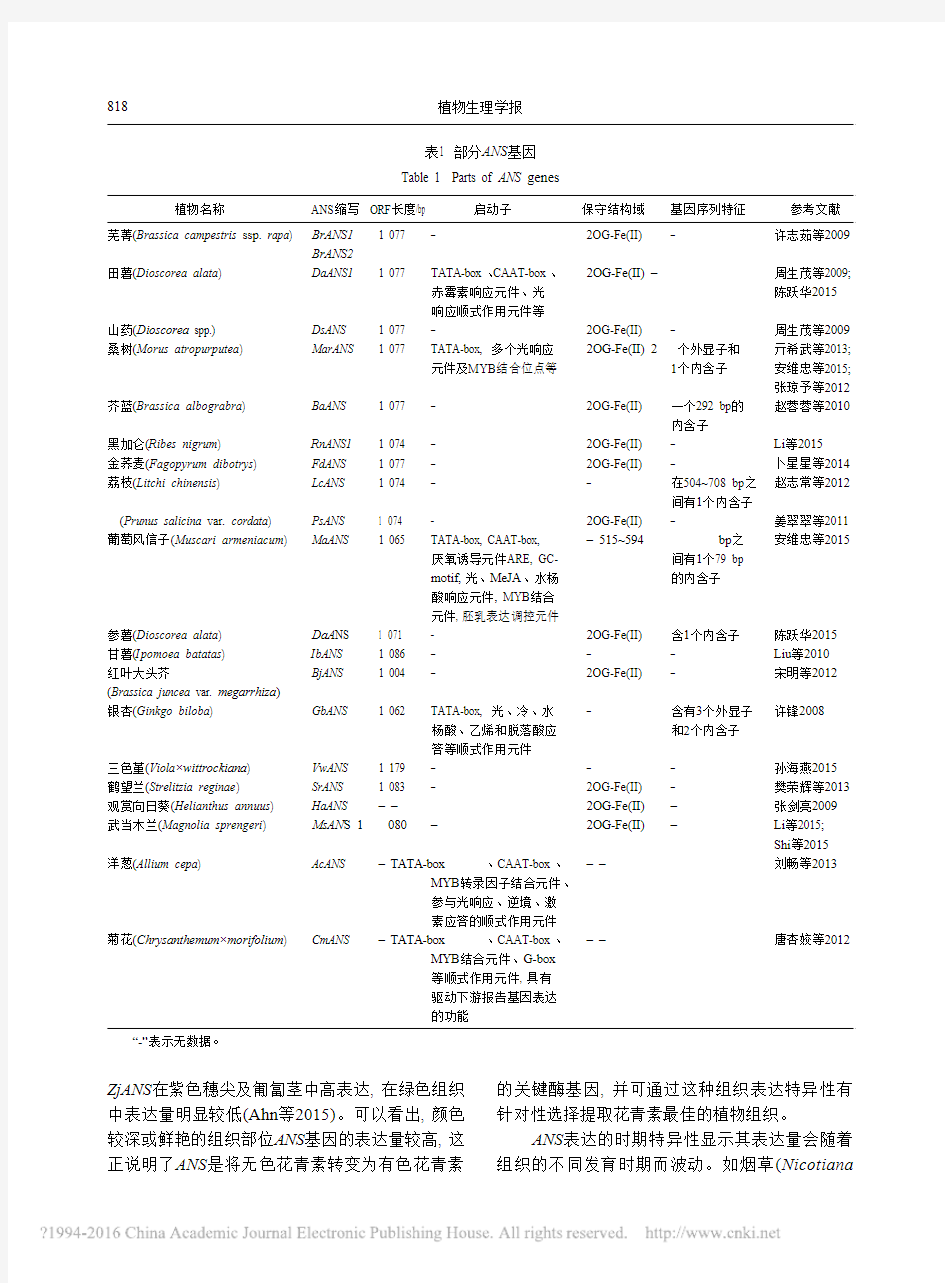
植物ANS 基因的开放阅读框ORF 普遍大于
1 000 bp, 基因序列含有1个或2个内含子, 启动子区具有基本启动子元件、转录因子结合元件、环境响应结合元件等, 其蛋白具有依赖Fe 2+的2-酮戊二酸[2OG-Fe(II)]双加氧酶家族基因的结构域(表1)。从启动子区域具有的响应元件可以推知, ANS 基因可能参与植物抵御逆境胁迫的应答和参与植物激素代谢通路, 其表达受MYB 类转录因子的调控; 从保守结构域可知, ANS 蛋白具有双加氧酶的功能, 是2OG-Fe(II)双加氧酶家族成员之一; 而ORF 长度和基因序列特征可为其他植物的ANS 基因克隆提供参考依据。
2 ANS 基因功能
目前, 对ANS 基因功能方面的研究主要集中在表达特性分析、过表达分析、miRNA 介导的基因沉默以及ANS 的表达调控等方面。2.1 ANS 的表达特性
经研究发现, ANS 基因在多种植物中普遍存在, 其表达在植物的组织中、组织的不同发育时期及不同品种中都具有特异性, 分别为组织特异性、时期特异性和品种特异性。
ANS 表达的组织特异性显示其在多个组织中均有表达, 但在各组织中的表达量各不相同。可可(Theobroma cacao )中TcANS 在叶、花、豆荚皮及种子中均有较高的表达(Liu 等2013)。而甘薯(Ipomoea batatas )的IbANS 在所有组织中均有不同程度的表达, 但块根及周皮中表达量更高(Liu 等2010); 金荞麦FdANS 在花期不同组织中的表达量分析显示花>叶>茎>根(卜星星等2014); 结楼草(Zoysia japonica )
植物生理学报
818
表1 部分ANS基因
Table 1 Parts of ANS genes
植物名称 ANS缩写 ORF长度/bp 启动子保守结构域基因序列特征参考文献
芜菁(Brassica campestris ssp. rapa) BrANS1 1 077 – 2OG-Fe(II) – 许志茹等2009
BrANS2
田薯(Dioscorea alata) DaANS1 1 077 TATA-box、CAAT-box、2OG-Fe(II) – 周生茂等2009;
赤霉素响应元件、光陈跃华2015
响应顺式作用元件等
山药(Dioscorea spp.) DsANS 1 077 – 2OG-Fe(II) – 周生茂等2009桑树(Morus atropurputea) MarANS 1 077 TATA-box, 多个光响应2OG-Fe(II) 2个外显子和亓希武等2013;
元件及MYB结合位点等1个内含子安维忠等2015;
张琼予等2012芥蓝(Brassica albograbra) BaANS 1 077 – 2OG-Fe(II) 一个292 bp的赵蓉蓉等2010
内含子
黑加仑(Ribes nigrum) RnANS1 1 074 – 2OG-Fe(II) – Li等2015
金荞麦(Fagopyrum dibotrys) FdANS 1 077 – 2OG-Fe(II) – 卜星星等2014荔枝(Litchi chinensis) LcANS 1 074 – – 在504~708 bp之赵志常等2012
间有1个内含子
(Prunus salicina var. cordata) PsANS 1 074 – 2OG-Fe(II) – 姜翠翠等2011葡萄风信子(Muscari armeniacum) MaANS 1 065 TATA-box, CAAT-box, – 515~594
bp之安维忠等2015
厌氧诱导元件ARE, GC- 间有1个79 bp
motif,
光、MeJA、水杨的内含子
酸响应元件, MYB结合
元件, 胚乳表达调控元件
参薯(Dioscorea alata) D aA NS 1 071 – 2OG-Fe(II) 含1个内含子陈跃华2015
甘薯(Ipomoea batatas) IbANS 1 086 – – – Liu等2010
红叶大头芥BjANS 1 004 – 2OG-Fe(II) – 宋明等2012 (Brassica juncea var. megarrhiza)
银杏(Ginkgo biloba) GbANS 1 062 TATA-box, 光、冷、水– 含有3个外显子许锋2008
杨酸、乙烯和脱落酸应和2个内含子
答等顺式作用元件
三色堇(Viola×wittrockiana) VwANS 1 179 – – – 孙海燕2015
鹤望兰(Strelitzia reginae) SrANS 1 083 – 2OG-Fe(II) – 樊荣辉等2013观赏向日葵(Helianthus annuus) HaANS – – 2OG-Fe(II)
– 张剑亮2009
武当木兰(Magnolia sprengeri) MsAN S 1
080 – 2OG-Fe(II) – Li等2015;
Shi等2015
洋葱(Allium cepa) AcANS – TATA-box、CAAT-box、– – 刘畅等2013
MYB转录因子结合元件、
参与光响应、逆境、激
素应答的顺式作用元件
菊花(Chrysanthemum×morifolium) CmANS – TATA-box、CAAT-box、– – 唐杏姣等2012
MYB结合元件、G-box
等顺式作用元件, 具有
驱动下游报告基因表达
的功能
“-”表示无数据。
ZjANS在紫色穗尖及匍匐茎中高表达, 在绿色组织中表达量明显较低(Ahn等2015)。可以看出, 颜色较深或鲜艳的组织部位ANS基因的表达量较高, 这正说明了ANS是将无色花青素转变为有色花青素的关键酶基因, 并可通过这种组织表达特异性有针对性选择提取花青素最佳的植物组织。
ANS表达的时期特异性显示其表达量会随着组织的不同发育时期而波动。如烟草(Nicotiana
李小兰等: 植物花青素合成酶ANS基因的研究进展819
tabacum) NtANS1和NtANS2在花成熟期表达量增加, 在花发育的最后阶段稍微降低(Lim等2013); 草莓(Fragaria ananassa cv. ‘Maehyang’) FaANS在开花后10 d开始表达, 而早期表达量会有短暂的降低, 到开花后22 d开始迅速上升, 34 d时达到顶峰(Bae 等2008); 田薯DaANS在块茎生长的前期具有很高的表达量, 8月份达到顶峰, 随后急剧降低(陈跃华等2015); 锦绣杜鹃花(Rhododendron pulchrum cv. ‘Oomurasaki’)叶中的ANS在开花过程中表达量降低(Nakatsuka等2008); 蛇莓(Duchesnea indica) DiANS在白色果实中的表达量低于红色时的果实(Debes等2011)。所以, 根据ANS在组织中表达的时期波动性, 可选择组织中花青素提取的最佳时期, 也可根据需要收获最佳时期的特定植物组织。
此外, ANS表达的品种特异性显示其表达水平为深色>浅色>白色/无色品种。如水母雪莲花(Saussurea medusa)白色系、绿色系和红色系愈伤组织中, ANS在红色系中表达水平高于另外两系(付婉艺2013); 紫甘蓝(Brassica oleracea var. capi-tata) ANS的表达水平明显高于青甘蓝(张彬2011); 粉色花瓣系桃(Prunus persica)中ANS的表达量显著高于白色花瓣系(Hassani等2015)。在选育富含花青素的优良作物或观赏植物品系时, 可参考ANS 表达的品种特异性, 从而缩短选育周期和时限。2.2 ANS的过表达
基因的过表达是研究基因功能的重要手段, 为探索ANS的功能, 其过表达方面也得到了一定程度的研究。
通过基因工程技术可将ANS转化到拟南芥(Arabidopsis thaliana)、烟草等模式植物中并获得转基因植株。DaANS的正向过量表达载体PCX-SN-35S-DaANS通过叶盘转化法转入烟草中并获得了3株阳性转基因植株(陈跃华2015); 三色堇VwANS通过农杆菌介导法转入拟南芥并获得了过表达转基因植株(孙海燕2015)。可以看出, ANS基因是可以通过转基因技术成功转化到其他植物中并超量表达的。
ANS的过表达一般情况下会增加转基因植株花青素的含量。桑树MaANS的转基因拟南芥与野生型相比, 整个植株的茎都能表现出淡红色(亓希武等2013)。可可TcANS在烟草中过表达提高了烟草花瓣中花青素及原花青素的含量; 其在拟南芥LDOX缺失突变体中过表达使种子中原花青素得以补充(Liu等2013)。水稻(Oryza sativa) ANS在水稻NP (Nootripathu)突变体中过表达, 果皮中积累原花青素; Pro (35S): ANS在玉米(Zea mays) a2突变体中表达使糊粉层产生花青素; Pro (MAS): ANS在NP突变体中过表达使原花青素前体物在果皮中生成花青素; 而且转基因植物中ANS转录水平增加10倍, 酶活性增加4倍, 增加了黄酮类及花青素的混合物积累, 同时原花青素降低(Reddy等2007)。从ANS过表达转基因植株中花青素含量增加可得到的启示是, 可在园艺植物研究中利用转基因技术获得色彩丰富的花卉等, 同时也可利用分子育种手段选育富含花青素的农作物优良品种。
2.3 miRNA介导的 ANS基因沉默
通过实施miRNA干扰技术, 可使ANS表达水平降低甚至导致基因沉默。‘红星’苹果果实中ANS被干扰后, 表达量下调98.1%, 同时使花色苷合成途径中类黄酮物质的合成受阻(王丽辉2014)。基因沉默方面的研究更加证明了ANS是花青素合成途径中的关键酶基因之一, 其表达调控的研究将有利于合理利用此基因功能使植物产生更多花青素。
2.4 ANS的表达调控
ANS的表达受多种因素影响, 自身序列的甲基化修饰、编码区核苷酸插入与缺失、miRNA、转录因子以及多种环境因素等都对ANS的表达具有调控作用, 这些调控包括正调控和负调控。
2.4.1 甲基化修饰对ANS表达的调控
ANS基因序列的甲基化水平影响其表达水平, 甲基化水平越高其表达水平越低。‘白鸽’莲(Nym-phaea)和‘野红莲’花瓣中ANS的开放阅读框及2 000 bp左右的启动子区之间无序列差异, 但两者的启动子区甲基化位点和甲基化水平存在差异。‘白鸽’莲要比‘野红莲’的甲基化位点多出18处(包括14处CG, 2处CHH和2处CHG), 总体的甲基化水平也比‘野红莲’高, 推测‘野红莲’和‘白鸽’莲的红、白花色差异可能是由于花瓣中ANS启动子区不同水平的甲基化影响了其与转录因子的结合, 进而影响ANS的表达水平及花青素的积累, 从而导致红、白莲花的着色差异(邓娇2015; Deng等2015)。ANS 基因序列甲基化水平与表达水平之间的关系研究,
植物生理学报820
揭示了对其结构和功能的研究过程中不能忽视基因序列的修饰环节, 这极有可能是品种之间颜色差异的主要原因之一。
2.4.2 编码区插入或缺失核苷酸对ANS表达的调控
基因编码区出现核苷酸插入或缺失会改变读码框的顺序, 从而使ANS的表达水平改变甚至不能正常表达。无花青素的石榴(Punica granatum ) PgANS (也叫PgLDOX)编码区有一个插入位点及一个SNP位点, SNP位点没有改变其编码的氨基酸序列, 而该插入位点与白色表型完全连锁, 导致PgANS无法转录, 花青素不能积累呈现白石榴的表型(Ben-Simhon等2015)。龙胆草(Gentiana tri? ora)中失活的ans1就是在第2个外显子中缺失了4 bp的核苷酸, 从而导致终止密码提前, 使基因失活(Na-katsuka等2012)。正确的读码框是基因表达正确蛋白质的关键因素之一, 可见ANS基因也毫无例外, 所以研究品种之间颜色差异的原因时除了考虑有无ANS基因、启动子区甲基化水平等, 还需考虑ANS基因编码区有无SNP位点、是否有核苷酸序列的插入和缺失等因素。
2.4.3 miRNA对ANS表达的调控
miRNA可通过调控其他基因的表达间接调控ANS的表达。棉花(Gossypium hirsutum) GhmiR156在伸长期的纤维中通过抑制GhSPL9的表达, 间接抑制了ANS的表达, 最终抑制花青素的合成(王正明2012)。在正常供磷和缺磷条件下, miR828过表达的转基因番茄(Solanum lycopersicum)植株中ANS 表达量和花青素含量均低于野生型(贾小云等2015)。番茄miR858负调控SlMYB7-like的转录, 在构建的转基因植株中内源miR858被封闭后, SlMYB7-like 转录显著提高, ANS的表达上调(Jia等2015)。众多有关miRNA的研究都表明, 其广泛参与了基因的表达和调控, ANS基因的表达除直接受miRNA干扰外, 这种间接调控作用给我们提供了更多基因表达调控研究的启示, 说明特定基因的表达以及表达量的多少是多种因素的综合效应。
2.4.4 转录因子对ANS表达的调控
转录因子是调控基因表达的反式作用因子, 一般与启动子区顺式作用元件相结合并调控靶基因的表达, 其可以是一个转录因子也可以是多个转录因子相互结合形成复合体的形式起作用。研究发现, MYB、bHLH、WD40类转录因子参与了ANS基因表达的调控, 而这正好与ANS基因启动子区顺式作用元件分析结果相一致。
MYB类转录因子对ANS表达的调控体现在多个方面: (1) MYB转录因子与ANS启动子区DNA结合位点结合从而启动其表达。紫肉甘薯块茎IbMYB1 (R2R3-MYB)能与ANS启动子区的TAACCG box和TATCC box 基序在体外特异结合, 当与完整的启动子结合时启动报告基因强烈表达, 当与缺MYB DNA结合位点的启动子片段结合时报告基因表达很弱(Dong等2014)。菊花MYB可能与ANS启动子上的顺式作用元件结合从而调控其对光照的响应(唐杏姣等2012)。淫羊藿(Herba epimedii) R2R3-MYB转录因子EsMYBA1能激活ANS的启动子(Huang等2013)。(2) MYB转录因子对ANS的表达具有正调控作用。杨梅(Myrica rubra) R2R3-MYB转录因子MrMYB1在拟南芥中的过表达使ANS表达明显上调(Huang等2013)。甘薯IbMYB1a的异源表达诱导ANS上调(An等2015)。(3) MYB转录因子对ANS的表达具有负调控作用。日本龙胆草(Japanese gentian)的GtMYB1R1和GtMYB1R9 (R3-MYB)在烟草中过表达使转基因烟草花中ANS的表达被抑制(Nakatsuka等2013)。智利草莓(Fragaria chiloensis ssp. chiloensis f. chiloensis) FcMYB1 (R2R3-MYB)在RNAi干扰下短暂下调, 使果实中ANS上调(Sal-vatierra等2013)。(4) MYB 转录因子在植物有色组织调控ANS表达。芜菁有色叶子上的BrANS表达受BrMYB2-2调控(Ahmed等2014)。黑莓(Rubus) R1R2-MYB10基因表达模式与RuANS类似, 在花青素积累高峰来临之前达到最高表达量(陈清2012)。
(5) MYB转录因子在环境胁迫条件下调控ANS的表达。‘红鸽’羽衣甘蓝(Brassica oleracea var. acephala f. tricolor) R2R3-MYB转录因子BoPAP1在低温条件下促使ANS过量表达(张彬2011)。由此可见, 调控ANS表达的MYB类转录因子有多种类型如R1R2-MYB、R2R3-MYB、R3-MYB等, 其中R2R3-MYB 既参与ANS的正调控又参与其负调控, 说明同种类型的MYB类转录因子在不同植物中对ANS表达的调控作用不同, 而R3-MYB主要起负调控作用。此外, MYB类转录因子可能是参与了逆境胁迫引起的信号转导网络来调控ANS基因表达的。
李小兰等: 植物花青素合成酶ANS基因的研究进展821
bHLH转录因子与ANS表达模式一致, 调控植物花青素积累。bHLH转录因子BrTT8与ANS的表达模式一致, 在红菜薹(Brassica campestris ssp. chinensis var. purpurea)花青素积累的组织中都有高丰度的表达, 而在没有花青素积累的组织以及小白菜中的表达量非常低(张彬2011; Ahmed等2014)。瓜叶菊(Senecio cruentus) ScbHLH17、ScbHLH21和ScbHLH22的表达模式同ScANS的表达模式一致, 通过调控ScDFR3和ScANS的表达模式, 从而决定瓜叶菊能否积累花青素苷(王璐2015)。编码bHLH转录因子的甜黑米黑色种皮基因Ra主要通过促进ANS表达来加强黑米种皮中花青素的积累(梁婷婷2013)。从表达模式上看, bHLH类转录因子主要对ANS表达起正调控作用。
WD40类转录因子调控ANS的表达。烟草WD40结构域的蛋白质NtTTG2通过调控ANS的表达从而影响花瓣着色(李宝燕2012)。
MYB、bHLH及WD40通过形成MBW复合体调控ANS的表达。水母雪莲花愈伤组织中MYB、bHLH、WD40转录因子在红色系中表达量极高, 绿色系次之, 白色系最低, 红色系中MYB的表达量为白色系和绿色系的19.7和7.6倍, 推测MYB与ANS的高表达有关, bHLH和WD40的表达水平比例接近1:1, 可能是形成了MBW (MYB-bHLH-WD40)复合体对类黄酮的生物合成进行调控(付婉艺2013)。而且草莓FaMYB9/FaMYB11、FabHLH3和FaTTG1形成MYB-bHLH-WD40复合体调控原花青素生物合成(Schaart等2013)。结合bHLH与ANS表达模式一致的情况, 可以推知, MYB、bHLH及WD40也可能形成复合体来调控ANS基因表达。但是, MYB、bHLH及WD40是否都是形成复合体, 或者有些形成复合体有些则是单独作用, 从而调控ANS表达?这还需要更多的研究来加以证实。
2.4.5 各种环境因素对ANS表达的调控
各种环境因素常常能够通过激活细胞信号通路, 从而激活相应转录因子对适应环境的基因进行表达调控, 所以环境因素是调控ANS基因表达的重要因子。经研究发现, 光照、低温、高温、干旱、糖类等都对ANS的表达具有调控作用(图1)。
光照是调控ANS表达的重要环境因子。(1)光照可诱导ANS的表达。红菜薹幼苗中ANS
在光诱
图1 部分环境因素对ANS表达的调控
Fig.1 The regulation of some environmental factors on the
expression of ANS gene
箭头前无短横线表示对ANS表达起正调控作用, 有短横线表示负调控作用。
导下过量表达, 且只有光照时才能累积花青素而呈现紫红色(张彬2011)。野茶树(Camellia sinensis) ANS的表达水平在黑暗处理后下降(Hong等2014)。对‘新红星’和‘王林’两种苹果进行套袋处理发现, 果实中ANS的表达量在除袋后上调, 其中‘新红星’苹果成熟时比刚除袋时上调17倍, 且两种果实都更易着色, 说明ANS的表达对果实着色具有重要作用(王丽辉2014)。(2)光处理时间延长, ANS的表达量增加。‘津田芜菁’中ANS的表达量随着光处理时间的延长而增加(许志茹和李玉花2006a)。红叶根用芥(Brassica juncea var. napiformis) ANS基因光照胁迫下12 h后表达量开始上升, 处理96 h后达到最大值(孙梓健2010)。(3)紫外辐射可诱导ANS的表达。‘赤丸芜菁’ ANS的表达受UV-A诱导, 且表达量与处理时间相关(许志茹等2009)。(4)紫外辐射对ANS的表达具有正调控作用。‘津田芜菁’ANS的表达量在UV-A处理48 h后明显高于黑暗条件下白色块根(许志茹和李玉花2006b)。银杏GbANS的表达水平在UV-B处理下上调(许锋2008)。茶树芽叶ANS 的表达受紫外光的正调控(李智2014)。(5)伽马辐射可诱导ANS的表达。小麦(Triticum aestivum) ANS的表达水平在小剂量的慢性伽马辐射下上升(Hong等2014)。光照对ANS表达的影响表明, 对于有色花青素的合成, 光照是必不可少的条件, 这正与ANS启动子区普遍存在光响应元件相一致, 同时可看出ANS是光敏感型基因。此外, 可以通过紫外、伽马等射线辐射的方法, 对植物进行逆境胁迫, 使ANS的表达量上调, 获得较多花青素。
植物生理学报822
温度的高低对ANS的表达具有调控作用。(1)不同温度处理可改变ANS的表达水平。茶树ANS 在5°C/10°C处理下, 表达量最低; 10°C/20°C处理下, 表达量最高; 在更高温度处理下, 表达量下调(李智2014)。芜菁BrANS能响应冷害和冻害胁迫, 且只在有色叶子上表达(Ahmed等2014)。(2)低温处理可使ANS的表达上调。‘红鸽’羽衣甘蓝ANS的表达水平在低温条件下明显高于室温条件, 且低温可以诱导A N S过量表达(张彬2011;张彬等2014)。红叶根用芥ANS低温胁迫12 h后表达量开始上升, 处理48 h后达到最大值(孙梓健 2010)。红心橙(Citrus sinensis) ANS的转录水平在4°C低温下处理3~6 d后急剧升高(Crifo等2011)。(3)高温可使ANS的转录水平降低。在35°C高温下红酒葡萄(Vitis vinifera)皮中的ANS转录水平下降(Mori等2007)。低温胁迫下ANS基因表达上调, 说明其参与了抵御低温胁迫的信号通路, 这可能与MYB类转录因子在低温下对其的激活作用相关, 也可根据此种特性为获取更多花青素而对植物采取适当的低温处理, 但由于高温胁迫会使ANS表达下调, 所以推测植物在高温下合成花青素可能比低温下少, 而合成花青素也可能是植物用来抵御低温胁迫的途径之一。
温度和光照共同调控ANS的表达。苹果ANS 的转录水平在高温下无论有无UV-B辐射都受抑制, 低温无UV-B辐射时没有较高抑制(Ban等2009)。红叶大头芥ANS的表达量在低温和强光胁迫下随胁迫时间的延长而增加, 其中强光胁迫下的表达量约为低温胁迫的2倍, 推测低温和强光胁迫可能诱导了红叶大头芥中花青素合成途径不同的调控机制(宋明等2012)。光照和低温分别作用下ANS表达上调, 而两者共同作用下上调幅度更大, 同时光照的影响大于低温的, 说明对于促进ANS表达上调的因素可以叠加, 可通过多种环境因素共同处理的方式上调ANS表达并取得加倍的花青素积累。
其他环境因子如干旱、氮素、植物激素和糖类等也对ANS的表达具有调节作用。(1)干旱胁迫可下调ANS的表达。红叶根用芥ANS在干旱胁迫下表达量较低(孙梓健2010); 红肉苹果叶片中ANS 的表达水平, 在长期干旱胁迫条件下出现下调, 短期干旱胁迫条件下初期大幅下降, 后期有小幅的增加(汪晓谦2015), 说明干旱条件可能不利于植物花青素的积累。(2)缺氮处理可上调ANS的表达。茶树芽叶ANS的表达量缺氮处理后显著上调(李智2014), 说明适当的氮肥控制可能有利于植物花青素的积累。(3)脱落酸、乙烯、MeJA等激素及蔗糖处理可上调ANS的表达。银杏GbANS在脱落酸、水杨酸、乙烯以及蔗糖处理下表达水平上调(许锋2008)。‘蓝丰’蓝莓(Vacc i nium spp.)白果期ANS在ABA (600 mg·L-1)处理后转录水平明显提高(孙莹2013)。PR::OSB2转基因水稻在MeJA处理下ANS表达上调(Kawahigashi等2007)。萝卜(Rapha-nus sativus)幼苗下胚轴在5%的蔗糖处理下ANS表达量显著提高(贾晓琳2013)。从这些研究结果可推测, 蔗糖可能为花青素的合成间接提供了反应底物, 而与逆境相关的植物激素脱落酸及茉莉酸甲酯和促进果实成熟的乙烯可能参与了刺激花青素合成的信号通路。(4) NAA、调环酸钙等植物生长调节剂及甘露糖处理可下调ANS的表达。NAA (200 mg·L-1)处理明显抑制‘蓝丰’蓝莓ANS的表达(孙莹2013)。苹果后熟时期喷施调环酸钙(prohexa-dione-calcium)后, ANS表达暂时下调(Bizjak等2013)。‘洛阳红’牡丹(Paeonia suffruticosa)在甘露糖处理下PsANS1的表达下调(张超2014)。从植物生长调节剂NAA、调环酸钙对ANS的下调作用可推知, 植物处于旺盛生长发育时期时花青素的合成可能受到抑制, 这与ANS基因在组织成熟时期的表达量高以及与刺激组织成熟的激素作用正好一致, 说明花青素在成熟时期合成量高。而甘露糖的抑制作用说明甘露糖与蔗糖之间可能存在拮抗作用, 同时也说明不同的糖对花青素的合成具有不一样的效果。
此外, 植物激素通过调节MYB、bHLH、WD40的表达调控ANS的表达。苹果(Malus domestica) MdMYB9和MdMYB11都与ANS的启动子结合, 而MdbHLH3调控MdMYB9和MdMYB11的转录, 茉莉酸ZIM结构域蛋白(MdJAZ)与MdbHLH3相互作用,M d J A Z2的过表达抑制M d b H L H3与M d-MYB9、MdMYB11的启动子结合。MdMYB9和MdMYB11的过表达促进苹果愈伤组织花青素及原花青素的合成, 茉莉酸甲酯进一步加强这种合
李小兰等: 植物花青素合成酶ANS基因的研究进展823
成(An等2015)。2,4-D、NAA和IAA通过调节拟南芥红色细胞中TT8、GL3及PAP1 (组成WD40-bHLH-MYB复合体)的表达从而调控ANS和DFR的表达来控制花青素的合成(Liu等2014)。茉莉酸甲酯通过bHLH类转录因子调控MYB类转录因子表达从而调控ANS的表达和花青素的合成, 而生长素类激素通过调控WD40-bHLH-MYB复合体来调控ANS的表达和花青素的合成, 两者的调控机制可能存在差异。另外, 也可看出MYB、bHLH、WD40类转录因子对ANS表达的调控可能是以多种方式进行的, 三者形成复合体是其中的一种方式, 而由bHLH调控MYB的表达后再由MYB来调控ANS表达也是其中的方式之一。
3 结语与展望
本文通过对植物花青素合成酶基因ANS的序列、功能及表达调控方面研究内容的总结和分析, 可以看出, ANS基因具有保守的2OG-Fe(II)加氧酶家族的序列特征, 其启动子区带有的多种环境胁迫响应元件暗示其与环境胁迫应答具有一定的相关性; ANS的表达具有组织特异性、时期特异性和品种特异性; 通过基因工程技术可以获得ANS过表达的转基因植株; miRNA可以使ANS基因沉默, 也可通过间接调控的方式调控ANS的表达; ANS启动子区的甲基化修饰水平及编码区核苷酸的插入或缺失直接影响其是否能够表达; MYB、bHLH、WD40类转录因子通过形成复合体或相互调控转录水平后调控ANS的表达, 具有正调控和负调控两种作用; 多种环境因素对ANS表达具有调控作用, 其中光照是ANS表达上调并合成花青素必需的环境因子, 低温可上调其表达, 两者共同作用使其表达上调作用更强, 激素通过调节转录因子的表达调控ANS表达等。
花青素合成酶在植物花青素合成过程中将无色花青素转变为有色花青素, 为丰富园艺色彩、天然色素的生产研究提供了参考依据, 而且花青素具有独特的保健功能, 对人类的健康具有保护作用, 所以ANS结构和功能的研究具有可观的价值。
但是, 从目前的研究现状也可以看出, ANS基因的研究还处于一个需要继续深化的阶段, 如miRNA对ANS的调控作用、ANS基因序列修饰后对不同品种花青素积累的影响、各种环境因子通过怎样的信号通路启动的转录因子以哪些方式调节ANS表达和调控花青素合成、利用ANS基因功能研究成果进行分子育种等方面的研究都还较少, 而这些领域的研究对于未来利用ANS基因功能为人类提供天然色素、健康食品等都是必需的, 值得科研工作者对其进行更深入的研究。
参考文献
Ahmed NU, Park JI, Jung HJ, Hur Y, Nou IS (2014). Anthocyanin biosynthesis for cold and freezing stress tolerance and desirable color in Brassica rapa. Funct Integr Genomics, 15: 383–394 Ahn JH, Kim JS, Kim S, Soh HY, Shin H, Jang H, Ryu JH, Kim A, Yun KY, Kim S, et al (2015). De novo transcriptome analysis to identify anthocyanin biosynthesis genes responsible for tissue-specific pigmentation in zoysiagrass (Zoysia japonica Steud.). PLoS ONE, 10 (4): e0124497
An CH, Lee KW, Lee SH, Jeong YJ, Woo SG, Chun H, Park YI, Kwak SS, Kim CY (2015). Heterologous expression of IbMYB1a by different promoters exhibits different patterns of anthocyanin accumulation in tobacco. Plant Physiol Biochem, 89: 1–10
An WZ, Liu YL, Liu HL, Chen KL (2015). Isolation and analysis of Muscari armeniacum MaANS gene and its promoter. Acta Bot Boreal-Occident Sin, 35 (9): 1728–1734 (in Chinese with En-glish abstract) [安维忠, 刘雅莉, 刘红利, 陈凯利(2015). 葡萄风信子MaANS基因及启动子的克隆与分析. 西北植物学报, 35
(9): 1728–1734]
An XH, Tian Y, Chen KQ, Liu XJ, Liu DD, Xie XB, Cheng CG, Cong PH, Hao YJ (2015). MdMYB9 and MdMYB11 are involved in the regulation of the JA-induced biosynthesis of anthocyanin and proanthocyanidin in apples. Plant Cell Physiol, 56 (4): 650–662 Bae KS, Kih JY, Pyee JH (2008). A set of anthocyanin biosynthetic genes are differentially expressed in strawberry (Fragaria×anan-assa cv. Maehyang) during the fruit development process. J Life Sci, 18 (2): 234–240
Ban Y, Kondo S, Ubi BE, Honda C, Bessho H, Moriguchi T (2009).
UDP-sugar biosynthetic pathway: contribution to cyanidin 3-ga-lactoside biosynthesis in apple skin. Planta, 230 (5): 871–881 Ben-Simhon Z, Judeinstein S, Trainin T, Harel-Beja R, Bar-Ya'akov I, Borochov-Neori H, Holland D (2015). A “White” anthocyan-in-less pomegranate (Punica granatum L.) caused by an inser-tion in the coding region of the leucoanthocyanidin dioxygenase (LDOX; ANS) gene. PLoS ONE, 10 (11): e0142777
Bizjak J, Weber N, Mikulic-Petkovsek M, Alam Z, Thill J, Stich K, Halbwirth H, Veberic R (2013). Polyphenol gene expression and changes in anthocyanins and polyphenols in the skin of ‘Brae-burn’ apples after the autumn application of prohexadione-calci-um. Plant Growth Regul, 71 (3): 225–233
Chen Q (2012). The research of blackberry anthocyanin, proanthocy-anidin synthesis metabolism and related genes cloning and ex-pression (PhD thesis). Ya’an: Sichuan Agricultural University (in Chinese with English abstract) [陈清(2012). 黑莓花青素苷、原花色素的合成代谢及相关基因克隆和表达研究(博士论文).
植物生理学报824
雅安: 四川农业大学]
Chen YH (2015). Cloning and expression analysis of DaANS gene in Dioscorea alata L. [Master’s thesis]. Haikou: Hainan University (in Chinese with En g lish abstract) [陈跃华(2015). 参薯DaANS 基因的克隆及表达分析[硕士论文]. 海口: 海南大学]
Chen YH, Xu Y, Wu WQ, Liu LY, Huang DY (2015). Cloning and analysis of differential expression of DaANS gene in Dioscorea alata. Plant Physiol J, 51 (6): 853–859 (in Chinese with English abstract) [陈跃华, 许云, 吴文嫱, 刘林娅,黄小龙, 黄东益(2015). 参薯DaANS基因克隆及表达差异分析. 植物生理学报,
51 (6): 853–859]
Crifò T, Petrone G, Lo Cicero L, Lo Piero AR (2011). Short cold stor-age enhances the anthocyanin contents and level of transcripts related to their biosynthesis in blood oranges. J Agric Food Chem, 60 (1): 476–481
Debes MA, Arias ME, Grellet-Bournonville CF, Wulff AF, Martínez-Zamora MG, Castagnaro AP, Díaz-Ricci JC (2011).
White-fru i ted Duchesnea indica (Rosaceae) is impaired in ANS gene expression. Am J Bot, 98 (12): 2077–2083
Deng J (2015). The analysis of ? avonoid pigments in lotus petals and the studies on the coloration mechanism of lotus petals [PhD thesis]. Wuhan: University of Chinese Academy of Sciences (Wuhan Botanical Garden) (in Chinese with English abstract) [邓娇(2015). 莲花瓣类黄酮色素分析及莲花瓣着色机理研究[博士论文]. 武汉: 中国科学院研究生院(武汉植物园)]
Deng J, Fu Z, Chen S, Damaris RN, Wang K, Li T, Yang P (2015).
Proteomic and epigenetic analyses of lotus (Nelumbo nucifera) petals between red and white cultivars. Plant Cell Physiol, 56 (8): 1546–1555
Dong W, You Y, Niu L, Gao F (2014). Isolation and analysis of the promoter of an anthocyanin synthase gene from purple-? eshed sweet potato tubers. Acta Physiol Plant , 36 (10): 2637–2649
Fan RH, Huang ML, Wu JS, Zhong HQ (2013). Cloning and expres-sion of anthocyanidin synthase in Strelitzia reginae Banks. Chin J Cell Biol, 35 (11): 1620–1625 (in Chinese with English ab-stract) [樊荣辉, 黄敏玲, 吴建设, 钟淮钦(2013). 鹤望兰花青素合成酶基因SrANS的克隆及表达分析. 中国细胞生物学学报,
35 (11): 1620–1625]
Fu WY (2013). Analysis of ? avonoids component and gene expres-sion in Saussurea medusa Maxim [Master’s thesis]. Yangling: Northwest A & F University (in Chinese with English abstract) [付婉艺(2013). 水母雪莲类黄酮成分及基因表达分析[硕士论文]. 杨凌: 西北农林科技大学]
Gu L, Zhu HM, G u ZX (2007). Anthocyanin biosynthesis and the co-lour mechanism, and the ways to improve its stability. Sci Tech Food Ind, 11: 240–244 (in Chinese with English abstract) [顾林, 朱洪梅, 顾振新(2007). 花青素的生物合成和成色机理及提高其稳定性的途径. 食品工业科技, 11: 240–244]
Hassani D, Liu HL, Chen YN, Wan ZB, Zhuge Q, Li SX (2015).
Analysis of biochemical compounds and differentially expressed genes of the anthocyanin biosynthetic pathway in variegated peach ? owers. Genet Mol Res, 14 (4): 13425
Hong G, Wang J, Zhang Y, Hochstetter D, Zhang S, Pan Y, Shi Y, Xu P, Wang Y (2014). Biosynthesis of catechin components is dif-
ferentially regulated in dark-treated tea (Camellia sinensis L.).
Plant Physiol Biochem, 78: 49–52
Hong MJ, Kim JB, Yoon YH, Kim SH, Ahn JW, Jeong IY, Kang SY, Seo YW, Kim DS (2014). The effects of chronic gamma irradia-tion on oxidative stress response and the expression of anthocy-anin biosynthesis-related genes in wheat (Triticum aestivum). Int J Radiat Biol, 90 (12): 1218–1228
Huang W, Sun W, Lv H, Luo M, Zeng S, Pattanaik S, Yuan L, Wang Y (2013). A R2R3-MYB transcription factor from Epimedium sagit t atum regulates the ? avonoid biosynthetic pathway. PLoS ONE, 8 (8): e70778
Huang YJ, Song S, Allan AC, Liu XF, Yin XR, Xu CJ, Chen KS (2013).
Differential activation of anthocyanin biosynthesis i n Arabidop-sis and tobacco over-expressing an R2R3 MYB from Chinese bayberry. Plant Cell Tiss Organ Cult, 113 (3): 491–499
Jaakola L (2013). New insights into the regulation of anthocyanin bio-synthesis in fruits. Trends Plant S ci, 18 (9): 477–483
Jia X, Shen J, Liu H, Li F, Ding N, Gao C, Pattanaik S, Patra B, Li R, Yuan L (2015). Small tandem target mimic-mediated blockage of microRNA858 induces anthocyanin accumulation in tomato.
Planta, 242 (1): 283–293
Jia XL (20 13). The primary research of exogeous sugar treatment in anthocyanin metabolism in radi s h seedings [Master’s thesis].
Xinxiang: Henan Normal University (in Chinese with English abstract) [贾晓琳(2013). 外源糖在心里美萝卜幼苗花青素代谢中作用初探[硕士论文]. 新乡: 河南师范大学]
Jia XY, Liu H, Shen J, L i Fang, Ding N, Sun Y, Gao CY, Li RZ (2015).
Negative regulation of anthocyanin biosynthesis in tomato by MircroRNA828 under phosphate de? ciency. Sci Agric Sin, 15: 2911–2924 (in Chinese with English abstract) [贾小云, 刘慧, 沈洁, 李芳, 丁娜, 孙岩, 高昌勇, 李润植(2015). MicroRNA828负调控缺磷胁迫诱导的番茄花青素生物合成. 中国农业科学, 15: 2911–2924]
Jiang CC, Chen GX, Pan DM, Lv SH (2011). Identi? cation and pro-karyotic expression of anthocyanidin synthase gene in Prunus salicina. Chin J Trop Crops, 11: 2088–2093 (in Chinese with English abstract) [姜翠翠, 陈桂信, 潘东明, 吕恃衡(2011). 果实中花青素合成酶基因PsANS的克隆及原核表达分析. 热带作物学报, 11: 2088–2093]
Kawahigashi H, Hirose S, Iwai T, Ohashi Y, Sakamoto W, Maekawa M, Ohkawa Y (2007). Chemically induced expression of rice OSB2 under the control of the OsPR1.1 promoter confers increased an-thocyanin accumulation in transgenic rice. J Agric Food Chem,
55 (4): 1241–1247
Li BY (2012). Regulatory roles of WD40-domain protein TTG2 in growth, development and pathogen defense of tobacco [PhD the-sis]. Nanjing: Nanjing Agricultural University (in Chinese with English abstract) [李宝燕(2012). 烟草WD40蛋白TTG2对生长发育和抗病性的调控作用[博士论文]. 南京: 南京农业大学]
Li XG, Wang J, Yu ZY (2015). C loning of an anthocyanidin synthase gene homolog from blackcurrant (Ribes nigrum L.) and its ex-pression at different fruit stages. Genet Mol Res, 14 (1): 2726
Li Z (2014). Effect of the main environmental factors on anthocyanin content and related genes expression of purple tea shoots [PhD
李小兰等: 植物花青素合成酶ANS基因的研究进展825
thesis]. Tai’an: Shandong Agricultural University (in Chinese with English abstract) [李智(2014). 不同环境因子调控茶树紫色芽叶形成的分子机制研究[博士论文]. 泰安: 山东农业大学] Liang TT (2013). Function analysis of black pericarp gene in rice variety ‘TIANHEMI’ [Master’s thesis]. Nanjing: Nanjing Agri-cultural University (in Chinese with English abstract) [梁婷婷(2013). 甜黑米黑色种皮基因的功能分析[硕士论文]. 南京: 南京农业大学]
Lim SH, Kim JK, Lee JY, Kim YM, Sohn SH, Kim DH, Ha SH (2013).
Petal-speci? c activity of the promoter of an anthocyanidin syn-thase gene of tobacc o (Nicotiana tabacum L.). Plant Cell Tiss Organ Cult, 114 (3): 373–383
Liu C, Miao J, Huo YM, Yang YY, Liu BJ, Wang ZF, Liu B, Wang F, Wu X (2013). Cloning and transient expression assay of ANS promoters in onion. Shandong Agric Sci, 45 (5): 13–17 (in Chi-nese with English abstract) [刘畅, 缪军, 霍雨猛, 杨妍妍, 刘冰江, 王志峰, 刘波, 王富, 吴雄(2013). 洋葱ANS基因启动子的克隆与瞬时表达分析. 山东农业科学, 45 (5): 13–17]
Liu X, Chen M, Li M, Yang C, Fu Y, Zhang Q, Zeng L, Liao Z (2010).
The anthocyanidin synthase gene from sweetpotato [Ipomoea batatas (L.) Lam]: cloning, characterization and tissue expres-sion analysis. Afr J Biotechnol, 9 (25): 3748–3752
Liu Y, Shi Z, Maximova S, Payne MJ, Guiltinan MJ (2013). Proan-thocyanidin synthesis in Theobroma cacao: genes encoding anthocyanidin synthase, anthocyanidin reductase, and leucoan-thocyanidin reductase. BMC Plant Biol, 13 (1): 202
Liu Z, Shi MZ, Xie DY (2014). Regulation of anthocyanin biosyn-thesis in Arabidopsis thaliana red pap1-D cells metabolically programmed by auxins. Planta, 239 (4): 765–781
Mori K, Goto-Yamamoto N, Kitayama M, Hashizume K (2007). Loss of anthocyanins in red-wine grape under high temperature. J Exp Bot, 58 (8): 1935-1945.
Nakajima J, Tanaka Y, Yamazaki M, Saito K (2001). Reaction mech-anism from leucoanthocyanidin to anthocyanidin 3-glucoside,
a key reaction for coloring in anthocyanin biosynthesis. J Biol
Chem, 276 (28): 25797–25803
Nakatsuka A, Mizuta D, Kii Y, Miyajima I, Kobayashi N (2008). Iso-lation and expression analysis of ? avonoid biosynthesis genes in ever g reen azalea. Sci Hortic, 118 (4): 314–320
Nakatsuka T, Saito M, Sato-Ushiku Y, Yamada E, Nakasato T, Hoshi N, Fujiwara K, Hikage T, Nishihara M (2012). Development of DNA markers that discriminate between white- and blue-? owers in Japanese gentian plants. Euphytica, 184 (3): 335–344 Nakatsuka T, Yamada E, Saito M, Fujita K, Nishihara M (2013). Het-erologous expression of gentian MYB1R transcription factors suppresses anthocyanin pigmentation in tobacco ? owers. Plant Cell Rep, 32 (12): 1925–1937
Pu XX, Luo XP, Bai YC, Li CL, Chen H, Wu Q (2014). Gen e cloning of anthocyanin synthase in Fagopyrum dibotrys and correlation between its expression level and anthocyanin content. Chin Trad Herb Drug, 45 (7): 985–989 (in Chinese with English abstract) [卜星星, 雒晓鹏, 白悦辰, 李成磊, 陈惠, 吴琦(2014). 金荞麦花青素合酶基因的克隆及其表达与花青素量的相关性研究. 中草药, 45 (7): 985–989]Qi XW, Shuai Q, Fan L, Zeng QW, Xiang ZH, He NJ (2013). Molec-ular cloning and expressional pattern of anthocyanidin synthase gene in two mulberry species with different fruit colors. Sci Ser-ic, 39 (1): 5–13 (in Chinese with English abstract) [亓希武, 帅琴, 范丽, 曾其伟, 向仲怀, 何宁佳(2013). 桑树花青素合成酶(ANS)基因的克隆及在2种果色桑树中的表达特征. 蚕业科学,
39 (1): 5–13]
Reddy AM, Reddy VS, Schef? er BE, Wienand U, Reddy AR (2007).
Novel transgenic rice overexpressing anthocyanidin synthase accumulates a mixture of ? avonoids leading to an increased anti-oxidant potential. Metab Eng, 9 (1): 95–111
Salvatierra A, Pimentel P, Moya-León MA, Herrera R (2013). In-creased accumulation of anthocyanins in Fragaria chiloensis fruits by transient suppression of FcMYB1 gene. Phytochemistry, 90: 25–36
Schaart JG, Dubos C, Romero De La Fuente I, van Houwelingen AMML, de V os RCH, Jonker HH, Xu WJ, Routaboul JM, Lep-iniec L, Bovy AG (2013). Identi? cation and characterization of MYB-bHLH-WD40 regulatory complexes controlling proantho-cyanidin biosynthesis in strawberry (Fragaria×ananassa) fruits.
New Phytol, 197 (2): 454–467
Shi SG, Li SJ, Kang YX, Liu JJ (2015). Molecular characterization and expression analyses of an anthocyanin synthase gene from Magnolia sprengeri Pamp. Appl Bioch Biotechnol, 175 (1): 477–488
Song M, Sun ZJ, Tang QL , Wang ZM, Ren XS (2012). Studies on an-thocyanin accumulation and related gene expression in big-head mustard [Brassica juncea (L.) Czern. et Coss. var. megarrhiza Tsen et Lee] induced by environmental stress. Chin Veg, (6): 27–34 (in Chinese with English abstract) [宋明, 孙梓健, 汤青林, 王志敏, 任雪松(2012). 环境胁迫下大头芥花青素积累及其相关结构基因的表达. 中国蔬菜, (6): 27–34]
Sun HY (2015) . Cloning of VwANS, VwF3'H and expression analysis of VwANS, VwDFR in pansy [Master’s thesis]. Haikou: Hainan University (in Chinese with English abstract) [孙海燕(2015). 三色堇VwANS和VwF3'H基因克隆及VwANS和VwDFR基因表达分析[硕士论文]. 海口: 海南大学]
Sun Y (2013). Study on anthocyanin biosynthetic and response to growth regulator in developing fruit of blueberry ]Mast e r’s thesis]. Beijing: Beijing Forestry University (in Chinese with English abst r act)[孙莹(2013). 蓝莓花青苷合成及对生长调节剂的响应[硕士论文]. 北京: 北京林业大学]
Sun ZJ (2010). Cloning and expression analysis of anthocyanin bio-synthesis genes in red-leaf mustard [Master’s thesis]. Chongq-ing: Southwest University (in Chinese with English abstract) [孙梓健(2010). 红叶芥花青素合成途径结构基因的克隆及表达分析[硕士论文]. 重庆: 西南大学]
Tang XJ, Han KT, Hu K, Meng L, Dai SL (2012). Cloning and tran-sient expression assay of CmDFR and CmANS promoters in an-thocyanin pathway from Chrysanthemum×morifolium. Biotech Bull, (5): 81–88 (in Chinese with English abstract) [唐杏姣, 韩科厅, 胡可, 孟丽, 戴思兰(2012). 菊花CmDFR与CmANS基因启动子序列克隆与瞬时表达分析. 生物技术通报, (5): 81–88] Wang L (2015). Regulation mechanism of anthocyanin biosynthesis
植物生理学报826
branch pathways in Senecio cruentus [Master’s thesis]. Beijing: Beijing Forestry University (in Chinese with English abstract) [王璐(2015). 瓜叶菊花青素苷合成分支途径的调控机制[硕士论文]. 北京: 北京林业大学]
Wang LH (2014). Study on t he anthocyanins metabolism and the regulation of relative genes in the fruit of apple (Malus pumila Mill.)[PhD thesis].Beij i ng:C hina Agricultural Universi t y(in Chinese with English abstract) [王丽辉(2014). 苹果果皮花色苷代谢及相关基因调控的研究[博士论文]. 北京: 中国农业大学] Wang XQ (2015). Phenolic metabolism of red-? eshed apples and its response to stress [PhD thesis]. Yangling: Northwest A & F Uni-versity (in Chinese with English abstract) [汪晓谦(2015). 红肉苹果酚类代谢及其对逆境的响应研究[博士论文]. 杨凌: 西北农林科技大学]
Wang ZM (2012). Identi? cation and functional a nalysis of miRNAs involved in cotton ? ber initiation [PhD thesis]. Beijing: Tsinghua University (in Chinese with English abstract) [王正明(2012). 棉花纤维细胞起始期相关miRNA的鉴定与功能研究[博士论文]. 北京: 清华大学]
Xu F (2008). Cloning and expression of GbP AL and GbANS genes and effect of ALA on the content of ? avonoids in Ginkgo biloba [PhD thesis]. Tai'an: Shandong Agricultural University (in Chinese with English abst r act) [许锋(2008). 银杏GbP AL和GbANS基因的克隆与表达及ALA对类黄酮含量的影响[博士论文]. 泰安: 山东农业大学]
Xu ZR, Li CL, Cui GX, Sun Y, Li YH (2009). Cloning, sequence analysis and expression of anthocyanidin synthase gene in tur-ni p. Lett Biotechnol, 20 (1): 66–68, 74 (in Chinese with English abstracta) [许志茹, 李春雷, 崔国新, 孙燕, 李玉花(2009). 芜菁花青素合成酶基因的克隆、序列分析及表达. 生物技术通讯,
20 (1): 66–68, 74]
Xu ZR, Li YH (2006a). Expression of the genes involved in anthocy-anidin biosynthesis of ‘Tsuda’ turnip. J Plant Physiol Mol Biol,
32 (5): 583–586 (in Chinese with English abstract) [许志茹, 李
玉花(2006a). ‘津田芜菁’花色素苷生物合成相关基因的表达.
植物生理与分子生物学学报, 32 (5): 583–586]
Xu ZR, Li YH (2006b). Screening the genes associated with antho-cyanin biosynthesis in roots of ‘Tsuda’ turnip using cDNA mi-croarray. Hereditas, 28 (9): 1101–1106 (in Chinese with English abstract) [许志茹, 李玉花(2006b). 利用cDNA微阵列分离津田
芜菁花青素生物合成相关基因. 遗传, 28 (9): 1101–1106] Zhang B (2011). Study on the mechanism of the regulation of the anthocyanin biosynthesis in Brassica [PhD thesi s].Chongqing: Chongqing University (in Chinese with English abstract) [张彬(2011). 芸薹属植物花青素生物合成代谢途径调控机制的研究[博士论文]. 重庆: 重庆大学]
Zhang B, Yin MQ, Wen YY, Zhao J, Wang JP, Wang YG (2014).
Expression features of the anthocyanin biosynthetic structural genes in kale. J Shanxi Agric Sci, 42 (4): 313–316 (in Chinese with English abstract) [张彬, 尹美强, 温银元, 赵娟, 王计平, 王玉国(2014). 羽衣甘蓝花青素合成途径结构基因的表达特性.
山西农业科学, 42 (4): 313–316]
Zhang C (2014). Molecular mechanism of glucose regulating anthocy-anin biosynthesis of tree peony cut ? ower [PhD thesis]. Beijing: Beijing Forestry University (in Chinese with English abstract) [张超(2014). 葡萄糖调控牡丹切花花青素苷合成的分子机理[博士论文]. 北京: 北京林业大学]
Zhang JL (2008). Study on the formation of ? ower color from orna-mental sunflower (Helianthus annuus) [PhD thesis]. Fuzhou: Fujian Agriculture and Forestry University (in Chinese with En-glish abstract) [张剑亮(2008). 观赏向日葵花色形成的机理研究[博士论文]. 福州: 福建农林大学]
Zhao RR, Jiang M, He CM, Zhu YQ, Zhou M (2010). Isolation and sequence analysis of anthocyanidin synthase gene BaANS from Brassica albograbra. Acta Agric Zhejianggensis, 22 (2): 161–166 (in Chinese with English abstract) [赵蓉蓉, 蒋明, 贺蔡明, 朱雅琴, 周敏(2010). 芥蓝Brassica albograbra花青素合成酶基因BaANS的克隆与序列分析. 浙江农业学报, 22 (2): 161–166 ] Zhao ZC, Hu FC, Huang JF, Hu GB, Yang ZY, Xiao J (2012). Cloning and sequence analysis of ANS gene from Litchi chinensis. North-ern Hortic, (19): 118–121 (in Chinese with English abstract) [赵志常, 胡福初, 黄建峰, 胡桂兵, 杨转英, 肖靖(2012). 荔枝ANS 基因的克隆及其序列分析. 北方园艺, (19): 118–121]
Zhou SM, Wang LP, Xiang X, Wei BH, Li LZ, Li YR, Fang FX, Cao JS (2009). Cloning and molecular characteristics of ANS gene and its correlations with anthocyanin accumulation in yam. Acta Hortic Sin, 36 (9): 1317–1326 (in Chinese with English abstract) [周生茂, 王玲平, 向珣, 韦本辉, 李立志, 李杨瑞, 方锋学, 曹家树(2009). 山药ANS基因的克隆和分子特性及其与花青素积累的关系. 园艺学报, 36 (9): 1317–1326]
李小兰等: 植物花青素合成酶ANS基因的研究进展827
The research progress on plant anthocyanin synthetase ANS gene
LI Xiao-Lan, ZHANG Ming-Sheng*, Lü Xiang
School of Life Sciences, Key Laboratory of Plant Resources Conservation and Germplasm Innovation in Mountainous Region (Ministry of Education), Guizhou University, Guiyang 550025, China
Abstract: Anthocyanin synthase (ANS) is a key enzyme at the end of plant anthocyanin biosynthetic pathway, which catalyzes leucoanthocyanins into anthocyanins. In this paper, we review the structure and function of ANS genes, so that to provide some reference data for relate to ANS cloning and its functional analysis, to ex-plore the molecular regulatory mechanism of anthocyanin synthesis, to develop and utilize anthocyanin based on a lot of plants.
Key words: anthocyanin synthetase; gene function; expression regulation; anthocyanin; adversity stress
Received 2016-04-14 Accepted 2016-05-28
This work was supported by the Project of High-level Innovative Talents in Guizhou (Grant No. [2015]4031) and the Project of Systemic Con-struction on Education Innovation Base of Graduate Student in Guizhou (Grant No. CXJD [2014]001).
Corresponding author (E-mail: mshzhang@https://www.wendangku.net/doc/0b5941051.html,).
第十四章原发性醛固酮增多症
第十四章原发性醛固酮增多症 概述 原发性醛固酮增多症(primary aldoste-ronism)是导致顽固性高血压最常见的继发性高血压病因之一。该疾病是由于肾上腺皮质发生病变从而分泌过多醛固酮,导致钠水潴留,血容量增多,肾素-血管紧张素的活性受抑制,典型临床表现为顽固性高血压、低血钾为主要特征的综合症。大多数是由肾上腺醛固酮腺瘤引起,也可能是特发性醛固酮增多症以及其他原因等。 流行病学 原醛是临床常见的继发性高血压的主要病因之一。早于20世纪40年代人们已经证明肾上腺有一种具有潴钠作用的物质,1953年分离出醛固酮,1955年合成了这一激素。同年,Conn对一位34岁女性高血压、低血钾患者。否定了“失钾性肾炎”的诊断,而提出是有肾上腺皮质腺瘤分泌醛固酮增多所致,并得到了手术证实。Conn首先发现并报道这一种内分泌高血压类型,并命名为原发性醛固酮增多症,故又称Conn综合症。Conn早年曾推测约20%高血压由原发性醛固酮增多症所致,但以后在美国其发病率占同期高血压患者的0.05%~2%,上海瑞金医院于1957~1989年共收治原醛症314例,占同期住院患者的2%。但随着肾上腺生理、生化及高精检出技术的进步,精确的实验室检查和先进的影像学诊断以及人们对该病认识的提高,使肾上腺疾病的诊断与治疗,更加容易和有效,偶发瘤患者检出率明显提高,肾上腺疾病所致的继发性高血压患病率有上升趋势,有外国学者已经提出,原醛已经成为继发性高血压中除肾脏病以外最常见的原因,其发生率可达15%~20%。按此比例推算在中国有高血压患者近1.3亿,其中应该约有1%的原醛患者,则应有130万,这部分患者大部分是可以治愈的高血压,因此早期诊断,早期治疗极其重要。该症发病年龄高峰为30~50岁,女性较男性多见。 病因及病理 根据病因病理变化和生化特征,原醛可分为以下5型: 1、肾上腺醛固酮腺瘤(aldosterone-producing adenoma,APA)发生在肾上腺皮质球状带并分泌醛固酮的良性肿瘤,即经典的Conn综合征。是原醛的主要病因,临床最多见的类型,占65%~80%,以单一腺瘤最多见,左侧多于右侧,双侧或多发性腺瘤仅占10%;个别患者可一侧是腺瘤,另一侧增生。肿瘤多为圆形或卵圆形,与周围组织有明显的边界,腺瘤主要由大透明细胞组成,这种细胞比正常束状带细胞大2~3倍。光镜下显示肾上腺皮质球状带细胞、网状带或致密细胞,以及大小不同的杂合细胞。杂合细胞表现了球状带和束状带细胞的特点,有些腺瘤细胞可同时存在球状带细胞弥漫增生。电镜下瘤细胞的线粒体嵴呈小板状,显示球状带细胞的特征。醛固酮瘤的成因不同,患者血浆醛固酮水平浓度与血浆ACTH 的昼夜节律呈平行关系,而对血浆肾素变化无明显反应。此型患者其生化异常及临床表现较其他类型典型。 2、特发性醛固酮增多症(idiopathic hyper-aldosteronism,IHA),即特发性肾上腺皮质增生,发病率占成人原醛症的10~30%,占儿童原醛症之首。近年来发病率有增加的趋势。
【免费下载】真菌基因组学研究进展
真菌基因组学研究进展 真菌为低等真核生物,种类庞大而多样。据估计,全世界约有真菌150万种,已被描述的约8万种。真菌在自然界分布广泛,存在于土壤、水、空气和生物体内外,与人类生产和生活有着非常密切的关系。许多真菌在自然界的碳素和氮素循环中起主要作用,参与淀粉、纤维素、木质素等有机含碳化合物及蛋白质等含氮化合物的分解。有些真菌如蘑菇、草菇、木耳、麦角、虫草、茯苓等可直接供作食用和药用,或在发酵工业、食品加工业、抗生素生产中具有重要作用。然而,也有些种类引起许多植物特别是重要农作物的病害,如水稻稻瘟病、小麦锈病、玉米腥黑穗病、果树病害等。少数真菌甚至是人类和动物的致病菌,如白色假丝酵母Candida albicans等。因此,合理利用有益真菌,控制和预防有害 真菌具有重要意义。 本文整理了已完成基因组序列测定的真菌的信息,并对真菌染色体组的历史、测序策略及其基因组学的研究进展进行了评述。 1真菌染色体组的研究历史和资源 1986年美国科学家Thomas Rodefick提出基因组学概念,人类基因组计划带动了模式生物和其它重要生物体基因组学研究。阐明各种生物基因组DNA中碱基对的序列信息及破译相关遗传信息的基因组学已经成为与生物学和医学研究不可分割的学科。由欧洲、美国、加拿大和日本等近百个实验室六百多位科学家通力合作,1996年完成第一个真核生物酿酒酵母Saccharomyces cerevisiae的基因组测序,这 对于酵母菌类群来说是一个革命性的里程碑,并且激起了真核基因功能和表达的第一次全球性研究(Goffeau etal,1996)。随后粟酒裂殖酵母Schizosaccharomyces pombe(Wood etal.2002)和粗糙脉孢 霉Neurospora crassa(Galagan etal.2003)染色体组的完成显露出酿酒酵母作为真菌模式生物的局限性。尽管如此,真菌染色体组测序的进展最初是缓慢的。为加快真菌染色体组研究的步伐,2000年由 美国Broad研究所与真菌学研究团体发起真菌基因组行动(fungal genome initiative,FGI),目的是 促进在医药、农业和工业上具有重要作用的真菌代表性物种的基因组测序。2002年2月FGI发表了第 一份关于测定15种真菌基因组计划的白皮书。2003年6月,真菌基因组行动发表了第二份白皮书,列 出了44种真菌作为测序的目标,强调对其中10个属即青霉属Penicillium、曲霉属Aspergillus、组 织胞浆菌属Histoplasma、球孢子菌Coccidioides、镰刀菌属Fusarium、脉孢菌属Neurospora、假丝 酵母属Candida、裂殖酵母属Schizosaccharomyces、隐球酵母属Cryptococcus和柄锈病菌属Puccin& 的物种优先进行测序。之后,经过FGI、法国基因组学研究项目联(G6nolevures Consortium)、美国能 源部联合基因组研究所(The DOE Joint Genome Institute,JGI)DOE联合基因组研究所、基因组研究 院(The Institute for Genomic Research,TIGR)、英国The Wellcome Trust Sanger InstimteSanger和华盛顿大学基因组测序中心等共同努力;得到包括美国国家人类染色体研究所、国 家科学基金会、美国农业部和能源部等的资助,也有来自学术界和产业集团如著名的 Monsanto、Syngenta、Biozentrum、Bayer Crop Science AG和Exelixis等公司的持续合作,在最近 的几年里,真菌基因组学研究取得重大突破。至2008年6月1日,共有3734种生物的全基因组序列测定工作已经完成或正在进行,公开发表812个完整的基因组,其中,70余种真菌基因组测序工作已经 组装完成或正在组装,分别属于子囊菌门、担子菌门、接合菌门、壶菌门和微孢子虫(Microsporidia) 的代表。此外,还有Ajellomyces dermatitidis和Antonospora locustae等20余种真菌基因组序列 正在测定中(Bemal etal.2001)。这些真菌都是重要的人类病原菌、植物病原菌、腐生菌或者模式生物,基因组大小为2.5—81.5Mb,包含酵母或产生假菌丝的酵母、丝状真菌,或者具有二型性(或多型性) 生活史的真菌,拥有与动物和植物细胞一样的的细胞生理学和遗传学特征,包括多细胞性、细胞骨架结
植物花青素合成酶ANS基因的研究进展
植物生理学报 Plant Physiology Journal 2016, 52 (6): 817–827 doi: 10.13592/https://www.wendangku.net/doc/0b5941051.html,ki.ppj.2016.0162817 收稿 2016-04-14 修定 2016-05-28 资助 贵州省高层次创新型人才培养计划(黔科合人才[2015] 4031号)和贵州省研究生教育创新基地建设(黔教研合CXJD 字[2014]001)项目。 * 通讯作者(E-mail: mshzhang@https://www.wendangku.net/doc/0b5941051.html,)。 植物花青素合成酶ANS 基因的研究进展 李小兰, 张明生*, 吕享 贵州大学生命科学学院, 山地植物资源保护与种质创新省部共建教育部重点实验室, 贵阳550025 摘要: 花青素合成酶ANS 是植物花青素生物合成途径末端的关键酶, 催化无色花色素转变为有色花青素。 本文通过对ANS 基因结构和功能进行综述, 旨在为更多植物ANS 基因的克隆及功能分析、花青素合成分子调控机制探索、花青素的开发利用等提供参考资料。 关键词: 花青素合成酶; 基因功能; 表达调控; 花青素; 逆境胁迫 花青素是植物次生代谢产物, 属于黄酮类水溶性天然色素, 主要以糖苷形式存在于表皮细胞的液泡中, 使植物的花、果实、种皮等器官呈现红、蓝、紫等颜色(顾林等2007; 张彬2011)。花青素具有多种生理功能, 对植物自身方面, 能吸引昆虫传粉、防止植物受紫外辐射、保护DNA 不受破坏、使细胞分化、抵御低温、防止病害以及使生命过程正常进行等; 对人类健康方面, 具有抗氧化、抗突变、预防心脑血管疾病、保护肝脏、抑制肿瘤细胞发生等多种生理功能(张彬2011)。无色花青素双加氧酶/花青素合成酶(leucoanthocyanidin dioxygenase/anthocyanidin synthase, LDOX/ANS)是植物花青素生物合成途径末端的关键酶, 催化无色花色素到有色花色素的转变(亓希武等2013; Jaakola 2013; Nakajima 等2001)。目前, 已经从多种植物中分离出了ANS 基因, 如芜菁(Brassica camp-estris ssp. rapa ) (许志茹等2009)、山药(Dioscorea spp.) (周生茂等2009)、桑树(Morus atropurputea ) (亓希武等2013)、芥蓝(Brassica albograbra ) (赵蓉蓉等2010)、金荞麦(Fagopyrum dibotrys ) (卜星星等2014)等。ANS 基因的功能研究不仅对园艺、植物保护方面有重要的价值, 对人类的健康也具有显著意义。本文对植物花青素合成酶ANS 的基因结构和功能进行介绍, 其中基因结构方面的内容可为克隆其他植物ANS 基因提供参考依据, ANS 基因的表达调控方面的内容可为ANS 基因的功能研究提供线索和途径。此外, 通过本综述可发现目前ANS 基因研究的薄弱环节, 为全面解析ANS 基因的功能及调控机制提供更多有利思路, 从而为探索花青素合成分子调控机制及进行花青素的开发利用等提供参考资料。1 ANS 基因结构 植物ANS 基因的开放阅读框ORF 普遍大于 1 000 bp, 基因序列含有1个或2个内含子, 启动子区具有基本启动子元件、转录因子结合元件、环境响应结合元件等, 其蛋白具有依赖Fe 2+的2-酮戊二酸[2OG-Fe(II)]双加氧酶家族基因的结构域(表1)。从启动子区域具有的响应元件可以推知, ANS 基因可能参与植物抵御逆境胁迫的应答和参与植物激素代谢通路, 其表达受MYB 类转录因子的调控; 从保守结构域可知, ANS 蛋白具有双加氧酶的功能, 是2OG-Fe(II)双加氧酶家族成员之一; 而ORF 长度和基因序列特征可为其他植物的ANS 基因克隆提供参考依据。 2 ANS 基因功能 目前, 对ANS 基因功能方面的研究主要集中在表达特性分析、过表达分析、miRNA 介导的基因沉默以及ANS 的表达调控等方面。2.1 ANS 的表达特性 经研究发现, ANS 基因在多种植物中普遍存在, 其表达在植物的组织中、组织的不同发育时期及不同品种中都具有特异性, 分别为组织特异性、时期特异性和品种特异性。 ANS 表达的组织特异性显示其在多个组织中均有表达, 但在各组织中的表达量各不相同。可可(Theobroma cacao )中TcANS 在叶、花、豆荚皮及种子中均有较高的表达(Liu 等2013)。而甘薯(Ipomoea batatas )的IbANS 在所有组织中均有不同程度的表达, 但块根及周皮中表达量更高(Liu 等2010); 金荞麦FdANS 在花期不同组织中的表达量分析显示花>叶>茎>根(卜星星等2014); 结楼草(Zoysia japonica )
基因敲除技术研究进展
兰州交通大学化学与生物工程学院综合能力训练Ⅰ——文献综述 题目:基因敲除技术研究进展 作者:王振宇 学号:201207744 指导教师:谢放 完成日期:2014-7-16
基因敲除技术研究进展 摘要基因敲除是自20世纪80年代末以来发展起来的一种新型分子生物学技术,是通过一定的途径使机体特定的基因失活或缺失的技术。在总结已有研究成果的基础上,本文对基因敲除技术的概况、原理方法应用以及近年来基因敲除技术的研究进展作一个简单的综述。 关键词基因敲除 RNA i生物模型基因置换基因打靶同源重组1. 基因敲除技术简介 基因敲除(Gene knockout)是指一种遗传工程技术,针对某个序列已知但功能未知的序列,改变生物的遗传基因,令特定的基因功能丧失作用,从而使部分功能被屏障,并可进一步对生物体造成影响,进而推测出该基因的生物学功能。 它克服了随机整合的盲目性和偶然性,是一种理想的修饰、改造生物遗传物质的方法。基因敲除借助分子生物学、细胞生物学和动物胚胎学的方法,通过胚胎干细胞这一特殊的中间环节将小鼠的正常功能基因的编码区破坏,使特定基因失活,以研究该基因的功能;或者通过外源基因来替换宿主基因组中相应部分,以便测定它们是否具有相同的功能,或将正常基因引入宿主基因组中置换突变基因以达到靶向基因治疗的目的。基因敲除是揭示基因功能最直接的手段之一。通常意义上的基因敲除主要是应用DNA同源重组原理,用设计的同源片段替代靶基因片段(即基因打靶),从而达到基因敲除的目的。随着基因敲除技术的发展,除了基因打靶技术外,近年来新的原理和技术也逐渐被应用,比较成功的有RNA干扰技术,同样也可以达到基因敲除的目的。简单的说基因敲除是指将目标基因从基因组中删除。基因敲除技术主要应用于动物模型的建立,而最成熟的实验动物是小鼠,对于大型哺乳动物的基因敲除模型还处于探索阶段。这项技术的诞生可以说是分子生物学技术上继转基因技术后的又一革命。尤其是条件性、诱导性基因打靶系统的建立,使得对基因靶位时间和空间上的操作更加明确、效果更加精确、
植物基因功能研究方法的新进展
植物基因功能诠释研究方法的新进展 (东北农业大学,150030) 摘要:本文通过阅读大量的文献,总结了植物基因功能注释研究方法的最新进展。对每种方法的原理及优缺点做了综述,拟供初学者和作相关研究者参考。 关键词:基因功能;研究方法;新进展 基因组研究应该包括两方面的内容:以全基因组测序为目标的结构基因组学(struc tural genomics)和以基因功能鉴定为目标的功能基因组(functional genomics)。结构基因组学代表基因组分析的早期阶段,以建立生物体高分辨率遗传、物理和转录图谱为主。功能基因组学代表基因分析的新阶段,是利用结构基因组学提供的信息系统地研究基因功能,它以高通量、大规模实验方法以及统计与计算机分析为特征。功能基因组学(functional genomics)又往往被称为后基因组学(postgenomics),它利用结构基因组所提供的信息和产物,发展和应用新的实验手段,通过在基因组或系统水平上全面分析基因的功能,使得生物学研究从对单一基因或蛋白质的研究转向多个基因或蛋白质同时进行系统的研究。[1,2]这是在基因组静态的碱基序列弄清楚之后转入基因组动态的生物学功能学研究。研究内容包括基因功能发现、基因表达分析及突变检测。基因的功能包括:生物学功能,如作为蛋白质激酶对特异蛋白质进行磷酸化修饰;细胞学功能,如参与细胞间和细胞内信号传递途径;发育上功能,如参与形态建成等采用的手段包括经典的减法杂交,差示筛选,cDNA代表差异分析以及mRNA差异显示等,但这些技术不能对基因进行全面系统的分析。新的技术应运而生,包括基因表达的系统分析,cDNA微阵列,DNA芯片等。鉴定基因功能最有效的方法是观察基因表达被阻断或增加后在细胞和整体水平所产生的表型变异,因此需要建立模式生物体。 自华大基因启动“千种动植物基因组参考序列谱构建计划”和“千种植物转录组研究”以来,已完成水稻、黄瓜、马铃薯、白菜等植物的基因组序列图谱绘制,并通过对大豆的重测序研究建立了高密度分子标记图谱。这将是21世纪生命科学研究的重要领域。[3]本文将对研究基因功能的新技术及其新进展作一综述。 1 利用生物信息学方法分析基因的功能 生物信息学是利用生物信息学和电子技术(互联网技术)寻找并克隆新的未知功能的基因,着重于技术和操作层面,利用生物信息学对新基因进行电子克隆,及克隆该新基因的序列后对其进行简单的功能分析,如基因的编码区、启动子区、内含子/外显子、翻译启始位点和翻译终止信号预测,基因的同源比对,编码的氨基酸辨识蛋白质,蛋白质的物理性质,蛋白质的二级/三级结构、特殊局部结构以及功能预测等[4]。 1.1 通过序列比对预测基因功能
转基因作物的研究进展
生物与环境工程学院课程论文 转基因作物的研究进展 学生姓名:魏斌聪 学号:200806016139 专业/班级:生物工程081班 课程名称:生物工程原理 指导教师:陈蔚青教授 浙江树人大学生物与环境工程学院 2011年5月
转基因作物的研究进展 魏斌聪 (浙江树人大学生物与环境工程学院生工081班浙江杭州310015) 摘要:人们将所需要的外源基因(如高产、抗病虫害优质基因) 定向导入作物细胞中, 使其在新的作物中稳定遗传和表现,产生转基因作物新品种, 是大幅度提高作物产量的一项新技术。本文先描述了转基因作物的发展进程,对其基因问题的研究作了讨论,并列出转基因作物目前存在的主要问题并作分析,最后对此项技术作出展望。 关键词:转基因作物;DNA技术;基因导入;安全性 前言 转基因植物(transgenic plant),是指基因工程中运用DNA 技术将外源基因整合于受体植物基因组、改变其遗传组成后产生的植物及其后代。转基因植物的研究主要在于改进植物的品质,改变生长周期等提高其经济价值或实用价值。[ 1 ]其主要范围是在作物方面,如可食用的大豆、玉米等,或者可投入生产的棉花等作物。 从表面上看来,转基因作物同普通植物似乎没有任何区别,它只是多了能使它产生额外特性的基因。从1983年以来,生物学家已经知道怎样将外来基因移植到某种植物的脱氧核糖核酸中去,以便使它具有某种新的特性:抗除莠剂的特性,抗植物病毒的特性,抗某种害虫的特性。[ 2 ]这个基因可以来自于任何一种生命体:细菌、病毒、昆虫等。这样,通过生物工程技术,人们可以给某种作物注入一种靠杂交方式根本无法获得的特性,这是人类9000年作物栽培史上的一场空前革命。[ 3 ] 1 转基因作物的发展进程 转基因作物的研究最早始于20世纪80年代初期。1983年,全球第一例转基因烟草在美国问世。1986年,首批转基因抗虫和抗除草剂棉花进入田间试验。1996年,美国最早开始商业化生产和销售转基因作物(包括大豆、玉米、油菜、
醛固酮增多症
醛固酮增多症
醛固酮增多症 醛固酮(aldosterone)是肾上腺皮质球状带分泌的最重要的盐皮激素,在维持机体钠平衡中起着十分重要的作用。醛固酮分泌过多导致钠潴留和钾丢失,称为醛固酮增多症(hyperaldosteronism,aldosteronism),分为原发性和继发性两类。若因肾上腺以外的原因使有效血容量降低,肾血流量减少等引起肾素-血管紧张素-醛固酮系统功能亢进者,则称为继发性醛固酮增多症(简称继醛);而由于肾上腺皮质腺瘤或增生,分泌过多的醛固酮,导致水钠潴留,体液容量扩增导致血压升高并抑制肾素-血管紧张素系统者,称为原发性醛固酮症增多症(简称原醛)。本章主要讨论原发性醛固酮增多症。1955年,ConnJW报道了第一例由肾上腺腺瘤所引起的原发性醛固酮增多症,故本症又称为Conn综合征。本病的发病率在未经选择的高血压患者中<1%。多见于成人,腺瘤者女性较男性多见,特发性等其他病因者男性多于女性。各种年龄儿童也可发生原醛,并可出现生长迟缓,病因为腺瘤者其年龄通常低于特发性者。 【病因】 多种原因可致原发性醛固酮增多症,其临床类型与相对发病率见下表。 1.分泌醛固酮的肾上腺皮质腺瘤分泌醛固酮的肾上腺皮质腺瘤 (aldosterone-producingadenoma,APA)又称Conn综合征,最多见,约占原醛症的60%~90%。多为单侧腺瘤,左侧较右侧多见;大多数为单个,直径多在2cm以下,包膜完整,切面呈金黄色,在光镜下可见四种细胞:小和大的具有球状带和束状带细胞特征的杂交细胞以及其他的如同束、球状带的细胞,在电镜下,瘤细胞具有如同球状带细胞特征的线粒体管状嵴,若经螺内酯治疗后可发现螺内酯小体,常同时伴球状带增生或伴结节性增生。仅1%左右为双侧或一侧有2个以上腺瘤。70%的腺瘤见于女性,腺瘤形成的原因至今不明。 2.特发性原醛症(IHA)本型的肾上腺球状带通常为弥漫性或局灶性增生,超微结构基本正常,若伴有结节则多为微小结节,直径不一,可大致2cm,典型的细胞呈现来自束状带的透明样细胞。免疫组化研究表明:这些细胞均显示对细胞
进化基因组学研究进展
研究进化基因组学进展 摘要:进化基因组学是利用基因组数据研究差异基因功能、生物系统演化、从基因在水平探索生物进化的学科。随着近年来基因组数据的不断增加,进化基因组学得到了长足的发展。进化基因组学主要包括从基因组水平理解和诠释生物进化和新基因分析研究探索两方面的内容。本文介绍了进化基因组学研究的主要内容和较为常用的方法,以及近年来在细菌、酵母、果蝇进化基因组学方面的研究进展。 关键词:进化基因组学系统进化比较基因组学新基因 正文 随着基因测序技术的不断进步以及基因组学的飞速的发展,人们积累了大量的基因组学数据,利用所得的大量的基因组数据与进化生物学相结合,在基因组水平研究生物进化机制,随即产生了进化基因组学。 近年来进化基因组学取得了长足的进展,在研究差异基因功能、生物系统演化、从基因在水平探索生物进化的终极方式等方面有重大突破,对人类理解生命现象和过程有重要作用。 研究系统进化学通常包括两个关键步骤:一方面,在不同物种中鉴定同源性特佂,另一方面利用构建系统进化树的方法比较这些特征,进而重新构建这些物种的进化历史[1]。针对这两个关键步骤,传统系统进化学,常采用基于形态学数据和单个基因研究的同源性状鉴定和重建系统进化树(常包括距离法、最大简约法、概率法)[1]的方法来研究。在目前拥有丰富基因组数据的条件下,我们可以分析基因组数据,利用进化基因组学研究系统进化。 一、目前进化基因组学的研究内容主要集中于两个方面:(1)在比较不同生物的基因数据的基础上,从基因组水平理解和诠释生物进化;(2)通过对新基因的分析研究探索基因进化过程的规律两个方面。在进行全基因组进化分析方面,进化基因组学主要集中于构建系统进化树、研究基因组进化策略、研究生物功能变化和进化机制、进化和生态功能基因组学、基因注释的等方面;在新基因方面
植物功能组研究进展
程论文(作业)封面(2011 至2012 学年度第 2 学期)课程名称:_ ___ 课程编号:___________ 学生姓名:__ ________ 学号:_______ 年级:__ ___________ 任课教师: _ ____________ 提交日期:年月日成绩:__________________ 教师签字:__________________ 开课---结课:第周---第周评阅日期:年月日
植物的功能基因组学研究进展 摘要:基因组研究计划包括以全基因组测序为目标的结构基因组学和以基因功能鉴定为 目标的功能基因组学两方面的内容。目前基因功能鉴定的方法主要有:基因表达的系统分析(SAGE) 、cDNA 微阵列、DNA(基因) 芯片、蛋白组技术以及基于转座子标签和T-DNA 标签的反求遗传学技术等。本文对上述各种技术的优缺点以及它们在植物基因功能鉴定中的应用进行了综述。 关键词:功能基因组学; 基因表达的系统分析;cDNA 微阵列;DNA 芯片;蛋白组 以拟南芥和水稻为代表的植物基因组研究已取得了迅速的进展,到目前为止,占拟南芥基因组(100Mb) 近三分之一的DNA 序列已被测定并在GenBank 数据库中登记注册,预期到2001 年通过全球合作将完成拟南芥全基因组的序列测定工作。随着植物基因组计划的实施和进展,GenBank 中累积了大量的未知功能的DNA 序列,如何鉴定出这些基因的功能将成为基因组研究的重点课题, 因此, 基因组研究应该包括两方面的内容: 以全基因组测序为目标的结构基因组学(structural genomics) 和以基因功能鉴定为目标的功能基因组研究, 后者往往又被称为后基因组研究。功能基因组研究的内容是利用结构基因组所提供的信息, 发展和应用新的实验手段系统地分析基因的功能〔1 〕。目前人类和酵母的功能基因组研究已经全面展开, 尤其是对已完成全基因组测序的酵母来说, 其功能基因组研究任务更加紧迫。植物的基因组研究虽然起步较晚, 但由于吸取了人类基因组研究中积累的一些经验, 所以进展也相当迅速, 对植物功能基因组学的研究目前也已经受到重视, 在1998 年12月出版的最新一期Plant Cell (10 :1771) 和Plant Physiol . (118 :713) 上均编发了关于植物功能基因组学研究的编者按, 并由Bouchez 和Hofte (1998) 〔2 〕综述了植物尤其是拟南芥功能基因组学研究的现状, 本文在此基础上综述了目前植物功能基因组学研究中使用的主要技术手段以及最新的研究进展。 1 基因功能的含义 基因的功能主要包括: 生物化学功能, 如作为蛋白质激酶对特异的蛋白质进行磷酸化修饰; 细胞学功能, 如参与细胞间和细胞内的信号传递途径; 发育上的功能, 如参与形态建成等。目前,获得一段DNA 序列的功能信息的最简单的方法是将该DNA 序列与GenBank 中公布的基因序列进行同源性比较,如利用BLASTn 和BLASTx 两种软件分别进行核苷酸和氨基酸序列同源性比较等。同源性比较的结果大体可以分为如下类型: 与生化和生理功能均已知的基因具同源性; 与生化功能已知的基因具同源性, 但该基因的生理功能未知;与其它物种中生化和生理功能均未知的基因具同源性; 虽与生化和生理功能均已知的基因具同源性, 但对该基因功能的了解尚不深入, 仍停留在表观现象上。上述同源性检索分析方法仅仅为该DNA 片段的功能提供了间接的证据,对基因功能的直接证据还需要实验上的数据。Bouchez 和Hofte (1998)〔2 〕将所需要的实验证据归纳如下: (1) 通过研究基因的时空表达模式确定其在细胞学或发育上的功能, 如在不同细胞类型、不同发育阶段、不同环境条件下以及病原菌侵染过程中mRNA 和/ 或蛋白质的表达的差异等。(2) 研究基因在亚细胞内的定位和蛋白质的翻译后调控等。(3) 利用基因敲除(knock - out) 技术进行功能丧分析或通过基因的过量表达(转基因) 进行功能获(gain2of2function) 分析,进而研究目的基因与表型性状间的关系。(4) 通过比较研究自发或诱发突变体与其野生型植株在特定环境条件下基因表达的差异来获取基因功能的可能信息。 2 植物的表达序列标记(EST) 与基因组大规模测序 通过从cDNA 文库中随机挑取的克隆进行测序所获得的部分cDNA 的5′或3′端序列称为表达序列标记( EST) ,一般长300~500bp 左右, 利用EST作为标记所构建的分子遗传图
转基因技术的研究进展
作物转基因技术的研究进展 摘要:作为生物技术领域的前沿,转基因技术已在多种植物上取得重大进展。本文主要介绍了当前作物转基因技术的三大主流方法:农杆菌介导法、基因枪介导法和花粉管通道法,并阐述了这几种转基因技术在水稻、小麦、棉花、玉米、大豆,甘薯等几种主要农作物的应用进展状况。 关键词:转基因技术、农作物、应用 Genetically Modified---转基因,简称GM,是指运用科学手段从某种生物体中提取所需要的基因,将其转入另一种生物中,使与另一种生物的基因进行重组,再从结果中进行数代的人工选育,从而获得特定的具有变异遗传性状的物质。而其衍生出的转基因技术就是将人工分离和修饰过的基因导入到目的生物体的基因组中,从而达到改造生物的目的,即把一个生物体的基因转移到另一个生物体DNA中的生物技术。 1983年比利时科学家Montagu 等人和美国Monsanto 公司Fraley等人分别将T- DNA上的致瘤基因切除并代之以外源基因,获得了世界上第一株转基因植株———转基因烟草。自此之后,作物转基因技术得到了迅速发展.截至目前,几乎所有的作物都开展了转基因研究,育种目标涉及到高产、优质、高效兼抗性及多用途等诸多方面.一批抗病、抗虫、抗逆、抗除草剂等转基因作物已进入商品化生产阶段. 国际农业生物技术应用服务组织2 月13 日在京发布的1 份报告显示,全球27 个国 家超过1800 万农民,2013 年种植转基因作物,种植面积比2012 年增加了500 万公顷。此外,首个具有耐旱性状的转基因玉米杂交品种亦于2013 年在美国开始商业化。 据该报告显示,全球转基因作物的种植面积于转基因作物商业化的18 年中增加了100 倍以上,从1996 年的170 万公顷增加到2013 年的1.75 亿公顷,其中美国仍是全球转基因作物的领先生产者,种植面积达7010 万公顷,占全球种植面积的40%。国际农业生物技术应用服务组织创始人兼荣誉主席、本年度报告作者Clive James 表示,目前排名前10 位的国家种植转基因作物的面积均超过100 万公顷,这为将来转基因作物的多样化持续发展打下了广泛基础。在种植转基因作物的国家中,有19 个为发展中国家,8 个为发达国家;发展中国家的种植面积连续2 年超越发达国家。 目前,作物遗传转化的方法有农杆菌介导法、基因枪法、电激法、PEG 法、脂质体法、低能离子束法、超声波介导法、显微注射法、花粉管通道法等.但在当前作物基因工程研究中,主要采用农杆菌介导法、基因枪法、花粉管通道法,这三种转基因技术也相对较为成熟. 一、农杆菌介导法 农杆菌介导法是指农杆菌侵染植物时,受到植物受伤后释放的酚类物质的刺激,活化质粒上Vir 区基因的表达,将质粒上的另一段DNA(T-DNA)共价整合到植物基因组上,在植物体内表达而改变植物的遗传特性。农杆菌介导法的转化效率受众多因素影响,如农杆菌侵染外植体的影响因素、外植体再生能力的内在因素和环境条件(pH、温度和光照条件)等[32],此法具有流程简单、仪器设备便宜、拷贝数低[33],且基因沉默少,转移的基因片段长等优点。 农杆菌介导法是获得第一个转基因植物的方法,迄今为止,农杆菌介导法获得的转基因植物占转基因植物总数85%,已成为植物基因转化首选方法。 二、基因枪介导法 基因枪法又称微弹轰击法,是将外源基因包裹在直径1~2 nm的钨或金颗粒表面,加速轰击植物外植体靶组织,穿过植物细胞壁和细胞膜而将外源基因带入植物细胞。因此,通过该方法进行DNA的转移过程不受外植体基因型的限制,可以将外源基因转移至几乎所有的植物细胞、组织器官和原生质体中。 最早的基因枪是由美国Cornel 大学的Sanford 等在1987 年研制成功的。目前基因枪介
原发性醛固酮增多症
原发性醛固酮增多症 原发性醛固酮增多症 100037 北京解放军304医院咸力明佟万仁 人民军医2003年第46卷第4期(总第521期) 原发性醛固酮增多症,简称原醛症,是因肾上腺皮质发生肿瘤或增生,使醛固酮分泌过多,以高血压、低血钾、肌无力、高醛固酮和低肾素活性为主要特征的综合征。 1 流行病学 原醛症是继发性高血压的原因之一,在高血压人群中的患病率为O.5%-2%。随着腹部B超、CT和MRI的广泛应用,许多无特征的病人也能被早期检出。Lim等从高血压465例中筛检出原醛症43例(占9.2%)。该症从新生儿至老人均可发病,但好发年龄为30-50岁,其发病率在性别中没有差别,腺瘤多见于女性,男女之比约为1:1.2-1.5,国外报告为1:2.3。 2 病因及病理 2.1 肾上腺皮质醛固酮分泌腺瘤(APA) 1955年由Conn首先描述,故又称Conn综合征,是原醛症主要病因,占70%一80%,绝大多数腺瘤位于一侧,左侧多于右侧,常为单个,仅1%左右为双侧或一侧有两个腺瘤,70%腺瘤见于女性。多数直径l-2cm,包膜完整,切面为桔黄色,均质实性,60%
-70%的腺瘤重量小于6g,光镜下显示为肾上腺皮质球状带、网状带或质密细胞,以及大小不同的“杂合细胞”。“杂合细胞”表现出球状带和束状带细胞的特点,有些腺瘤可同时存在球状带细胞弥漫性增生。电镜下可见瘤细胞内线粒体嵴为血小板。 2.2 特发性醛固酮增多症(IHA) 占成人原醛症的10% -20%,在儿童原醛症中最常见。其病理变化为双侧肾上腺球状带增生,伴或不伴结节,切面见肾上腺皮质增厚,厚度在0.15cm以上,光镜下可见大量透明细胞增生,多为弥漫性,偶为局灶性。组织学上具有肾上腺被刺激物质,即在人垂体中发现的一种糖蛋白和另一γ促黑素原相关因子,而醛固酮合成酶基因并无突变,但该基因表达增多且酶活性增加。2.3 原发性肾上腺皮质增生(PAH) 约占原醛症的1%。Kater等在1982年发现有4例介于APA和IHA之间的病例,其病理形态上与IHA相似,可为单侧或双侧增生,但生化特征与APA更相似,行肾上腺单侧或次全切除可纠正醛固酮过多的症状和生化异常。 2.4 糖皮质激素可抑制性醛固酮增多症(GRA) 又称地塞米松可抑制性醛固酮增多症(DSH),自1966年Sutherland报告以来,国内也有个例和家系报道。GRA发病年龄轻,有明显的家族发病倾向,为常染色体显性遗传性疾病。本病特点是,外源性ACTH可持续刺激醛固酮分泌,而小剂量地塞米松可
基因组学研究的应用前景
基因组学研究的应用前景摘要:基因组学是一门研究基因组的结构,功能及表达产物的学科,基因组的结构不仅是蛋白质,还有许多复杂功能的RNA,包括三个不同的亚领域,及结构基因组学,功能基因组学和比较基因组学。近几年,基因组学在微生物药物,细菌,病毒基因,营养基因方面都有进展,其前景是光明的。 关键词:基因研究未来结构 一、微生物药物产生菌功能基因组学研究进展 微生物药物是一类化学结构和生物活性多样的次级代谢产物,近年来多个产生菌基因组序列已经被测定完成,在此基础上开展的功能基因组研究方兴未艾,并在抗生素生物合成,形态分化,调控,发育与进化及此生代谢产物挖掘等方面有着新的发现,展现出广阔的研究前景,青霉素及其衍生的《》内酰胺类抗生素极大地改善了人类的卫生保健和生活质量,并促进研究人员不断对其工业生产菌株类黄青霉进行遗传改良和提高其产量,从而降低生产成本。经过60年的随机诱变筛选,当前青霉素产量至少提高了三个数量级,同时,青霉素的生物合成机理也得到了较为清晰的阐述,其pcbAB编码的非核糖体肽合酶ACVS~DPcbc编码的异青霉素N合成酶IPNS位于细胞质中,而苯乙酸COA连接酶PenDE编码的IPN酰基转移酶位于特殊细胞器一微体中。 研究发现,青霉素合成基因区域串联扩增,产黄青细霉胞中微体含量增加都可显著提高青霉素产量。然而随机诱变筛选得到的黄青霉工业菌株高产的分子机制尚不明确。为此,2008年荷兰研究人员联合国美国venter基因组研究所对黄青霉wisconsin54—1225进行了基因组测试和分析,并进一步利用DNA芯片技术研究了wisconsin54—1255及其高产菌株DS17690在培养基中是否添加侧链前体苯乙酸情况下的转录组变化,四组数据的比较分析发现,有2470个基因至少在其中一个条件下是差异表达的,根据更为严格的筛选标准,在PPA存在的条件下,高产菌相比测序菌株有307个基因转录是上调的,和生长代谢,青霉素前体合成及其初级代谢和转运等功能相关,另有271个基因显著下调,主要是与生长代谢及发育分化相关的功能基因。 二、乳酸菌基因组学的研究进展
植物花青素生物合成中的调控基因
植物生理学通讯 第42卷 第4期,2006年8月747 植物花青素生物合成中的调控基因 刘仕芸 黄艳岚 张树珍* 中国热带农业科学院热带作物生物技术研究所热带作物生物技术国家重点实验室,海口571101 Regulatory Gene of Anthocyanin Biosynthesis in Plant LIU Shi-Yun, HUANG Yan-Lan, ZHANG Shu-Zhen * State Key Laboratory of Tropical Crop Biotechnology, Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Science, Haikou 571101, China 提要 文章概述了植物花青素的生物合成途径,重点介绍了植物花青素调控基因在几个重要的模式植物中的调控特点及其调控机制。 关键词 花青素;生物合成途径;调控基因;调控机制 收稿2005-12-27修定 2006-06-22 * 通讯作者(E-mail: zhangsz@https://www.wendangku.net/doc/0b5941051.html,, Tel: 0898- 66892735)。 花青素(anthocyanin)是一类广泛地存在于植物中的水溶性天然色素,属类黄酮化合物。自然状态下花青素常与各种单糖形成花色苷,由于具有吸光性而表现出红色、紫色和蓝色等色彩。花青素由1个基本的结构母核和不同的取代基组成。其基本结构母核是2-苯基苯并吡喃,即花色基元,大多数花青素在花色基元的3'、5'、7'碳位上有取代羟基。由于B 环各碳位上的取代基不同(羟基或甲氧基),形成了各种各样的花青素。现在已知的有近50种,一般为6种花青素即天竺葵色素(pelargonidin)、矢车菊色素(cyanidin)、飞燕草色素(delphinidin)、芍药色素(peonidin)、牵牛色素(petunidin)和锦葵色素(malvidin)及其衍生物(Harborne 和Williams 2001)。大量研究表明,花青素具有抗氧化、抗突变、抗增生预防心脑血管疾病、保护肝脏、抑制肿瘤细胞发生等多种生理功能,其抗氧化效果分别是维生素C 、维生素E 的20倍和50倍,能清除氧自由基;有预防和治疗100多种疾病的作用(赵保路1999;张长贵等2006)。因此,花青素在开发天然色素、保健食品和天然抗氧化剂中有一定研究价值。1 花青素的生物合成途径 20世纪80年代末至90年代初,植物花青素和类黄酮物质代谢途径已较为清楚(Holton 和Cor-nish 1995),一般花青素的生物合成途径见图1。苯丙氨酸是花青素及其他类黄酮生物合成的直接前体,由苯丙氨酸到花青素经历3个阶段,第一阶段由苯丙氨酸到4-香豆酰CoA ,这是许多次生代 谢共有的,该步骤受苯丙氨酸裂解酶(PAL)基因活性调控。第二阶段由4-香豆酰CoA 和丙二酰CoA 到二氢黄酮醇,是类黄酮代谢的关键反应,该阶段产生的黄烷酮和二氢黄酮醇在不同酶作用下,可转化为花青素和其他类黄酮物质。第三阶段是各种花青素的合成,至少有3个酶:二氢黄酮醇还原酶(DFR)、花青素合成酶(ANS)和类黄酮3-葡糖基转移酶(3GT)能够将无色的二氢黄酮醇转化成有色的花色素。其中DFR 催化二氢黄酮醇进一步还原成无色花色素,再经过氧化、脱水和糖基化,不同的无色花色素变成有色的花色素苷(砖红色的花葵素、紫红色的芍药花色素和蓝色的飞燕草色素)。这些花色素苷还可进一步糖基化、甲基化和酰基化形成不同的产物(Holton 和Cornish 1995)。 2 花青素转录因子的结构特点 植物花青素的时空合成机制已有深入的研究。已有的研究表明,不同植物中的花青素生物合成受2类基因的共同控制,一类是结构基因,其编码生物合成途径中所需的酶;另一类是调节基因,其编码的转录因子调控结构基因的时空表达(Holton 和Cornish 1995)。目前已分离和鉴定了3类花青素合成的转录因子:(1) R2R3-MYB 蛋白;(2) myc 家族的bHLH 蛋白;(3) WD40蛋白
转基因动物技术应用研究进展汇总
转基因动物技术应用研究进展 摘要:本文主要对动物转基因技术发展状况作了概述,重点是近年发展的提高转基因效率的非定点整合转基因方法, 如睾丸转基因法和卵巢转基因法; 提高转基因精确性的定点整合转基因的基因打靶法作了介绍。然后对转基因技术的应用作了论述,最后对转基因技术的发展前景作了展望。 关键字:动物转基因技术;应用;展望 Progress on Techniques for Producing Transgenic Animals And their Application Abstract: This review describes the recently developed animal gene transfer techniques, including gene transfer into the testis and ovary for easily making non-site specific methods; gene targeting in embryonic stem cells, somatic cells and primordial germ cells for site specific methods.The application and prospect of transgenic technology was also discussed. Key words: animal gene transfer technique; application;prospect 动物转基因技术是将外源基因移入动物细胞并整合到基因组中, 从而使其得以表达。自Palmiter等[1] (1982)把大鼠生长激素基因导入小鼠受精卵获得超级巨鼠以来,世界各国科学家对转基因技术应用于动物生产的研究产生了极大的兴趣,并相继在兔、羊、猪、牛、鸡、鱼等动物上获得转基因成功。转基因动物研究是近年来生命科学中最热门、发展最快的领域之一,其应用已广泛渗透于分子生物学、发育生物学、免疫学、制药及畜牧育种等各个研究领域中。这项技术正在对动物生产产生一场新的革命,在提高生长速度、生产性能,改善产品品质、抗病育种、基因治疗等方面取得了可喜的进展,显示出诱人的应用前景。 1 转基因动物技术 1.1 显微注射法 这一方法是发展最早,目前应用最广泛和最为有效的制作转基因动物的方法,创始人是Jaenisch和Mintz等,Gorden等[2]和最先通过此法获得转基因动物。其基本原理是:通过显微操作仪将外源基因直接用注射器注入受精卵,利用受精卵繁殖过程中DNA的复制过程,将外源基因整合到DNA中,发育成转基因动物。 1.2 逆转录病毒载体导入法 将目的基因重组到逆转录病毒载体上,制成高滴度的病毒颗粒,人为感染着床前后的胚胎,
