胞必佳对S_180_A小鼠腹水和_省略_血病细胞系HL_60抑瘤作用研究_林清强

胃中甲基橙的残留率,与对照组比较有显著性差异,特别是蜂胶醇提物有非常显著性差异(P <0.01)。2.2 对小鼠小肠推进的影响 结果(见表2)。
表2 蜂胶不同提取部位对小鼠小肠推进的影响(x ±S )
组 别剂量(g ·kg -1)鼠数(
只)小肠推进率(%)对照组01049.7±8.2蜂胶A 低组21052.3±9.4蜂胶A 高组41061.5±7.9*蜂胶B 低组21072.7±8.5
**
蜂胶B 高组
4
10
78.3±9.7*
*q 检验:*与对照组比较P <0.05;**与对照组比较P <0.01
由表2可见,蜂胶水提液高剂量和醇提物的小肠炭末推进率与对照组相比有显著性差异,特别是蜂胶醇提物有非常
显著性差异(P <0.01)。4 讨论
蜂胶是西方蜜蜂和非洲蜂采集植物的芽孢分泌物或伤口处流出的树叶油脂、黏液、树脂、橡胶,并混入蜂蜡和其它分泌物,咀嚼加工而成的一种黏液物质。中医认为,蜂胶性平,味微甘、苦,有润肤生肌、消炎止痛的功能,常用于治疗口腔溃疡、牙周炎、胃溃疡、宫颈糜烂、带状疱疹、牛皮屑、银屑病、皮肤裂痛、鸡眼、烧烫伤等。有报道表明蜂胶乙醇提取物对福氏
痢疾杆菌、沙门氏菌、金黄色葡萄球菌、大肠杆菌、绿脓杆菌、变形杆菌等肠道致病菌和条件致病菌均有较强的抑菌能力,
并对金黄色葡萄球菌耐药株有明显的抗菌活性〔2〕;蜂胶乙醇提取液还具有免疫增强和免疫调节作用,可以使氢化可的松致免疫功能低下模型鼠的细胞免疫功能恢复正常水平〔4〕。本实验结果表明,蜂胶不同提取部位在促进消化功能方面,出现药理效应不同,虽均降低小鼠胃中甲基橙残留率和促进小肠炭末推进率,但醇提物的作用较水提物为好,这可能与蜂胶所含黄酮类化合物、类黄酮、萜烯类化合物易溶于乙醇有关。本实验研究表明蜂胶具有良好的促进消化功能作用,这为今后开发应用蜂胶在消化系统疾病方面提供了临床依据。
参考文献
〔1〕吴平谷,叶立扬.蜂胶有效成分的分离与鉴定〔J 〕.卫生研究,
2000,29(2):123-124.
〔2〕陈思维,薛淑英,王敏伟.介绍一种简易实验性胃排空测定方法
〔J 〕.中国药理学通报,1994,10(4):317.
〔3〕王南舟.复合蜂胶制剂调节肠道功能的体外实验研究〔J 〕.营养
卫生,2003,24(3):119-121.
〔4〕艾予川,许兵红,曾莉萍,等.河南蜂胶对金黄色葡萄球菌耐药株
不同抑菌作用研究〔J 〕.实用儿科临床杂志,2004,19(8):710-711.
胞必佳对S 180A 小鼠腹水和人急性髓性白血病细胞系HL -60抑瘤作用研究
林清强1
,林秋莺2
,黄明聪1
,武 庚1
(1.福建师范大学生命科学学院福州350108;2.福州市第一医院福州350009)
摘要:胞必佳的体内、体外抑瘤试验表明,N -CWS 能显著抑制瘤细胞生长,同时在S 180A 小鼠腹水体内,与人急性髓性白血病细胞系HL -60体外
的抑瘤率均有效,并且受到浓度的影响较为显著。
关键词:胞必佳;细胞壁骨架;抑瘤;对比
中图分类号:R97 文献标识码:A 文章编号:1006-3765(2009)-06-0047-02
作者简介:林清强,男(1971.3-),实验师,在职硕士,研究方向:农产品加工,药物研制。E -mail :qingqianglin @fjnu .edu .cn
细胞壁骨架(Cell Wall Skeleton ),简称CWS ,是去除了内容物后的细胞表层结构。它可通过细胞培养、破碎、离心、酶解等一系列微生物及生物化学方法而获得。化学分析表明,细胞壁骨架主要含有霉菌酸,多糖和粘肽等化学成分〔1〕。来自不同细菌的细胞壁骨架中霉菌酸的脂肪酸长度,多糖的单糖构成和粘肽的氨基酸成分有一些差别,但它们都具有十分相似的基本结构,即:霉菌酸-多糖-粘肽。这种共同的基本结构构成了细胞壁骨架的免疫学分子基础,而不同细菌之间细胞壁骨架的部分化学差异决定了它们的免疫学活性差异。已知目前所使用的多种细胞壁骨架中,红色诺卡氏菌细胞壁骨
架(简称N -CWS )具有最强的免疫学活性。
胞必佳是在对红色诺卡氏菌P0-8菌株细胞体提取后的免疫增强剂,由枝菌酸(诺卡氏菌酸)-多糖(阿拉伯半乳聚糖)-粘肽(主要为丙氨酸、谷氨酸、mesr -二氨基庚二酸、葡萄糖胺和胞壁酸)所组成的。与BCG 同属佐剂,其免疫活性比BCG 强,毒副作用比BCG 低。动物实验证明胞必佳能抑制移植性肿瘤和诱发性肿瘤的生长,具有预防诱发剂致癌和防止肿瘤转移的功能〔2〕。本文就胞必佳在体内对S 180A 小鼠腹水和体外人急性髓性白血病细胞系HL -60的抑制作用对比研究进行报道。
1 体内试验1.1 材料 胞必佳由福建省天神药业有限公司提供,每支含N -CW S 200μg 。1.2 动物与瘤株 S 180A 购自中科院上海药物所;BALB /c
·
47·Strait Pharmaceutical Journal Vol 21No .62009
小鼠由厦门大学抗癌中心提供,雌性,体重18~22g。
1.3 试验步骤 抽取生长7d的S180A小鼠腹水,调整成2×107细胞/mL的悬液备用;样品以生理盐水溶解,配制成2000μg·mL-1备用;将瘤细胞悬液与N-CWS样品等量混合,对照组则以将瘤细胞悬液与生理盐水等量混合,以200μg/ 0.2mL/只接种至小鼠右腋皮下,接种后14天解剖取瘤,称取瘤重,计算瘤重抑制率。各组瘤重均值与对照组均值的差异显著性作student′t测验。
瘤重抑制率(%)=〔(对照组瘤重均值—试验组瘤重均值)/对照组瘤重均值〕×100%
1.4 实验结果(见表1)。
表1 胞必佳在体内对S180A小鼠腹水瘤抑制作用(%)
样品批号(200μg/只)动物数(只)体重(克)
始/末始/末
平均瘤重(g)
X±S
抑瘤率
(%)
P值
2003050310/1019.88/23.400.157±0.08788.11<0.01 2003060110/1019.67/23.370.136±0.06189.70<0.01 2003060210/1019.49/24.300.319±0.16475.84<0.01 2003060310/1019.96/22.860.355±0.17473.11<0.01 2003060410/1019.80/24.550.281±0.14378.72<0.01 2003060510/1019.78/25.880.218±0.09183.49<0.01对照25/2519.84/26.741.96±0.520//
2 体外试验
2.1 材料 同上。
2.2 细胞系 人急性髓性白血病细胞系HL-60引自中科院上海药物所。
2.3 试验方法 胞必佳用1640培养液溶解成1500μg·m L-1、750μg·m L-1、375μg·mL-1、188μg·mL-1、94μg·mL-1、47μg·mL-1六个浓度备用;HL-60细胞用1640培养液调整成2×105细胞/mL,无菌96孔培养板每孔接种HL-60细胞100μL,试验组每孔加以上浓度的N-CWS100μL,使终浓度分别为750μg·mL-1、375μg·m L-1、188μg·m L-1、94μg·mL-1、47μg·m L-1、2
3.5μg·mL-1,对照组则同时加100μL的1640培养液,以上各组各设三复孔,对照组设23复孔。培养板置37℃、5%CO2的温箱中孵育72h,快速倾倒弃除上清,每孔加M T T(5mg·m L-1)20μL,继续培养4h,每孔加100μLDM SO,微型振荡器振荡10min,在Bio-tek酶标仪上以570nm的波长测A值,按以下公式算出抑制率。
抑制率(%)=〔(对照组A值—试验组A值)/对照组A 值〕×100%
以Chou氏父子开发的Do se-Effect A nalysis软件计算IC50、IC70、IC90。
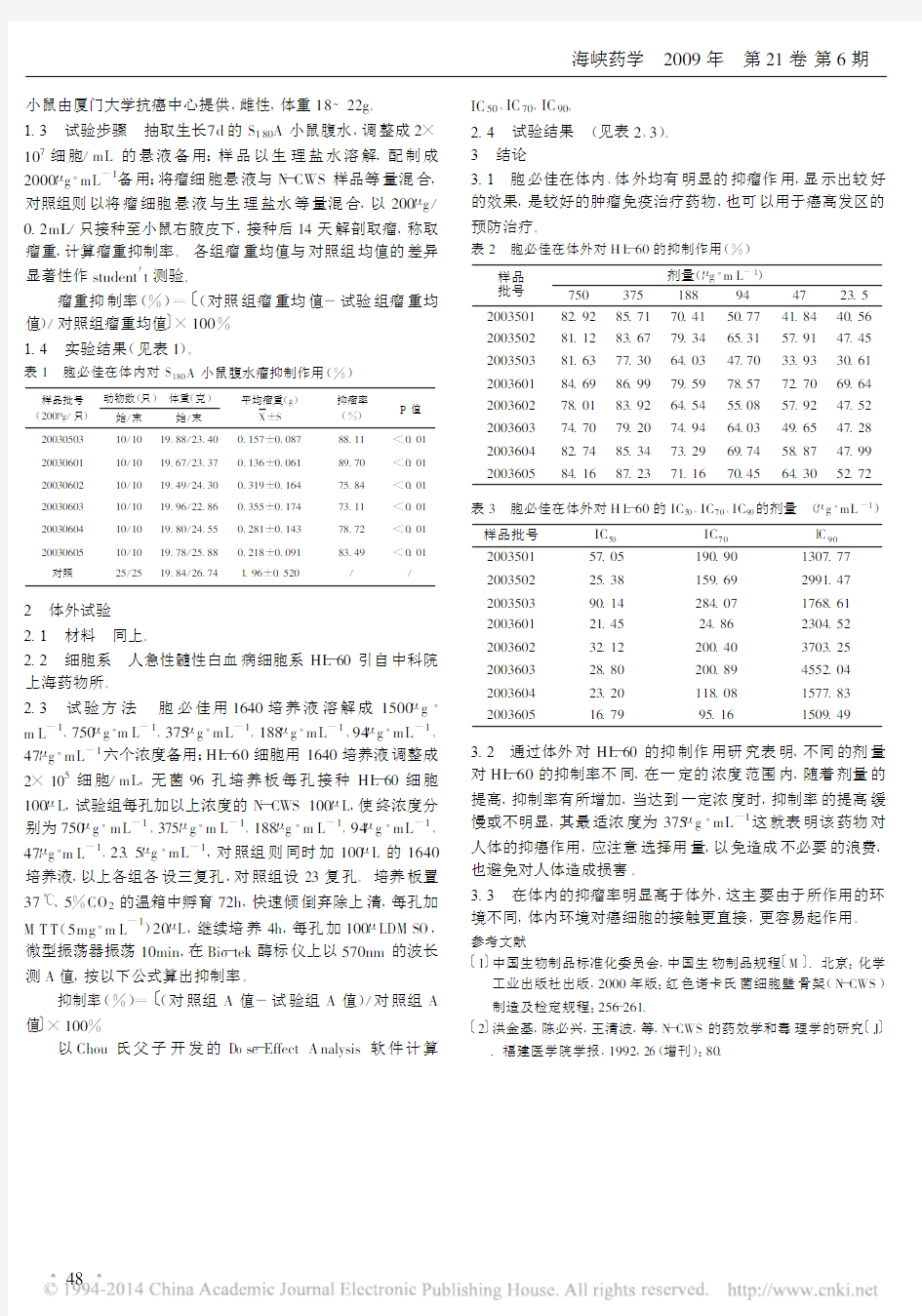
2.4 试验结果 (见表2、3)。
3 结论
3.1 胞必佳在体内、体外均有明显的抑瘤作用,显示出较好的效果,是较好的肿瘤免疫治疗药物,也可以用于癌高发区的预防治疗。
表2 胞必佳在体外对H L-60的抑制作用(%)
样品
批号
剂量(μg·m L-1)
750375188944723.5 200350182.9285.7170.4150.7741.8440.56 200350281.1283.6779.3465.3157.9147.45 200350381.6377.3064.0347.7033.9330.61 200360184.6986.9979.5978.5772.7069.64 200360278.0183.9264.5455.0857.9247.52 200360374.7079.2074.9464.0349.6547.28 200360482.7485.3473.2969.7458.8747.99 200360584.1687.2371.1670.4564.3052.72
表3 胞必佳在体外对H L-60的IC50、IC70、IC90的剂量 (μg·mL-1)样品批号IC50IC70IC90
200350157.05190.901307.77
200350225.38159.692991.47
200350390.14284.071768.61
200360121.4524.862304.52
200360232.12200.403703.25
200360328.80200.894552.04
200360423.20118.081577.83
200360516.7995.161509.49
3.2 通过体外对HL-60的抑制作用研究表明,不同的剂量对HL-60的抑制率不同,在一定的浓度范围内,随着剂量的提高,抑制率有所增加,当达到一定浓度时,抑制率的提高缓慢或不明显,其最适浓度为375μg·mL-1这就表明该药物对人体的抑癌作用,应注意选择用量,以免造成不必要的浪费,也避免对人体造成损害。
3.3 在体内的抑瘤率明显高于体外,这主要由于所作用的环境不同,体内环境对癌细胞的接触更直接,更容易起作用。
参考文献
〔1〕中国生物制品标准化委员会,中国生物制品规程〔M〕.北京:化学工业出版社出版,2000年版:红色诺卡氏菌细胞壁骨架(N-CWS)制造及检定规程:256-261.
〔2〕洪金基,陈必兴,王清波,等,N-CWS的药效学和毒理学的研究〔J〕.福建医学院学报,1992,26(增刊):80.
·
48
·
海峡药学 2009年 第21卷第6期
血液检查正常参考值1
血液检查 一、血液一般检查: 1、红细胞计数(RBC) [正常参考值] 男:4.0×10 12-5.3×10 12个/L(400万-550万个/mm3)。 女:3.5×10 12-5.0×10 12个/L(350万-500万个/mm3)。 儿童:4.0×10 12-5.3×10 12个/L(400万-530万个/mm3)。 [临床意义] 红细胞减少多见于各种贫血,如急性、慢性再生障碍性贫血、缺铁性贫血等。 红细胞增多常见于身体缺氧、血液浓缩、真性红细胞增多症、肺气肿等。 2、血红蛋白测定(Hb) [正常参考值] 男:120-160g/L(12-16g/dL)。 女:110-150g/L(11-15g/dL)。 儿童:120-140g/L(12-14g/dL)。 [临床意义] 血红蛋白减少多见于各种贫血,如急性、慢性再生障碍性贫血、缺铁性贫血等。 血红蛋白增多常见于身体缺氧、血液浓缩、真性红细胞增多症、肺气肿等。 3、白细胞计数(WBC) [正常参考值] 成人:4×109-10×109/L(4000-10000/mm3)。 新生儿:15×109-20×109/L(15000-20000/mm3)。 [临床意义] 生理性白细胞增高多见于剧烈运动、进食后、妊娠、新生儿。另外采血部位不同,也可使白细胞数有差异,如耳垂血比手指血的白细胞数平均要高一些。 病理性白细胞增高多见于急性化脓性感染、尿毒症、白血病、组织损伤、急性出血等。 病理性白细胞减少再生障碍性贫血、某些传染病、肝硬化、脾功能亢进、放疗化疗等。 4、白细胞分类计数(DC) [正常参考值] 中性秆状核粒细胞:0.01-0.05(1%-5%)。 中性分叶核粒细胞:0.50-0.70(50%-70%)。 嗜酸性粒细胞:0.005-0.05(0.5%-5%)。 淋巴细胞:0.20-0.40(20%-40%)。 单核细胞:0.03-0.08(3%-8%)。 [临床意义] 中性杆状核粒细胞增高见于急性化脓性感染、大出血、严重组织损伤、慢性粒细胞膜性白血病及安眠药中毒等。 中性分叶核粒细胞减少多见于某些传染病、再生障碍性贫血、粒细胞缺乏症等。
小鼠腹水型肝癌淋巴道转移实验
小鼠腹水型肝癌淋巴道转移实验 [摘要] 目的:1.通过可移植性小鼠腹水型肝癌淋巴道转移实验,从感性上认识肿瘤侵袭与淋巴道转移的生物学特性,了解肿瘤动物实验模型建立的过程及意义。2.进一步了解动物尸体解剖、组织取材、染色的过程。3.强化科研思维的培养及实验技能的训练。 方法:将高转移力小鼠腹水型肝癌细胞(HCa - F)经 615 小鼠右腋中线皮下接种,定期观察右腋皮下肿瘤的生长和同侧腋窝淋巴结及腹
股沟淋巴结肿大情况,并于接种后 21 天处死全部小鼠,取皮下瘤体及双侧腋窝淋巴结,腹股沟淋巴结称重并测量大小,同时观察肿瘤的形态特点,生长方式,肺、肝、肾等脏器,并将瘤体、淋巴结及脏器做切片处理以作染色和镜下观察。 结果:21 天观察,实验使用 10 只小鼠,最终存活 8只,其中形成肿块 7 只(3只形成的肿块较大),成瘤率 70%,淋巴结转移率 70%。肉眼观察,较大肿瘤 2*1.5*1.3cm,灰白色,质地较硬,从中间切开,发现肿块大部分坏死,中心部分出现腔,腔内有肿瘤坏死物质。镜下观察,坏死组织粉染,轮廓尚存。残存肿瘤组织细胞存在异型性:瘤细胞大小和形态不一致,细胞核体积增大并呈现多形性,核浆比增大。核的大小、形状和染色不一。核分裂象增多,核浆比失调,胞浆减少。结论:高转移力小鼠腹水型肝癌细胞通过淋巴道转移,无器官转移,且具有高转移力。 [关键词]HCa-F(高转移力小鼠腹水型肝癌细胞); 615小鼠; 高淋巴道转移 [前言]研究背景:原发性肝癌的发生率地区差异大,在亚非国家较常见,我国的发病率较高,属于常见的肿瘤之一。近年来,我国对肝癌的防治研究取得了明显的成绩,一些直径在1cm一下的小肝癌已被发现并及时治疗取得满意的疗效[1]。随着临床治疗经验的积累,逐渐
血细胞的种类和生理功能
红细胞的生理功能 红细胞的主要功能是运输O2和CO2,此外还在酸碱平衡中起一定的缓冲作用。这两项功能都是通过红细胞中的血红蛋白来实现的。如果红细胞破裂,血红蛋白释放出来,溶解于血浆中,即丧失上述功能。 白细胞的功能 白细胞是机体防御系统的一个重要组成部分。它通过吞噬和产生抗体等方式来抵御和消灭入侵的病原微生物。 1.吞噬作用吞噬作用是生物体最古老的,也是最基本的防卫机制之一。对于其要消灭的对象无特异性,在免疫学中称之为非特异性免疫作用。中性粒细胞和单核细胞的吞噬作用很强,嗜酸性粒细胞虽然游走性很强,但吞噬能力较弱。 白细胞可以通过毛细血管的内皮间隙,从血管内渗出,在组织间隙中游走。它们吞噬侵入的细菌、病毒、寄生虫等病原体和一些坏死的组织碎片。一般认为,白细胞能向异物处聚集,并将其吞噬,这是因为白细胞有趋化性。由于细菌体或死亡的细胞所产生的化学刺激,诱发白细胞向该处移动(图5-5)。组织发炎时产生一种活性多肽,也是白细胞游动的诱发物质之一。 中性粒细胞内的颗粒为溶酶体,内含多种水解酶,能消化其所摄取的病原体或其他异物。一般一个白细胞处理5~25个细菌后,本身也就死亡。死亡的白细胞集团和细菌分解产物构成脓液。 单核细胞由骨髓生成,在血液内仅生活3~4天,即进入肝、脾、肺和淋巴等组织转变为巨噬细胞。变为巨噬细胞后,体积加大,溶酶体增多,吞噬和消化能力也增强。但其吞噬对象主要为进入细胞内的致病物,如病毒、疟原虫和细菌等。巨噬细胞还参与激活淋巴细胞的特异免疫功能。此外,它还具有识别和杀伤肿瘤细胞,清除衰老与损伤细胞的作用。 2.特异性免疫功能淋巴细胞也称免疫细胞,在机体特异性免疫过程中起主要作用。所谓特异性免疫,就是淋巴细胞针对某一种特异性抗原,产生与之相对应的抗体或进行局部性细胞反应,以杀灭特异性抗原。血液中淋巴细胞按其发生和功能的差异,分为T淋巴细胞和B淋巴细胞两类。 (1)细胞免疫细胞免疫主要是由T细胞来实现的。这种细胞在血液中占淋巴细胞总数的80%~90%。T细胞受抗原刺激变成致敏细胞后,其免疫作用表现以下三个方面。直接接触并攻击具有特异抗原性的异物,如肿瘤细胞,异体移植细胞;分泌多种淋巴因子,破坏含有病原体的细胞或抑制病毒繁殖;B细胞与T 细胞起协同作用,互相加强,来杀灭病原微生物。 (2)体液免疫体疫免疫主要是通过B细胞来实现的。当此细胞受到抗原刺激变成具有免疫活性的浆细胞后,产生并分泌多种抗体,即免疫球蛋白,以针对不同的抗原。B细胞内有丰富的粗面内质网,蛋白质合成旺盛。抗体通过与相应
小鼠骨髓的综合性实验报告
小鼠骨髓的综合性实验报告 YUNNAN NORMAL UN I VER SITY 本科学生综合性实验报告 学号姓名 学院专业、班级 实验课程名称: 教师及职称 开课学期至学年学期 填报时间年月曰 云南师范大学教务处编印 一(实验设计方案 实验名称实验序号 实验室实验时间 一、实验目的 1、学习并掌握小鼠骨髓细胞染色体的制备方法。 2、观察小鼠染色体的形态特征,统计细胞的染色体数目。 3、了解微核发生的机制; 4、掌握微核实验的一般程序和实践意义; 5、掌握对实验动物进行药物处理的一般程序; 6掌握进行实验设计的一般程序和规则,并锻炼实践能力
二、实验原理、实验流程或装置示意图 1、骨髓细胞具有高度的分裂增殖能力。因此可以直接得到中期细胞而不必象 血淋巴细胞或组织那样要经过体外培养。经秋水仙素处理后,分裂增殖中的骨髓细胞由于纺缍体的形成受到抑制,染色体不能正常趋向两极而使之停留于中期,同时染色体缩短,轮廓清晰,把收获的细胞进行低渗,固定处理,使细胞处于膨胀状态,再将细胞悬液滴在载片上,使细胞破裂,染色体散开,染色后即可观察到染色体。 2、微核(Micronucleus): 染色单体或染色体的无着丝点断片,或因纺锤体受损而丢失的整个染色体,在细胞分裂后期,仍然遗留在细胞质中。末期之后,单独形成一个或几个规则的次核,被包含在子细胞的胞质内,因比主核小,故称为微核。凡能使染色体发生断裂或使染色体和纺锤体联结损伤的化学物,都可用微核试验来检测。各种类型的骨髓细胞都可形成微核,但有核细胞的胞质少,微核与正常核叶及核的突起难以鉴别。 嗜多染红细胞是分裂后期的红细胞由幼年发展为成熟红细胞的一个阶段,此时红细胞的主核已排出,因胞质内含有核糖体,姬姆萨染色呈灰蓝色,成熟红细胞的核糖体已消失,被染成淡桔红色。骨髓中嗜多染红细胞数量充足,微核容易辨认,而且微核自发率低,因此,骨髓中嗜多染红细胞成为微核试验的首选细胞群。 三、实验设备及材料 1、材料:小白鼠(2n=40) 2、器具: 注射器( 1 ml ,5ml 各一支)、托盘、解剖剪、镊子、吸管、离心管、离心机、载片、滤纸、白纱布小块等。 3、药品: 0.15mg/ml 秋水仙素,1%柠檬酸三钠,固定液(3份甲醇,1份冰乙酸,临用时现配),Giemsa染液,2.2%柠檬酸钠,0.01M磷酸缓冲液(PBS) pH6.8。
实验一、骨髓瘤细胞的培养
实验一、骨髓瘤细胞的培养 骨髓瘤细胞系应和免疫动物属于同一品系,这样杂交融合率高,也便于接种杂交瘤细胞在同 一品系小鼠腹腔内产生大量McAb。 常用骨髓瘤细胞系有:NS1、SP2/0、X63 Ag8.653 等。 骨髓瘤细胞的培养适合于一般的培养液,如RPMI1640, DMEM培养基。小牛血清的浓度 一般在10?20%,细胞的最大密度不得超106/ ml, 一般扩大培养以1 : 2稀释传代,每2? 3天传代一次。细胞的倍增时间为16?20小时,上述三株骨髓瘤细胞系均为悬浮或轻微贴 壁生长,只用弯头滴管轻轻吹打即可悬起细胞。 二材料: 1. 试剂: ( 1 )培养基杂交瘤技术中使用的细胞培养基主要有RPMI-1640 或DMEM(Dulberco Modified Eagles Medium)两种基础培养基,具体配置方法按厂家规定的程序,配好后过滤除菌(0.22um滤膜),分装,4 C保存。 不完全RPMI-1640培养基:RPMI-1640培养基原液96ml,100 X L.G.溶液1ml,双抗溶液1ml, 7.5% NaHCO溶液1-2ml , HEPES溶夜1ml。 不完全DMEM培养基:DMEM 13.37g,超纯水或四蒸水980ml, NaHCO3.7g , 100X L.G. 溶液10ml,双抗溶液10ml , 7.5% NaHCO溶液1-2ml,用1N HCl调试pH至7.2-7.4,过滤除菌,分装4C保存。 完全RPMI-1640或DMEM培养基:不完全RPMI-1640或DMEM培养基80ml,灭活小牛血清15-20ml ,用于骨髓瘤细胞SP2/0 和建株后杂交瘤细胞培养。 (2)小牛血清灭活:从-20 C冰箱取出小牛血清,室温自然融化,56C 30min即可充分灭活,分装小瓶(5ml/瓶),-20 C冻存备用,尽量避免反复冻融。 (3)青、链霉素(双抗)溶液(100X )取青霉素G (钠盐)100万单位和链霉素(硫酸盐)1g或100万单位,溶于100ml灭菌超纯水或四蒸水中,分装小瓶(4-5ml/瓶),-20 C 冻存。 2. 器材: 超净工作台、CQ恒温培养箱、普通冰箱、电子天平,药物天平、巴氏吸管、10ml吸管、100ml 细胞培养瓶、滴管、灭菌小瓶等 三方法: 细胞冻存及复苏 先用24 孔细胞培养板扩大骨髓瘤细胞或单克隆抗体细胞株, 当长满时, 再扩大到100ml 细胞瓶。当其处于对数生长期时,将细胞洗下,用细胞冻存液(含10% DMS0 40% FCS的DMEM培养基)将细胞悬浮,调配成1-3 X 106个/ml,每个细胞冻存管分装1ml,移至液氮罐口悬吊2小时或-70 C冰箱过夜,然后沉入液氮中。复苏时,从液氮中取出冻存管后迅速置入40C水浴中,在1min内融化,1500rpm离心5min,弃上清,用少量完全培养基轻轻悬浮细胞,移入24 孔板中培养。 四、细胞培养应注意事项 1. 细胞培养瓶、吸管:使用前要严格消毒,对于新购置或已经使用的玻璃器皿,一般先用先用0.1%
肝癌小鼠造模实验方法
肝癌小鼠造模实验方法 (1)肿瘤细胞悬液的制备小鼠肿瘤细胞用小鼠腹腔培养,然后抽取腹水,是 取得大量肿瘤细胞最便捷的方法。具体操作如下:将肿瘤细胞株复苏后,接种于babl/c (昆明小鼠)腹腔,培养8-10天后,接种小鼠的腹腔内长出含肿瘤细胞的腹水,选择腹水饱满的小鼠,在超净台内于无菌条件下消毒小鼠腹部,用注射器抽取淡腹水为瘤源,放入无菌容器内,加入无菌生理盐水稀释瘤液,小心摇匀,并置冰水上保存。若用多只动物做瘤源时,则应混合腹水。(腹水应为淡黄色浓稠液体,若为深黄色或红色则应弃去不用。) (2)肿瘤细胞计数取少量腹水,放置于干试管内,用生理盐水稀释100倍,用 枪头吸取少许腹水,滴于载玻片上,推片,镜下观察细胞形态:细胞为圆形,胞浆均匀,透明,折光性好,分布均匀。并于镜下进行细胞分类计数,其中肿瘤细胞数应≥95%。 (3)肿瘤细胞接种腹水用无菌生理盐水调整细胞浓度为1*107mL ,在小鼠右侧腋下(右侧腋窝 皮下?)常规接种H22瘤液0.2mL /只(含2*106个瘤细胞)(5*106)?。全程严格无菌操作, 40min 内完成。 (4)分组与给药昆明小鼠用上法造模,造模后再将腹水瘤小鼠按体重分层,随 机分为阳性对照组(CTX)、青蒿素各剂量组(150mg /kg 、300mg /kg)、青蒿琥酯P0组(60mg /kg)、青蒿琥酯ip 组(60mg /kg)、青蒿醇提物和青蒿水提物各剂量组 (1000mg /kg 、4000mg /kg)和模型对照组(Model),每组各lO 只小鼠。造模24h 后,阳性对照组(CTX)20mg /kg 和青蒿琥酯ip 组(60mg /kg),腹腔注射0.2mL /只,每天1次,连续lOd :其它组灌胃给药,灌服溶液0.4mL /只,每天1次,连续lOd 。模型对照组仅予等量CMC-Na 溶液,连续lOd 。平均每只小鼠每天给等量鼠料,每周换垫料2次,每日换新鲜水1次。记录各小鼠死亡的时间。 其他问题: 检测药物对肿瘤的抑制作用,给药时间怎么确定? 1、 造模后第二天给药 2、 肿瘤长出一定体积后在给药
血常规正常值
血常规是最一般,最基本的血液检验。血液由液体和有形细胞两大部分组成,血常规检验的是血液的细胞部分。血液有三种不同功能的细胞--红细胞(俗称红血球),白细胞(俗称白血球)、血小板。通过观察数量变化及形态分布,判断疾病。是医生诊断病情的常用辅助检查手段之一。 1.红细胞计数(RBC)是指单位体积血液中所含的红细胞数目。 【正常参考范围】 新生儿:(6.0~7.0)×1012/L 婴儿:(5.2~7.0)×1012/L 儿童:(4.2~5.2)×1012/L 成人男:(4.0~5.5)×1012/L 成人女:(3.5~5.0)×1012/L 2.血红蛋白(Hb)是红细胞的主要组成部分,承担着机体向器官、组织运输氧气和运出二氧化碳的功能。其增减的临床意义基本上与红细胞增减的意义相同,但血红蛋白能更好地反映贫血的程度。贫血按严重程度可分为:极重度贫血,HbL<30g/L;重度贫血,Hb在31~60g/L;中度贫血,Hb在>61~90g/L;轻度贫血,Hb在>90g/L与低于正常参考的下限之间。 【正常参考范围】 男性120~160g/L 女性110~150g/L 新生儿170~200g/L 3.血细胞比容(HCT)是指抗凝血液在一定条件下离心沉淀,而测出红细胞在全血中所占体积的百分比。 【正常参考范围】 男40%~50%; 女35%~45%。 4.白细胞计数:指计数单位体积血液中含的白细胞数目。正常的外周血液中常见的白细胞有中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、淋巴细胞和单核细胞。 【正常参考范围】 成人(4.0~10.0)×109/L 新生儿(15.0~20.0)×109/L 5.白细胞分类计数(DC)是指对不同类型的白细胞分别计数并计算其百分比。 【正常参考范围】 中性粒细胞N0.5~0.7(50%~70%) 嗜酸性粒细胞E0.01~0.05(1%~5%) 嗜碱性粒细胞B0~0.0l(0~1%) 淋巴细胞L0.20~0.40(20%~40%) 单核细胞M0.03~0.08(3%~8%)
小鼠骨髓来源树突状细胞(BMDC)培养
小鼠骨髓来源树突状细胞(BMDC)的培养 1、取骨髓,对倍稀释 2、用滴管沿管壁缓慢加入淋巴细胞分离液(45度角倾斜,尽量产生气泡,起到缓冲作用) 3、2000转,离心30分钟 4、吸取白膜层,(沿管壁)交替多次吸取,加入5倍体积以上的PBS液 5、1500转,离心15分钟(洗掉血小板) 6、弃掉上清,留少许回流液,轻弹管壁,加入PBS液至50ml 7、800转,离心10分钟,(洗掉红细胞) 8、重复两至三次 9、加入PBS液至50ml,计数:?个细胞 离心后铺板,1X1076孔板培养液,共铺20板。无血清1640+DNA酶12h后轻晃培养液,洗板后加入完全培养基和GM—CSF(1000U/ml)和IL—4(500U/lml) 10、第三天每孔补加等体积的完全培养基和GM—CSF(1000U/ml)和IL— 4(500U/lml) ,这时细胞部分悬浮 11、第五天为imDC,+1LPS(1ug/ml),诱导至第七天,为mDC。 参考Inaba等人的方法,并根据本实验室的经验稍作改进。即: 1. 颈椎脱位法处死C57BL/6小鼠,无菌状态下取股骨和胫骨,浸泡在RPMI-1640培养基中。 2. 用1ml注射器吸取RPMI-1640培养液,从骨干的一端刺入骨髓腔,将骨髓冲洗到一无菌培养皿中,每根骨头反复4~6遍,收集培养皿中的骨髓细胞悬液,离心,1500 rpm×10min。 3. 弃去上清,加入5 ml无菌Tris-NH4Cl溶液悬浮细胞溶解红细胞,于室温下静置2分钟溶解红细胞后,再次离心,1500 rpm×5min,弃上清。 4. 用RPMI-1640培养液洗涤后将细胞用完全培养基悬浮,分至6孔培养板中,并在每孔中加入完全培养基至4 ml,再加入rmGM-CSF至终浓度 10 ng/ml,IL-4终浓度10ng/ml。 5. 将细胞培养板放入37℃,含5% CO2的孵箱中培养48小时。 6. 轻轻吹打细胞后,连同培养液一起吸去悬浮细胞,仅保留贴壁细胞。 7. 加入新鲜的完全培养基及相同浓度的rmGM-CSF,继续培养至第5天。 8. 半量换液,并补足rmGM-CSF;尽量保留悬浮细胞。 9. 继续培养至第7天,用吸管轻轻吹打后收集所有悬浮细胞,即为富集的小鼠骨髓来源的树突状细胞(Bone marrow- derived dendritic cell, BMDC)。经鉴定,此时BMDC的纯度可达80%以上。 楼上的cherry_28提供的好像是外周血DC的培养方法。我本人没有培养外周血DC的经验,但培养了2年半的小鼠骨髓DC,有稍许体会。其中体会最深的是:强烈反对初次铺板不到24小时就去除悬浮细胞的做法,我接触的网友中用贴壁时间<48小时而养不出DC不少于15位,而延长贴壁时间就可以大大提供集落形成率。下面是我用上述方法培养的小鼠DC,供朋友们共同讨论。
小鼠间充质干细胞分离培养与纯化
小鼠间充质干细胞 一、细胞复苏和接种 1. 37℃预热小鼠间充质干细胞培养液和基础培养液。 2. 从液氮中取出细胞产品管,快速将其置入37℃水浴中解冻,直到管中只剩下最后一片结晶(注意:不要让水没过产品管)。 3. 在生物安全柜中,用75%的酒精擦拭产品管外壁。 4. 将产品管中的细胞移至15ml无菌离心管中,慢慢逐滴加入预温的37℃基础培养液4-5 ml混匀,边滴加边摇匀。 5. 用1ml基础培养液冲洗产品管,并将其转移到15 ml离心管中,边滴加边摇匀。 6. 轻轻混匀细胞后,取10 μl细胞悬液和10 μl台盼蓝混匀,从中取10 μl计数。 7. 细胞悬液在1 000 rpm,室温条件下,离心5分钟,去除上清。 8. 加完全培养液4-5 ml,调整细胞量,轻轻混匀细胞,备用。 9. 按10 000-15 000个细胞/cm2接种细胞。 10. 每个T25培养瓶中加完全培养液3-5 ml,后置于37℃、5%CO2培养箱内培养。 二、细胞换液和培养 注意:复苏或传代后的细胞,请于24小时后,第一次更换培养液。 1. 复苏后的细胞经37℃、5%CO2培养箱内培养24小时,此时细胞已完全贴壁,更换培养液后,请继续在37℃,5%CO2培养箱内培养。 2. 之后,每2-3天更换培养液1次,至细胞长到培养瓶表面的80% 可进行传代或冻存。 3. 换液前,请将培养液从4℃中取出,使其恢复到室温。 三、消化细胞 1.消化液的配制:pH7.0-7.2 ,分别配制0.5%胰酶液和0.04%EDTA-Na2液,
用前按1:1混合。 将PBS或D-Hank's液, 消化液,含10% FBS的基础培养液恢复到室温。 2.具体操作如下: (1)吸去培养液,加入3 ml PBS或D-Hank's液,使PBS或D-Hank's液均匀的分布在培养瓶细胞表面。1分钟之后,吸去PBS或D-Hank's液。 (2)每个T25培养瓶加入消化液2 ml,使消化液均匀的分布在培养瓶细胞面。 (3)25℃消化2分钟,在显微镜下看细胞回缩成圆形后,轻轻震动使绝大部分细胞脱落。(4)向每个培养瓶中加3-5 ml 含10% FBS的基础培养液中和胰酶的消化作用。 (5)用移液管轻轻吹打培养瓶表面使细胞完全脱落后,吸至15 ml无菌离心管内。 (6)20℃,1 500 rpm 离心5分钟,弃上清。 (7)加入一定量的完全培养液,调整细胞数量后,抽样加入胎盘蓝计数,得到细胞数和活性后,按细胞数传代或冻存。 四、细胞传代 1.消化细胞(详见第三步)。 2.按10000-15000个细胞/cm2接种细胞于T25的培养瓶中。 3.每个培养瓶中加完全培养液3-5ml,后置于37℃、5%CO2培养箱内培养。 五、小鼠骨髓MSCs的体外分离、培养及扩增 断颈处死小鼠,超净台上取胫骨和股骨,切开两端松质骨,并在骨干中部剪断,无血清DMEM-LG培养基冲出骨髓细胞,制成单细胞悬液,经Percoll密度梯度离心法,分离和收集有核细胞,用含15%FBS的DMEM-LG培养基重悬离心管中的MSCs,镜下细胞计数,使细胞密度达到1X106个/ml,CO2培养箱培养,换液,将MSCs不断纯化。当细胞生长融合达80%-90% 时,用1:1 的0.25% 胰蛋白酶和0.02%EDTA消化分散细胞,在显微镜
小鼠骨髓间充质干细胞培养
小鼠骨髓间充质干细胞培养 目前常用的分离MSC的方法有全骨髓法和密度梯度离心法,全骨髓法即根据干细胞贴壁特性,定期换液除去不贴壁细胞,从而达到纯化MSC的目的。密度梯度离心法即根据骨髓中细胞成分比重的不同,提取单核细胞进行贴壁培养。随着对MSC表面抗原认识的深入,有人利用免疫方法如流式细胞仪法、免疫磁珠法等对其进行分离纯化,但经过流式或磁珠分选后的细胞出现了增殖缓慢等一些问题,加之耗费较大和技术的难度,在某种程度上限制了这些方法的广泛应用。 实验准备: 1实验动物雄性,C57B L/6小鼠,清洁级,8周龄,体重18-20g。 2实验材料与试剂高糖DMEM培养基,胎牛血清,双抗(青霉素钠,链霉素),培养皿,镊子,眼科剪,止血钳,1mL注射器 操作步骤 1、小鼠骨髓间充质干细胞的分离及原代培养 取8周龄雄性C57BL/6小鼠,颈椎脱臼法处死,75%酒精浸泡5分钟,取出双侧腿骨,置于培养皿中小心剔除粘连于骨上的肌肉组织,剪去腿骨两端,用1m l注射器抽取预冷的培养液反复冲洗骨髓腔,直至骨发白,冲洗液直接收集在插在冰上的离心管中,1500rpm离心5分钟,弃上清,用含10%胎牛血清的高糖DMEM培养液重悬细胞,接种于培养皿中(一只小鼠种一个60mm的培养皿),置于5?2,37℃,培养过夜,吸出上清,用PBS洗两遍,洗掉未贴壁的细胞,加入新鲜的培养液,继续培养。以后每两天换液1次,并观察细胞形态。待细胞长至80%-85%时传代(1传2) 2、原代分离的间充质干细胞在接种后培养24小时,细胞开始贴壁,胞体呈圆形或多边形,培养第3-5天,细胞开始较紧密贴附壁上并开始有细胞呈梭形,并不断长大、变长,但未观察到细胞分裂,培养第7天开始观察到细胞分裂,随着细胞数的增加,细胞的生长速度变快,逐渐成漩涡状排列,培养第12天贴壁细胞长满瓶底的80%,并融合成片。传代后细胞生长迅速。 采用贴壁培养法可获得足够数量、生长状态良好、增殖能力强的间充质干细胞,随传代数增加,其纯度增加,且该方法简单、实用。 间质干细胞的培养一定要用塑料培养瓶,不能用玻璃的。因为象间质干这类的基质细胞不易贴玻璃,而且现在买的进口好品牌的培养瓶都涂有一层促细胞贴壁的物质,多数园友培养时都添加10-15%胎牛血清。 分离培养结果的差异可能是由于各个研究小组标本来源、采用的分离方法不同从而所获得的细胞不同,或者用来检测的细胞代数不同,或者培养过程中用的胎牛血清不同,导致MSCs 获得或失去这些表面标记物的表达。
腹水抗体制备一般流程
腹水抗体制备(实验室级别) 2012-8-27 一、实验原理: 将稳定分泌单抗的细胞株,通过扩大培养,接种于Balb/c小鼠腹腔内,使其以腹水瘤形式在小鼠腹腔内增殖,从而得到大量含单抗的腹水。 二、实验材料: 药品:血清培养基、液体石蜡、生理盐水 仪器:电热恒温水浴箱、CO2培养厢、超净工作台、低速自动平衡离心机 三、制备步骤: 1.打石蜡 在细胞培养前两周,取8周-10周的Balb/C小鼠,按每个细胞株注射3只,1ml/只,以促进小鼠肠道蠕动,进行分笼,写好标记,十天后准备注射细胞; 2.杂交瘤细胞复苏与扩大培养 (1)12孔细胞培养板,每孔中加入的细胞培养液约2ml。 (2)按冻存细胞的液氮罐位置,取出冻存的细胞管,在37℃水浴箱中搅动1min 左右,快速融化冷冻的杂交瘤细胞。 (3)将融化的细胞吸入5mL的细胞培养液中,尽量收集细胞,装入EP管,然后 平衡EP管,800rpm,8min,进行离心。 (4)将离心好的细胞上清液吸除,吸取3mL细胞培养液混匀沉淀细胞,将该细胞 液吸出,按1ml/孔混匀到相应培养板孔中,显微镜下观察复苏后的细胞数量,生长形态和背景是否有污染及杂质,然后放入细胞培养厢中进行孵育。 3.杂交瘤细胞收集与注射 (1)待细胞处于对数生长期,即可收集。吸取上清1ml后,吹打细胞,使贴壁细 胞脱落,然后收集到15ml离心管中,800rpm,8min离心, (2)吸取离心上清液(冻存备用),然后每管加入4ml生理盐水,混匀后,同样条 件再次离心,弃去上清液,每管再加人2-3ml生理盐水,混匀后吸入5ml注射器,按约1ml-0.5ml/只,注射小鼠腹腔。从注射后起一周后,每天注意观察小鼠腹腔隆起程度和小鼠生命状态,防止小鼠死亡。 4.腹水收集 (1)取经过免疫的腹部隆起的小鼠,颈部处死,用消毒酒精浸泡,用剪刀剪开腹 部上皮,撕开腹部皮肤,挑起腹腔膜,剪开,注意不要全部剪开,将吸管插进去,挤压腹水后,再吸取腹水到15ml离心管中,800rpm,30min离心,收集油脂层一下淡黄液体,即为腹水抗体。 (2)正常情况下,每只小鼠可收集2-3ml腹水。抗体浓度0.5-5mg/ml。按1ml/ 管,用1.5mlEP管分装后放-80℃冻存。 5.抗体纯化 (1)ProteinG亲和层析柱准备:填料(1ml)装柱后,超纯水流洗3-5个柱床体积 以洗掉乙醇,用平衡缓冲液洗5-10个柱床体积平衡柱子。 (2)上样:将样品上柱,上柱前需将样品超滤浓缩至1ml上柱。 (3)洗涤:平衡缓冲液洗5-10个柱床体积,直至洗涤液用检测液检测无明显显 色反应为止。
小鼠骨髓间充质干细胞的分离培养与鉴定
小鼠骨髓间充质干细胞的分离培养与鉴定 发表时间:2012-05-24T09:50:06.677Z 来源:《医药前沿》2012年第1期供稿作者:林芸1 蔡鹏威2 陈为民1 孟春3 [导读] 分离、培养符合实验要求的小鼠骨髓间充质干细胞并进行鉴定,为进一步的研究打基础。 林芸1 蔡鹏威2 陈为民1 孟春3 ( 1 福建医科大学省立医院临床学院血液科福建福州 3 5 0 0 0 1 ) ( 2 福建省立医院检验科福建福州 3 5 0 0 0 1 ) ( 3 福州大学生物工程学院福建福州 3 5 0 0 0 1 ) 【摘要】目的分离、培养符合实验要求的小鼠骨髓间充质干细胞并进行鉴定,为进一步的研究打基础。方法采用贴壁培养法培养小鼠骨髓间充质干细胞,观察细胞的形态及生长特性,并应用流式细胞仪对细胞表面抗原CD34、CD45、CD29、CD44进行表型鉴定。结果原代分离的间充质干细胞在接种后培养24小时,细胞开始贴壁,胞体呈圆形或多边形,培养第3-5天,细胞开始较紧密贴附壁上并开始有细胞呈梭形,培养第7天开始观察到细胞分裂,随着细胞数的增加,细胞的生长速度变快,逐渐成漩涡状排列,培养第12天贴壁细胞长满瓶底的80%,并融合成片。传代后细胞生长迅速,培养7天左右即可长满瓶底的80%。传至10代仍具有良好的增殖活性。流式细胞仪检测第4代及第8代MSCs细胞均不表达CD34、CD45,但表达CD29、CD44,纯度分别为73.8% 、91.65%。结论采用贴壁培养法可获得生长状态良好、增殖能力强的间充质干细胞,随传代数增加,其纯度增加,且该方法简单、实用。 【关键词】骨髓间充质干细胞细胞培养流式细胞术表型鉴定 【中图分类号】R392.2 【文献标识码】A 【文章编号】2095-1752(2012)01-0082-02 间充质干细胞(mesenchymal stem cells,MSCs)起源于中胚层,具有高度增殖和自我更新的能力,有向骨、软骨、脂肪、血管内皮细胞、神经星型胶质细胞等分化的潜能[1],可分化成骨髓基质支持造血,并可分泌多种细胞因子促进造血干细胞增殖分化,同时它能抑制同种异体反应性T淋巴细胞,在同种异基因造血干细胞移植后的造血重建及免疫调节,预防移植物抗宿主病等方面有广阔的应用前景[2],但骨髓间充质干细胞含量极低,仅占骨髓单个核细胞的0.001%-0.010%[3],因此,培养出生长状态良好,足够数量的骨髓间充质干细胞是应用的前提。 1 材料和方法 1.1 材料 1.1.1 实验动物雄性,C57B L/6小鼠,清洁级,8周龄,体重18-20g,购于吴氏动物实验中心。 1.1.2 实验仪器与试剂低糖DMEM培养基(Gibco公司),特级胎牛血清(Hy c l o ne公司),胰蛋白酶(Si gma公司),青霉素钠(Si gma公司),链霉素(Si g m a公司),5%C O2培养箱(日本三洋公司),流式细胞仪(BD FA CSCalibur),倒置显微镜(OLYMPUS),大鼠抗小鼠单克隆抗体:CD29-PE、CD44-FITC、CD34-PE、CD45-FITC(BD公司)。 1.2 方法 1.2.1 小鼠骨髓间充质干细胞的分离及原代培养取8周龄雄性C57BL/6小鼠,颈椎脱臼法处死,75%酒精浸泡5分钟,取出双侧腿骨,置于装有P BS溶液的培养皿中小心剔除粘连于骨上的肌肉组织,移入装有预冷的含10%特级胎牛血清、青霉素钠100U/ml、链霉素0.1g/L 的低糖DMEM培养液的培养皿中,剪去腿骨两端,用1m l注射器抽取培养液反复冲洗骨髓腔,直至骨发白,收集冲洗液,反复吹打使细胞打散,静置10分钟,小心将上清移至灭菌的10m l离心管中,4℃3000r p m离心3分钟,弃上清,用含10%特级胎牛血清的L-DMEM培养液重悬细胞,反复吹打混匀,4℃3000r p m离心3分钟,弃上清,再用含10%特级胎牛血清的L-D M EM培养液重悬细胞,反复吹打混匀,4℃3000r p m离心3分钟,弃上清,再用含10%特级胎牛血清的L-DMEM培养液重悬细胞,反复吹打混匀,调整细胞密度为5×105个/ml接种于25cm2培养瓶中,置于5%C02,37℃,饱和湿度95%的培养箱中培养4小时后,轻轻吸出上清,并加入新鲜培养液。培养24小时后轻轻吹打,使未贴壁的细胞悬浮,吸出上清,加入新鲜的培养液,继续培养。以后每天换液1次,并观察细胞形态。 1.2.2 小鼠骨髓间充质干细胞的传代培养原代细胞生长接近瓶底的80%时,吸去上清,加入0.125%胰蛋白酶,37℃条件下消化并观察细胞形态,待细胞呈球形、不在粘连时吸弃胰酶,加入新鲜培养液重悬细胞,4℃3000r pm离心3分钟,弃上清,再加入培养液重悬细胞,反复吹打混匀,按1:2比例接种到新的培养瓶,置于5%C02,37℃,饱和湿度95%的培养箱中继续培养,仍然每天换液,直至细胞贴壁融合成片,接近瓶底80%时,重复以上操作,再次传代。 1.2.3 小鼠骨髓间充质干细胞的表型鉴定收获第4代及第8代生长良好的细胞,胰酶消化后,4℃1000r p m离心5分钟,弃上清,PBS洗涤细胞2次,每代细胞分别设2管,调节每管细胞数为5×105,分别加入C D29和C D44、CD34和CD45单抗,室温孵育30分钟,PBS洗涤细胞3次,流式细胞仪检测分析,同时用PBS作为一抗设置阴性对照。 2 结果 2.1 小鼠骨髓间充质干细胞的原代培养及扩增培养4小时后吸出上清,加入新鲜培养液后,大多数悬浮细胞被吸出,瓶中细胞数目明显减少,并且都呈现球转,折光率较强,原代分离的间充质干细胞在接种后培养24小时,细胞开始贴壁,胞体呈圆形或多边形,培养第3-5天,细胞开始较紧密贴附壁上并开始有细胞呈梭形,并不断长大、变长,但未观察到细胞分裂,培养第7天开始观察到细胞分裂(图1),随着细胞数的增加,细胞的生长速度变快,逐渐成漩涡状排列,培养第12天贴壁细胞长满瓶底的80%,并融合成片(图2)。传代后细胞生长迅速,培养7天左右即可长满瓶底的80%。传至10代仍具有良好的增殖活性。
实验四 腹水型单抗的制备及纯化
实验四腹水型单抗的制备及纯化 迄今为止,通常情况下均采用动物体内生产单抗的方法,鉴于绝大多数动物用杂交瘤均由BALB/c小鼠的骨髓瘤细胞与同品系的脾细胞融合而得,因此使用的动物当然首先BALB/c 小鼠。本方法即将杂交瘤细胞接种于小鼠腹腔内,在小鼠腹腔内生长杂交瘤,并产生腹水,因而可得到大量的腹水单抗且抗体浓度很高。可见该法操作简便、经济,不过,腹水中常混有细胞及其残渣、小颗粒物质、脂肪滴以及小鼠的各种杂蛋白,因此在很多情况下要提纯后才能使用。而腹水单抗的纯化是一个相当困难的工作,本实验将进行IgG1型腹水单抗的提纯方法。 材料: 1、成年BALB/c小鼠。 2、灭菌液体石蜡或福氏不完全佐剂;处于对数生长期的杂交瘤细胞;新鲜采集的腹水 (或冻存的腹水)。 3、饱和硫酸铵(pH7.2-7.4)溶液,正辛酸,0.1M NaOH,1M NaOH,0.06M,pH4.0 NaAc-HAc缓冲液,0.01M,pH7.4 PBS,10×PBS(0.01M,pH7.4)。 方法: 一、腹水的制备 1.取12周龄的BALB/ c小鼠腹腔注射灭菌石蜡,0.5ml/只或腹腔注射福氏不完全佐剂, 0.2-0.3ml/只。 2.1周后(注射灭菌液体石蜡)或3天后(注射福氏不完全佐剂)腹腔接种用PBS或无血清培养基稀释的杂交瘤细胞,每只小鼠1—3×106/0.3ml。 3.间隔5天后,每天观察小鼠腹水产生情况,如腹部明显膨大,以手触摸时,皮肤有紧张感,即可用16号针头采集腹水,一般可连续采2-3次,通常每只小鼠可采5-10ml腹水。将腹水离心(2000rpm离心5min),吸去最上层的脂肪组织,除去细胞成分和其他的沉淀物,收集上清,将上清加入50﹪甘油冻存于-20℃冰箱,留下一小部分测定效价。 二、辛酸—硫酸铵法纯化腹水中的单抗 1.取3ml腹水,2500r/min离心弃杂质,加入0.06M,pH4.0 NaAc-HAc缓冲液3ml,调pH 至4.8(用0.1M NaOH调); 2.加入99ul正辛酸(33ul/ml腹水),室温搅拌≥30min,4℃搅拌≥60min,逐滴加完,4℃澄清2h(20min); 3.取出15000r/min离心30min(10min)(4℃),去沉淀(白蛋白和其它非IgG蛋白),上清加入1/10体积的10×PBS(0.01M,pH7.4),用1M NaOH调pH至7.2; 4.上清滴加等量饱和硫酸铵(pH7.2-7.4)溶液,使硫酸铵的饱和度为50%,继续搅拌10-30min,静置30min; 5.10000rpm(4℃)离心30min(10min),弃上清,将沉淀溶于1.2ml,0.01M,pH7.4 PBS 中, 6.0.01M,pH7.4 PBS透析过夜(4℃),其间换液3次,收集透析袋内液体,—20℃保存备用。少数测效价。
小鼠骨髓干细胞取样制备方法
小鼠骨髓干细胞取样制备方法 Mouse SP protocol 1.水浴设置在37度,并用温度计量确认温度。预热DMEM+,预冷HBSS+ 2.使用 5-8 周龄雄性小鼠,取大腿骨和胫腓骨处的骨髓悬浮于HBSS+、 1)杀死小鼠,背朝下躺着,用70% 酒精喷洒腹部灭菌、 2)臀部稍下方用齿状刀口的剪刀水平切开腹部皮肤、 3)从此刀口同时向上向下同时撕裂皮肤,用钳子钳住膝盖骨扯下所有腿部皮肤、 4)从膝盖处剪断,取下胫腓骨,尽可能将肌肉组织剔除干净,剪掉脚,将其放于陪替 氏培养皿,其中放有5 ml左右预冷的HBSS+,置于冰上、 5)剔除干净大腿骨上的肌肉类组织,在臀部处剪掉大腿骨,骨髓细胞主要在这里,所 以尽可能取得更多的大腿骨,骨上组织尽可能剔出的越干净越好,以免骨髓细胞粘 附上面、将其置于培养皿、 6)一个小鼠取得四段腿骨, 用钳子固定垂直培养皿方向固定腿骨,用27-G 10ml注射 器打入HBSS+、骨髓细胞会从另一端推出,尽可能取得更多细胞,腿骨上下颠倒再 推打, 骨髓取出后腿骨会变白的、 7)用 18-G 针头反复推吸4-5次培养皿里的细胞,以打散团块细胞、但尽量不要打入 气体,因为气泡容易导致细胞死亡、将细胞转移到50ml的PP离心管里,同时用 70um的滤网过滤去处碎骨或团块, 计数有核细胞、 3.精确计数有核细胞、(平均5 x 107 有核细胞/6周龄的C57Bl/6 小鼠)、 4. 5 min 500g 4°C离心,弃上清,加溶血素裂解红细胞: 注:当红细胞较多时细胞悬液:红细胞裂解液=1:8室温静置10min 当红细胞较少时细胞悬液:红细胞裂解液=1:4室温静置5min 红细胞裂解液为10×,临用前用DDW稀释成1× 5.用HBSS+(2%FBS)洗细胞(5 min 500g 4°C离心) 6.用预热的DMEM(2%FBS)调整细胞浓度为106/ml 7.分两管,其中一管加入verapamil,verapamil的终浓度为100 μM,封口膜封好37度水 浴10min后,和另一管同时加入Hoechst 33342染色,终浓度5ug/ml ,37度水浴90min,
_骨髓间充质干细胞在骨科中的应用
第9卷第18期·总第122期 2011年09月·下半月刊 87骨髓间充质干细胞在骨科中的应用※ 陈亮1陈跃平1,2* 摘要:骨髓间充质干细胞(BMSC)是一种来自中胚层发育的早期干细胞,具有多向分化潜能的特性,可分化为骨细胞、软骨细胞、脂肪细胞等。临床上还运用BMSC治疗骨科疾病大量的体外实验已获成功。 关键词:骨髓间充质干细胞;骨科学;文献综述 doi:10.3969/j.issn.1672-2779.2011.18.055 文章编号:1672-2779(2011)-18-0087-03 骨髓中含有2类干细胞,①造血干细胞,它为循环血液提供前体细胞;②非造血性干细胞,它是骨髓中造血结构性和功能性支持细胞,在调节造血干细胞的长期存活,生长分化中起重要作用。早期分离培养时,发现其形状呈成纤维细胞样而称其为“成纤维细胞集落形成单位”或“骨髓基质成纤维细胞”。随着研究的深入,人们发现其对骨髓造血干细胞起支持诱导作用,又因其来自于骨髓基质,因而称其为“骨髓基质细胞”。因其在不同的诱导条件下,有向中胚层组织细胞分化的能力,又称其为“骨髓间充质干细胞”。 1 骨髓间充质干细胞多向分化特性 多向分化潜能被认为是BMSC最重要的生物学特征。大量体外实验证明,在不同诱导条件下,BMSC可以向多种中胚层来源的组织细胞分化,如成骨细胞、软骨细胞、脂肪细胞等。 1.1 BMSC向成骨细胞的定向诱导分化BMSC在体外培养中,通过地塞米松、β磷酸甘油和抗坏血酸等的诱导,能够分化为成骨细胞。Ouyang等[1]在培养基内加入抗坏血酸后BMSC排列紧密呈片状生长,将BMSC片与去除矿物质的移植骨片结合植入受损部位,3周后形态学、组织学、免疫组织化学观察显示,植入物的结构与正常骨膜相似,并向成骨、软骨分化。 1.2 BMSC向软骨细胞的定向诱导分化BMSC向软骨细胞的定向诱导分化将此分离的BMSC加入无血清培养体系中培养,培养体系中加入转化生长因子β、软骨来源形态形成蛋白及整合素可促使BMSC向软骨细胞分化。舒朝锋等[2]实验证明,在单层诱导培养条件下,人骨髓BMSC能分泌软骨细胞特征性细胞外基质如Ⅱ型胶原、糖胺多糖等,具有作为软骨组织工程种子细胞来源的可能。 1.3 BMSC向脂肪细胞的定向诱导分化 1999年,Pittenger等[3]人的BMSC培养体系中加入甲基异丁基黄嘌呤、地塞米松、胰岛素和茚甲新等,结果成功地诱导出脂肪细胞,细胞内聚集脂滴,并表达过氧化物酶体增殖物激活受体,脂蛋白脂酶和脂肪酸结合蛋白aP2。在这种培养条件下,约95%的细胞向此系分化,细胞内的脂质小泡持续增加直至充满细胞,这些物质可被油红染成红色。 ※基金项目:广西壮族自治区科技厅自然基金[No:2010GXNSFA013223] 作者单位:1 广西中医学院附属瑞康医院骨科(南宁530011) 2 南方医科大学在读博士(南宁530011) *通讯作者 2 骨髓间充质干细胞的分离方法 骨髓中BMSC含量很少,仅占骨髓内单个核细胞总数的0. 001%~0.01%,并随年龄的增加而减少,因此,必须实现其体外分离培养、扩增。目前BMSC的分离方法主要以下几种:①密度梯度离心法:主要根据骨髓中细胞成分的比重不同,清除红细胞,分离提取骨髓单个核细胞进行贴壁培养。目前较常用Percoll 液(1.073 g/ml)和Ficoll 液(1.077 g/ml)进行密度梯度离心。值得注意的是,不同密度的分离液对BMSC的纯度影响极大。这种方法分离培养的BMSC大小均匀,纯度较高,Pittenger等[4]在过密度梯度离心法分离培养的BMSC在第1代纯度可达95%,第2代达98%。因此该法被广泛采用。②贴壁筛选法:即全骨髓法,是根据BMSC贴壁生长而造血系细胞悬浮生长的特性,通过定期换液除去不贴壁细胞,收集贴壁生长BMSC,其纯度可达95%。目前多用这两种方法,细胞的粘附特性仍是分离和纯化BMSC的最基本原则,物理性富集后塑料器皿内的贴壁培养仍是分离BMSC的最基本方法,更好的分离方法还有待于进一步的探索。 3 BMSC的表面标志及鉴定 3.1 表面标志到目前为止,BMSC的表面抗原具有非专一性,它表达了间质细胞、内皮细胞和表皮细胞的表面标志。主要包括:①粘附分子,如CD166、CD54、CD102、CD44、CD106等。②生长因子和细胞因子受体,如IL-1受体、IL-3受体、IL-4受体、IL-6受体、IL-7受体、干扰素γ受体、肿瘤坏死因子α等。③整合素家族成员,包括CD49a、CD49b、CD49c、CD29、CD104等。④其它,如CD90、CD105等。不表达造血细胞的表面标志,如CD34、CD45、CD14、CD3、CD4、CD8等,也不表达与人白细胞抗原识别有关的共刺激分子B721、B722及主要组织兼容性复合物Ⅱ类分子如人白细胞DR 抗原等[5,6]。此外,BMSC自身还能产生一些造血及非造血的生长因子、白细胞介素和化学激动因子,但除细胞因子是持续性产生外,其它的仅仅在受到刺激后表达,BMSC还能产生一系列的基质分子,包括纤维连接素、胶原、蛋白聚糖,还能表达基质2细胞,细胞2细胞等相互作用的反受体,其中特别有关的是对CD44强表达,CD44是多种配体的受体,其分别在骨、骨髓中对细胞外基质构建起着重要的作用[7,8 ]。 3.2 鉴定对BMSC进行鉴定可联合细胞化学和流式细胞分析方法[9]。细胞化学方法,BMSC具有独特的代谢特点,几乎所有细胞酸性萘酚酸酯酶及糖原阳性,酸
