河南省商丘市高考化学第二轮复习 专题十六 有机化学基础(二)教学案

专题十六有机推断与合成
【考纲要求】:
1.进一步加深和掌握有机化学中重要官能团的结构、性质、基本有机反应、同分异构体等有机化学的主干知识。
2.能够根据已知的知识和相关信息,对有机物进行逻辑推理和论证,得出正确的结论或作出正确的判断,并能把推理过程正确地表达出来
【知识梳理】
一、有机知识储备
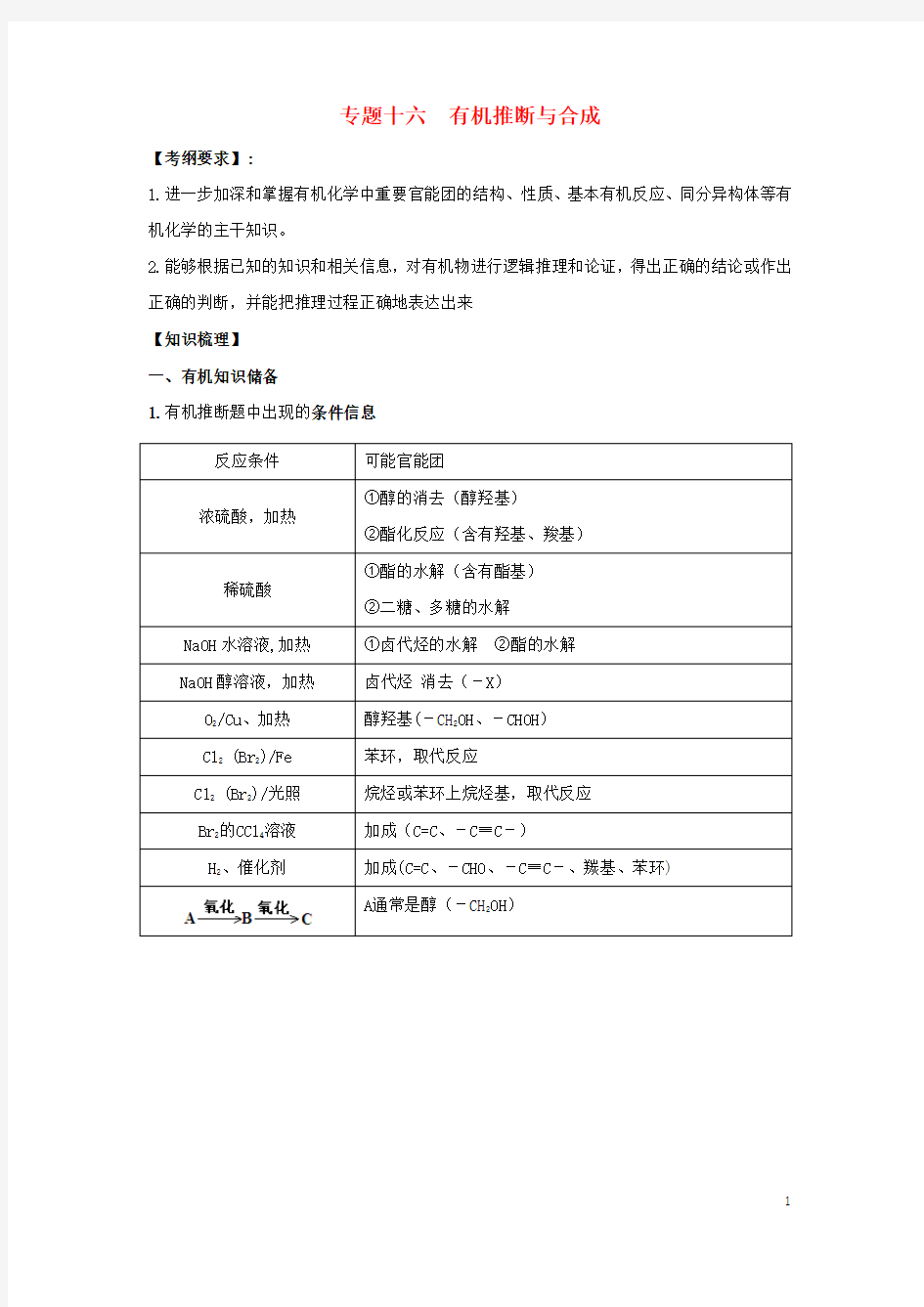
1.有机推断题中出现的条件信息
2. 有机推断题中出现的性质信息
3.官能团引入:
4.根据反应产物推测官能团的位置
(1).由醇氧化为醛或酮及羧酸的情况,判断有机物的结构。当醇氧化成醛或酸时应含有“-CH2OH”,若氧化为酮,应含有“-CH-OH”
(2).由消去反应产物可确定“-OH”和“-X”的位置。
(3).由取代产物的种数确定H的个数及碳架结构。
(4).由加氢后的碳架结构,确定“C=C”或“C≡C”的位置。
二、有机推断题的解题思路:
①剖析要合成的物质(目标分子),选择原料,路线(正向、逆向思维,结合题给信息)
②合理的合成路线由什么基本反应完全,目标分子骨架
③目标分子中官能团引入
【典型例题1】下图中A、B、C、D、E、F、G均为有机化合物。
根据上图回答问题:
(1)D 的化学名称是 。 (
2
)
反
应
③
的
化
学
方
程
式
是 。 (有机物须用结构简式表示)
(3)B 的分子式是 。A 的结构简式是 。反应①的反应类型是 。
(4)符合下列3个条件的B 的同分异构体的数目有 个。
i )含有邻二取代苯环结构、ii )与B 有相同的官能团、iii )不与FeCl 3溶液发生显色反应。 写出其中任意一个同分异构体的结构简式 。 (5)G 的重要的工业原料,用化学方程式表示G 的一种重要的工业用途 。 [思维点拨]
本题(1),(2),(3)问可从特殊反应条件和常见物质组成突破,可由A 在“NaOH/H 2O /△”条件下反应后再酸化知B 、C 、D 为醇和酸,又由D 的组成可知D 为乙醇,G 为乙烯(也可由D 到G 的特殊反应条件,和D 、G 的组成推出D 、G );由C 与D(乙醇)的反应条件“浓硫酸, △”和F 的组成推出C 为乙酸,F 为乙酸乙酯;由E 的结构式知E 中有酯基,结合反应条件“浓硫酸, △”,采用逆向思维推出B 的结构简式,再根据A 、B 、C 、D 的组成和结构正逆向思维相结合推出A 的结构简式,前三问答案为:(1)乙醇(2)CH 3COOH +
CH 3CH 2OH ??
?→??
浓硫酸,CH 3COOCH 2CH 3+H 2O (3)C 9H 10O 3
解本第(4)问首先确定B 的结构简式为(如下图):
根据ii )知道同分异构体的官能团为一个羧基和一个羟基,由iii )知道同分异构体中不含酚羟基,即羟基不能直接与苯环相连,又由i )知道同分异构体中含有苯环且取代基在邻位,
综合以上推导出的官能团种类和同分异构体的大致骨架结构,可知同分异构体中除含苯环、羧基外不可能再含其 它不饱和结构,只用改动B 中羧基和羟基与苯环之间碳的连接顺序即可和官能团位置即可,其实转化为了最简单的碳链异构和位置异构,①在B 的基础上让羧基和羟基同在一个饱和碳原子上可写出Ⅰ式(位置异构),②让羟基和两个饱和碳原子在一个取代基上,羧基直接和苯环相连可写出Ⅱ和Ⅲ式(碳链异构和位置异构)。 第(4)问答案为3种,同分异构体可写出上述三式中任一种。
本题(5)问考察物质用途和方程式的书写,可写以下两反应中的任一种:
nCH 2=CH 2??
→?催化剂CH 2-CH 2 或 CH 2=CH 2+H 2O ??→?催化剂
CH 3CH 2OH 【典型例题2】.A 、B 、C 、D 、E 、F 和G 都是有机化合物,它们的关系如下图所示:
(1)化合物C 的分子式是C 7H 8O ,C 遇到FeCl 3 溶液显示紫色,C 与溴水反应生成的一溴代物只 有两种,则C 的结构简式为 ; (2)D 为一直链化合物,其相对分子质量比化 合物C 的小20,它能跟NaHCO 3反应放出CO 2, 则D 分子式为 ,
D 具有的官能团是 ;
(3)反应①的化学方程式是 ;
(4)芳香化合物B 是与A 具有相同官能团的A 的同分异构体,通过反应②化合物B 能生成E 和F ,F 可能的结构简式是 ;
(5)E 可能的结构简式是 。 解析:(1)可以很容易地判断出C 是对甲基苯酚。
(2)C 的相对分子质量是108,则D 的相对分子质量为88,从转化关系知,其中含有一个羧基,其式量是
45,剩余部分的式量是43 ,应该是一个丙基,则D 的分子式是C 4H 8O 2,是正丁酸。具有的官能团为羧基。
(3)化合物A 是丁酸对甲基苯酚酯,要求写的是该物质水解的化学方程式,在酸性条件下水解生成对甲基
苯酚和丁酸。
(4)根据G 的分子式,结合反应②可知,F 的分子式是C 3H 8O,其结构有两种,分别是丙醇和异丙醇。
E是芳香酸,其分子式是C8H8O2.
(5)符合题意的结构有四种:分别是苯乙酸、邻甲基苯甲酸、间甲基苯甲酸、对甲基苯甲酸。
[
答案:
【智能检测】
请回答下列问题:
(1)根据系统命名法,B的名称为。
(2)官能团-X的名称为,高聚物E的链节为。
(3)A的结构简式为。
(4)反应⑤的化学方程式为。
(5)C有多种同分异构体,写出期中2种符合下列要求的同分异构体的结构简式。
i.含有苯环 ii.能发生银镜反应 iii.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是(填序号)。
a.含有苯环
b.含有羰基
c.含有酚羟基
2: (09年全国理综卷I·30)化合物H是一种香料,存在于金橘中,可用如下路线合成:
已知:(B2H6为乙硼烷)回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以生成88gCO2和45gH2O。A的分子式是;
(2)B和C均为一氯代烃,它们的名称(系统命名)分别为;(3)在催化剂存在下1molF与2molH2反应,生成3—苯基—1—丙醇。F的结构简式是
;
(4)反应①的反应类型是;
(5)反应②的化学方程式为;
(6)写出所有与G均有相同官能团的G的芳香类同分异构体的结构简式
。
3.(09年山东理综·33)
下图中X是一种具有水果香味的合成香料,A是有直链有机物,E与FeCl3溶液作用显紫色。
请根据上述信息回答:
(1)H中含氧官能团的名称是,B→I的反应类型为。(2)只用一种试剂鉴别D、E、H,该试剂是。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式
为。
(4)D和F
反应生成
X的化学
方程式为
。
4.(2008全国理综Ⅱ29).
A、B、C、D、E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:
(1)B和C均为有支链`的有机化合物,B的结构简式为;
C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为
(3)写出⑤的化学反应方程式。
⑨的化学反应方程式。
(4)①的反应类型,④的反应类型,⑦的反应类型。
(5)与H具有相同官能团的H的同分异构体的结构简式为
。 5.(09年安徽理综·26)
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
(1)A 与银氨溶液反应有银镜生成,则A 的结构简式是 。 (2)B→C 的反应类型是 。 (3)E 的结构简式是
(4)写出F 和过量NaOH 溶液共热时反应的化学方程式: (5)下列关于G 的说法正确的是( )
a .能与溴单质反应 b. 能与金属钠反应 c. 1molG 最多能和3molH 2反应 d. 分子式是C 9H 6O 3
6[2012·重庆理综化学卷28]衣康酸M 是制备高效除臭剂、粘合剂等多种精细化学品的重要原料,可经下列反应路线得到(部分反应条件略)
.
(1)A 发生加聚反应的官能团名称是 ,所得聚合物分子的结构型式是
(填“线型”或“体型”)。 (
2
)
B
→
D
的
化
学
方
程
式
为 。
(3)M 的同分异构体Q 是饱和二元羧酸,则Q 的结构简式为 (只写一种)
(4)已知 ,E 经五步转成变成M 的合成反应流程为:
① E →G 的化学反应类型为 ,
G →H 的化学反应方程式为 ② J →L 的离子方程式为
CN
CH 2△
NaOH 水溶液
→—CH 2
COONa + NH
3
E
→Cl 2
光照
CH 2
CH 2C CN
CH 2Cl △NaOH 水溶液
→
O 2催化剂
→
△
→
△酸化
→银氨溶液
G
H
J
L
M
学案26 专题十七有机推断与合成专题参考答案
1.答案::(1)1—丙醇(2)羧基(3)
(4)
(5)、、写出上述3个结构简式中的任意2个(6)c
2.答案:(1)C4H10(2)2—甲基—1—氯丙烷、2—甲基—2—氯丙烷
(3)(4)消去反应
(5)
(6)、、、
3.(1)羧基消去反应(2)溴水(3)CH3COOCH=CH2
(4)
4.答案:(1)
(2)(3)
(4)水解反应,取代反应,氧化反应(5)CH3CH=CHCOOH CH2=CHCH2COOH
5:(1)CH3CHO (2)取代反应(3)
(4)
(5)a、b、d
6. (1)碳碳双键,线型(2)
(3)
(4)①取代反应
②
高考化学专题复习:化学与生活1
《化学与生活》自选模块 1、 海产品中常含有较多的碘元素,因此海边的居民很少患碘缺乏病。某化学兴趣小组的 同学通过以下步骤提取海带中的碘: (1)灼烧过程可在下列哪种仪器中进行( )。 A 、烧杯 B 、试管 C 、蒸发皿 D 、坩埚 (2)过滤用到的玻璃仪器主要有 。 (3)用有机溶剂将碘从水中提取出来的过程叫 。若用CCl 4 作溶剂进行提取,则分层后上层为 。 提取碘的过程中,还可选用的有机溶剂为( )。 A 、酒精 B 、苯 C 、汽油 D 、甘油 答案:(1)D (2分) (2)烧杯、玻璃棒、漏斗(3分) (3)萃取(2分)、水(1分); B (2分) 2、氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上曾普遍采用高纯硅与纯氮在1300℃时反应获得氮化硅。 (1)画出N 的原子结构示意图: 。根据元素周期律知识,写出氮化硅的化学式: 。 (2)根据性质,推测氮化硅陶瓷的用途是 (填序号)。 A 、制汽轮机叶片 B 、制有色玻璃 C 、制永久性模具 D 、制造柴油机 (3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。请写出该陶瓷被氢氟酸腐蚀的化学方程式: 。 (4)现用四氯化硅和氮气在氢气气氛的保护下,加强热发生反应,可获得较高纯度的氮化 硅,反应的化学方程式为 。 答案:(1 (2分) Si 3N 4 (2分) (2) (3)Si 3N 4 + 12HF =3SiF 4↑+ 4NH 3↑(2分) (4)3SiCl 4+2N 2+6H 2 Si 3N 4+ 12HCl (2分) 注:TSP —空气中漂尘,NOx —含氮氧化物,SOx —硫的氧化物 (1)这五个县市中,空气质量最好的县市是 ,最差的县市是 。 (2)最容易出现酸雨的县市是 。为预防出现酸雨,降低煤燃烧时向大气排放高温
高考化学知识点专题汇编 (11)
课时跟踪检测(五十三)陌生有机物的结构与性质 1.(2020·茂名模拟)轴烯是一类独特的星形环烃。下列关于三元轴烯()说法不正确的是() A.可以使酸性高锰酸钾溶液褪色 B.所有原子在同一平面 C.与1,3-丁二烯()互为同系物 D.与苯互为同分异构体 解析:选C该分子中含有C===C双键,所以能使酸性高锰酸钾溶液褪色,A正确;由于C===C双键构成的平面结构,所以该分子的所有原子在同一平面上,B正确;该分子含有三个C===C双键和一个碳环,而只有两个C===C双键,所以二者结构不相似,不是同系物,C错误;该分子的化学式为C6H6,与苯的化学式相同,但结构不同,所以二者互为同分异构体,D正确。 2.化合物X()是一种医药中间体。下列有关化合物X的说法正确的是() A.该物质分子式为C10H9O4 B.在酸性条件下水解,水解产物只有一种 C.分子中所有原子处于同一平面 D.1mol化合物X最多能与2mol NaOH反应 解析:选B A项,由化合物X的结构简式可知该有机物分子式为C10H8O4,错误;B 项,该有机物具有环酯结构,则水解产物只有一种,正确;C项,含有饱和烃基,具有甲烷的结构特点,则所有原子不可能在同一个平面上,错误;D项,含有羧基、酯基,且酯基可水解生成酚羟基和羧基,则1mol化合物X最多能与3mol NaOH反应,错误。3.牛至是一种质地坚硬、树枝茂密的多年生药草,下列三种结构简式表示的物质是从牛至中提取出来的活性成分。下列有关说法正确的是() A.c分子中最多有7个碳原子共平面 B.可用溴的CCl4溶液将a、b两种物质区别开 C.完全燃烧1mol三种物质时消耗氧气的量:a>c>b D.a分子与HCl发生加成反应时可得到四种以上产物
高考化学复习专题
高考化学复习专题——信息迁移式试题 [考纲要求] 能够从试题提供的新信息中,准确地提取实质性内容,并经与已有知识块整合,重组为新知识块的能力。 信息迁移式试题(又称信息给予题),是由题干给出信息,要求考生运用已学的知识解决新情景中的若干问题。这种试题的特点是题型新颖,材料陌生,构思别致,思维量大。能有效地考查考生的自学能力和思维能力。具有很好的选拔功能,这是高考题型改革的发展趋势。解题时一是会利用外显信息正确模仿迁移;二是排除干扰信息,进行合理筛选有效信息迁移;三是挖掘潜在信息,注重联想类比迁移。 一、直接利用题目呈现的信息 [试题回顾] 1. 氟化钠是一种用于农作物杀菌、杀虫剂和木材的防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵; 已知:20℃时氯化铵的溶解度为37.2g,氟化钠的溶解度为2g,Na2SiF6微溶于水:(1)流程①中H2SiF6和NH4HCO3反应得到的NH4F与H2SiO3组成浑浊液,请写出流程②中相关反应的化学方程式:②。 (4)流程①中NH4HCO3必须过量,其原因是。 2. 海波(Na2S2O3?5H2O) 可用作脱氯剂、定影剂、解毒剂。硫粉和亚硫酸纳溶液煮沸可制得Na2S2O3?5H2O;Na2S2O3?5H2O的部分性质见下表:
物理性质易溶于水,不溶于乙醇;熔点48.2 ℃;在潮湿的空气中易潮解 化学性质43℃以上的空气中易风化;遇酸易分解(S2O32―+2H+=S↓+SO2↑+H2O ) 实验室制备海波过程如下: (1)实验开始时,加入1 mL C2H5OH 的目的是 (3)过滤后发现滤渣B 中有少量淡黄色物质。为除去淡黄色物质,洗涤滤渣 B 的操作过程是 (4)烘干滤渣B 时应注意什么问题,原因是 [课堂练习] 3.(2007天津卷)二氯化二硫(S2C12)在工业上用于橡胶的硫化。为在实验室合成S2C12,某化学研究性学习小组查阅了有关资料,得到如下信息: ①将干燥的氯气在110℃~140℃与硫反应,即可得S2C12粗品。 ②有关物质的部分性质如下表: 物质熔点/℃沸点/℃化学性质 S 112.8 444.6 略 S2C12-77 137 遇水生成HCl、SO2、S;300℃以上完全分解; S2C12 + C12 2SCl2 设计实验装置图如下: ⑴.上图中气体发生和尾气处理装置不够完善,请你提出改进意见 ____________________________________________________________________________。
最新高考化学题型专题训练(共23页 附答案)
最新高考化学题型专题训练(共23页 附答案) 高考题型练(一) 1.我国酒文化源远流长。下列古法酿酒工艺中,以发生化学反应为主的过程是( ) A .酒曲捣碎 B .酒曲发酵 C .高温蒸馏 D .泉水勾兑 解析:酒曲捣碎是物质形状的变化,是物理过程,A 错。酒曲发酵是淀粉转化为葡萄糖,葡萄糖再分解为乙醇和二氧化碳,是化学过程,B 正确。高温蒸馏是利用乙醇和水的沸点不同将乙醇蒸出,是物质状态的变化,属于物理过程,C 错。泉水勾兑是乙醇和水的简单混合,属于物理过程,D 错。 答案:B 2.用N A 表示阿伏加德罗常数的值,下列说法正确的是( ) A .常温常压下,36 g 18O 2中所含的中子数为16N A B .8.0 g Cu 2S 和CuO 的混合物中含有的铜原子数为0.1N A C .电解饱和食盐水时,阳极生成22.4 L 气体时,转移的电子数为2N A D .室温下向1 L pH =1的醋酸溶液中加水,所得溶液中H + 数目小于0.1N A 解析:1个18O 2中含20个中子,36 g 18O 2为1 mol ,所含中子数为20N A ,A 项错误;设Cu 2S 的质量为m g ,则8.0 g Cu 2S 和CuO 的混合物中含有的铜原子数为(m 160×2+8.0-m 80)×N A = 0.1N A ,B 项正确;反应2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑中转移2e - ,则阳极生成标准状况下22.4 L Cl 2时,转移的电子数为2N A ,题中没有说明气体所处的状态,C 项错误;1 L pH =1的醋酸溶液中H + 数目为0.1N A ,加水稀释,醋酸的电离程度增大,故所得溶液中H + 数目大于0.1N A ,D 项错误。 答案:B 3.实验室中,从海藻里提取碘的部分流程如图。下列说法中,不正确的是 ( ) A .试剂a 可选用酸化的双氧水 B .试剂b 可选用酒精 C .步骤③的操作是过滤 D .步骤①需用坩埚,步骤⑤需用分液漏斗 解析:海藻灼烧得到海藻灰,浸泡得到悬浊液,过滤得到含I - 的溶液,加入试剂a ,I - 被氧
高考化学专题复习——常见气体的制备学案
第十六单元常见气体的制备气体制备的一般装置流程:
在气体制备过程中可能的副反应、试剂的挥发性、水的挥发都可能使制得的气体中含有杂质气体。可以选用适当的方法净化。 1.干燥 (1) (2)
常用的固体干燥剂有:等,碱石灰不能用于酸性气体的干燥,P2O5则不能用于碱性 气体(如NH3)的干燥。 2.洗气 浓硫酸作为干燥剂时不能干燥碱性气体和一些还原性气体。 如:等 3.固体加热吸收 如用灼热铜网除去O2,灼热除去H2等 4.干燥剂的选择 除去气体中混有少量水分的方法叫做气体的干燥。选择干燥剂的原则是被干燥的气体不能与干燥剂发生化学反应。 常用气体干燥剂按酸碱性可分为三类: ①酸性干燥剂,如浓硫酸、五氧化二磷。酸性干燥剂能够干燥显酸性或中性的气体,如CO2、SO2、NO2、HCl、H2、Cl2、O2、CH4等。 ②碱性干燥剂,如生石灰、碱石灰、固体NaOH。碱性干燥剂可以用来干燥显碱性或中性的气体,如NH3、H2、O2、CO、CH4等。 ③中性干燥剂,如无水氯化钙等,可以干燥中性、酸性、碱性气体,如O2、H2、CO、CH4等(NH3除外)。 在选择干燥剂时,显碱性的气体不能用酸性干燥剂,显酸性的气体不能选用碱性干燥剂。有还原性的气体不能选用有氧化性的干燥剂。能与气体反应的物质不能选作干燥剂,如不能用浓硫酸干燥NH3、H2S、HBr、HI等,不能用CaCl2来干燥NH3(因生成CaCl2·8NH3)
四、常见气体的检验
五、气体的收集 1.排水(液)法 Cl2收集可用排饱和食盐水收集。 一般排水法收集的气体纯度比排气法好。但与水反应的气体 (如NO2)、易溶于水的气体(如HCl、NH3)不能用排水法收集 2.排空气法 与空气中成分能反应的气体(如NO)、密度与空气差不多的气体(如C2H4、CO)不能用排空气法收集 六、尾气的处理 有毒有害尾气应该进行适当的处理,以免污染环境。 1.用液体吸收
高考化学知识点专题汇编 (10)
课时跟踪检测(五十七)物质制备类综合实验 1.二氯化一氯五氨合钴(Ⅲ),化学式为[Co(NH3)5Cl]Cl2,摩尔质量为250.5g·mol-1,常温下为紫红色固体,难溶于水,不溶于乙醇,工业上可用作聚氯乙烯(PVC)的染色剂和稳定剂。实验室制备二氯化一氯五氨合钴(Ⅲ)的流程如下: 已知:[Co(NH3)5H2O]Cl3===[Co(NH3)5H2O]3++3Cl-; [Co(NH 3)5Cl]2++H2O[Co(NH3)5H2O]3++Cl-; [Co(NH3)5H2O]3+受热可以产生氨。 (1)往黄红色沉淀[Co(NH3)6]Cl2中加H2O2时发生的离子反应方程式为 ________________ __________________________________________________________________________。 (2)下列操作或描述正确的是________。 A.步骤②,过滤得到黄红色沉淀[Co(NH3)6]Cl2,往该沉淀中加双氧水溶液 B.步骤②,双氧水溶液要缓慢滴加,是为了控制反应温度,防止温度过高发生副反应C.步骤④,水浴温度低于85℃时产率下降,可能是因为温度对反应速率的影响比较大D.步骤⑥,抽滤之后,吸滤瓶中的滤液应从吸滤瓶的支管倒出 (3)在步骤⑥中对产品进行抽滤,选择正确操作的编号,将下列步骤补充完整:组装好装 置,将滤纸置于布氏漏斗内,用少量蒸馏水润湿→________→用倾析法将溶液转移入布氏漏斗中→________→将烧杯中剩余沉淀转移入布氏漏斗中,抽滤至干燥→________→取下吸滤瓶,用滤液冲洗烧杯中残留固体,再重新抽滤。 a.微开水龙头;b.开大水龙头;c.微关水龙头;d.关闭水龙头,拔下橡皮管;e.拔下橡皮管,关闭水龙头;f.不对水龙头进行操作。 (4)在步骤⑥中洗涤操作为先用冷水洗涤,再用乙醇洗涤。用乙醇洗涤的目的是 ____________。 (5)最终得到产品的质量为21.4g,则该实验的制备产率为__________。 解析:(1)由流程图可知[Co(NH3)6]Cl2被H2O2氧化为[Co(NH3)5H2O]3+,反应的离子方程式为2[Co(NH3)6]Cl2+H2O2+2NH+4===2[Co(NH3)5H2O]3++4NH3↑+4Cl-或2[Co(NH3)6]Cl2+H2O2+4H+===2[Co(NH3)5H2O]3++2NH+4+4Cl-。(2)A项,步骤①过滤得到黄红色沉淀[Co(NH3)6]Cl2,错误;B项,反应速率过快短时间内放出的热量过多,而由信息可知温度过高[Co(NH3)5H2O]3+会分解,所以应缓慢滴加,正确;D项,吸滤瓶中的液体应直接倒出,错误。(3)抽滤开始和结束打开水龙头都应该先慢后快。(4)由于
(最新)2020高考化学二轮复习 第一部分 专题十五 有机化学基础(选考)专题强化练
专题十五 有机化学基础(选考) 专题强化练 1.(2018·全国卷Ⅲ)近来有报道,碘代化合物E 与化合物H 在Cr-Ni 催化下可以发生偶联反应,合成一种多官能团的化合物Y ,其合成路线如下: 已知:RCHO +CH 3CHO ――→NaOH/H 2O △ RCH===CHCHO +H 2O 回答下列问题: (1)A 的化学名称是________________。 (2)B 为单氯代烃,由B 生成C 的化学方程式为________________ ______________________________________________________。 (3)由A 生成B 、G 生成H 的反应类型分别是________、________。 (4)D 的结构简式为________________。 (5)Y 中含氧官能团的名称为________________。 (6)E 与F 在Cr-Ni 催化下也可以发生偶联反应,产物的结构简式为________________。 (7)X 与D 互为同分异构体,且具有完全相同官能团。X 的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X 的结构简式________________。 解析:A 到B 的反应是在光照下的取代,Cl 应该取代饱和碳上的H ,所以B 为 ;B 与NaCN 反应,根据C 的分子式确定B →C 是将Cl 取代为CN ,所以C 为;C 酸性水解应该得到CHCCH 2COOH ,与乙醇酯化得到D ,所以D 为 CHCCH 2COOCH 2CH 3,D 与HI 加成得到E 。根据题目的已知反应,要求F 中一定要有醛基,在根据H 的结构得到F 中有苯环,所以F 一定为 ;F 与CH 3CHO 发生题目已知反应,得到G ,G 为 ;G 与氢气加成得到H ;H 与E 发生偶联反应得到Y 。 (1)A 的名称为丙炔。
高考电化学专题-复习精华版
2.氢氧燃料电池反应汇总: 介质电池反应2H2 +O = 2H2O 2 酸性负极2H2 - 4e- = 4H+ 正极O2 + 4H+ + 4e-= 4H2O 中性负极2H2 - 4e- = 4H+ 正极O2 + 2H2O + 4e-= 4OH- 碱性负极2H2 +4OH-- 4e- = 4H2O 正极O2 + 2H2O + 4e-= 4OH- 3.固体氢氧燃料电池: 固体电解质介质电池反应:2H2 +O = 2H2O 2 负极 2H2 - 4e- +2O2-= 2H2O 正极 O2 + 4e-= 2O2- 负极2H2 - 4e- = 4H+ 正极 O2 + 4H+ + 4e-= 2H2O 4.甲烷新型燃料电池 以两根金属铂片插入KOH溶液中作电极,又在两极上分别通入甲烷和氧气。 电极反应为: 负极:CH4+10OH--8e-=CO32- + 7H2O 正极:2O2+ 4H2O+8e-= 8OH- 电池总反应:CH4+2O2 + 2KOH =K2CO3+ 3 H2O 分析溶液的pH变化。 C4H10、空气燃料电池、电解质为熔融K2CO3, 用稀土金属材料作电极(具有催化作用) 负极:2C4H1 -52e- + 26CO32-- =34 CO2+10H2O 0
第二课时 电解池原理 一、 电解池基础 定义:使电流通过电解质溶液而在阴阳 两极引起氧化还原反应的过程。 装置特点:电能转化为化学能。 ①、与电源本连的两个电极; 形成条件 ②、电解质溶液(或熔化的电解质) ③、形成闭合回路。 电极 阳极:与直流电源正极相连的叫阳极。 概念 阴极:与直流电源负极相连的叫阴极。 电极反应: 原理:谁还原性或氧化性强谁先放电(发生氧化还原反应) 离子放电顺序: 阳极:阴离子还原性 S 2->I->Br - >Cl ->OH ->SO 42- (含氧酸根)>F - 阴极:阳离子氧化性 Ag +>Fe 3+>Cu 2+ >Pb 2 +>Sn 2+ >Fe 2+>Zn 2+ >H +>A l3+>Mg2+>N a+ 电子流向 e - e- 氧化反应 阳极 阴极 还原反应 反应原理:4OH --4e -=2H 2O +O 2 Cu2++2e -=C u 电解质溶液 电解结果:在两极上有新物质生成。 总反应:2CuSO 4+ 2H 2O = 2Cu+2H 2SO 4+O2↑ 注意:当离子浓度相差较大时,放电顺序要发生变化,相同时按H +,不同时按(H +) 二、 电解池原理 粗铜板作阳极,与直流电源正极相连; ①、装置 纯铜作阴极,与直流电源负极相连; 用CuSO 4 (加一定量H 2SO 4)作电解液。 移向 阴离子 移 向 阳离 子 电 解池原理
高考化学专题训练
高考化学专题训练 ———实验设计 1.图1-1装置是某种气体X的发生装置和收集装置(必要时可加热)。所用的试剂从下列试剂中选取2~3种,硫化亚铁、二氧化锰、铜屑、氯化铵、稀硝酸、浓盐酸、蒸馏水。 请回答下列问题。 (1)气体X的化学式是______。 (2)所选药品a中是_____,b是_____,装置B的作用是_______。 (3)用所选的药品制X时离子方程式是______。 (4)在反应刚开始时A中的主要现象是______。 (5)开关M的作用_____。 2.四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃;金属锡的熔点为231℃,拟用以下仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)请回答下列各个问题。 A.用玻璃管(未画出)连接上述装置,正确的顺序是(填各接口的代字母) ( )接( )、( )接( )、( )接( )、( )接( )、( )接( ); B.装置Ⅵ作用是______;装置Ⅳ的作用是______; C.冷凝管里冷水的流向是从______进入,从________流出; D.实验时应先点燃_______处酒精灯,加热温度应大于______℃,待_______即可停止加热; E.已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为_______。 F.如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是________。 G.为了防止污染空气,在装置的最后应_______。 3.实验室里有一瓶KCl与CaCl2的固体混合物,通过下面实验可确定该混合物中KCl和CaCl2的质量比,也可制得纯净的KCl,根据实验步骤填写下列空白:
高中有机化学复习资料汇总
高考有机化学总复习 专题一:有机物的结构和同分异构体: (一)有机物分子式、电子式、结构式、结构简式的正确书写: 1、分子式的写法:碳-氢-氧-氮(其它元素符号)顺序。 2、电子式的写法:掌握7种常见有机物和4种基团: 7种常见有机物:CH4、C2H6、C2H4、C2H2、CH3CH2OH、CH3CHO、CH3COOH。 4种常见基团:-CH3、-OH、-CHO、-COOH。 3、结构式的写法:掌握8种常见有机物的结构式: 甲烷、乙烷、乙烯、乙炔、乙醇、乙醛、乙酸、乙酸乙酯。(注意键的连接要准确,不要错位。) 4、结构简式的写法:结构简式是结构式的简写,书写时要特别注意官能团的简写,烃基的合并。要通过练习要能识别结构简式中各原子的连接顺序、方式、基团和官能团。掌握8种常见有机物的结构简式:甲烷CH4、、乙烷C2H6、乙烯C2H4、、乙炔C2H2、乙醇CH3CH2OH、乙醛CH3CHO、乙酸CH3COOH、乙酸乙酯CH3COOCH2CH3。 (二)同分异构体:要与同位素、同素异形体、同系物等概念区别,注意这四个“同”字概念的内涵和外延。并能熟练地作出判断。 1、同分异构体的分类:碳链异构、位置异构、官能团异构。 2、同分异构体的写法:先同类后异类,主链由长到短、支链由整到散、位置由心到边。 3、烃卤代物的同分异构体的判断:找对称轴算氢原子种类,注意从对称轴看,物与像上的碳原子等同,同一碳原子上的氢原子等同。 专题二:官能团的种类及其特征性质: (一)、烷烃: (1)通式:C n H2n+2,代表物CH4。 (2)主要性质: ①、光照条件下跟卤素单质发生取代反应。
②、在空气中燃烧。 ③、隔绝空气时高温分解。 (二)、烯烃: (1)通式:C n H2n(n≥2),代表物CH2=CH2,官能团:-C=C- (2)主要化学性质: ①、跟卤素、氢气、卤化氢、水发生加成反应。 ②、在空气中燃烧且能被酸性高锰酸钾溶液氧化。 ③、加聚反应。 (三)、炔烃: (1)通式:C n H2n-2(n≥2),代表物CH≡CH,官能团-C≡C- (2)主要化学性质: ①、跟卤素、氢气、卤化氢、水发生加成反应。 ②、在空气中燃烧且能被酸性高锰酸钾溶液氧化。 ③、加聚反应。 (四)、芳香烃: (1)通式C n H2n-6(n≥6) (2)主要化学性质: ①、跟卤素单质、硝酸、硫酸发生取代反应。 ②、跟氢气加成。 ③、苯的同系物的侧链能被酸性高锰酸钾溶液氧化,但苯不能。 (五)、卤代烃: (1)通式:R-X,官能团-X。 (2)主要化学性质: ①、在强碱性溶液中发生水解反应。(NaOH+H2O并加热) ②、在强酸性溶液中发生消去反应(但没有β碳原子和β碳原子上没能氢原子的卤代烃
高考化学复习热点专题
高考化学复习热点专题 离子共存题是高考中重现率较高的题,尽管每年的考题在形式上常有所改变,但考查内容却相同。本文结合近年高考试题,对离子共存题常见题型进行归纳分析,供读者参考。 一、常见题型 1.“无色透明”条件型 若题目限定溶液“无色”,则不含有色离子,即Fe2+(浅绿色)、Fe3+(棕黄色)、Cu2+(蓝色)、MnO4-(紫色)等离子。若“透明”,则溶液不形成混浊或沉淀(与溶液有无颜色无关)。如Ag+与Cl-、Br-、I-、SO42-;Ca2+与CO32-、SO32-;Ba2+与CO32-、SO32-、SO42-等在水溶液中会发生反应,有混浊或明显的沉淀生成,它们不能大量共存。 例1.某无色透明的溶液中,下列各组离子能大量共存的是( ) A.H+、Cl-、Ba2+、CO32- B.Ag+、I-、K+、NO3- C.K+、OH-、Cl-、Na+ D.Fe3+、Cl-、NO3-、Na+ 解析: 正确选项应满足无色透明、能大量共存两个条件。答案为C项。 2.“酸性”条件型 常见的叙述有酸性溶液、PH=1的溶液、能使PH试纸变红的溶液、紫色石蕊试液呈红色的溶液、甲基橙呈红色的溶液、加入镁粉能放出氢气的溶液、c(OH-)=1×10-14mol·L-1的溶液等。 若题目中限定溶液呈酸性,则溶液中有H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、S2-、F-、ClO-、CH3COO-、C6H5O-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)。例2.(2005年全国高考理综试题?河南等省卷)在pH=1的溶液中,可以大量共存的离子是( ) A.K+、Na+、SO42-、S2O32- B.NH4+、Mg2+、SO42-、Cl- C.Na+、K+、HCO3-、Cl- D.K+、Na+、AlO2-、NO3- 解析: 正确选项应满足pH=1(有H+存在)、可以大量共存两个条件。答案为B项。3.“碱性”条件型 常见的叙述有碱性溶液、PH=14的溶液、能使PH试纸变蓝的溶液、红色石蕊试纸变蓝的溶液、酚酞呈粉红色的溶液、甲基橙呈黄色的溶液、加入铝粉反应后生成AlO2-的溶液、c(H+)=1×10-14 mol·L-1的溶液、既能溶解AI(OH)3又能溶解H2SiO3的溶液等。 若题目中限定溶液呈碱性,则溶液中有OH-存在,其中不能大量含有H+、弱碱的阳离子(如NH4+、Mg2+、Ag+、Al3+、Zn2+、Cu2+、Fe2+、Fe3+ 等)以及弱酸的酸式根离子。 例3.(2005年江苏高考化学试题)某溶液既能溶解AI(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是() A.K+、Na+、HCO3-、NO3- B.Na+、SO42-、Cl-、ClO- C.H+、Mg2+、SO42-、NO3- D.Ag+、K+、NO3-、Na+ 解析: 正确选项应满足溶液既能溶解AI(OH)3又能溶解H2SiO3 (有OH-存在)、可以大量共存两个条件,只有B项符合题意。
2020届高考化学大题题型专项训练
高考大题题型专项训练(三) 化学实验综合探究题 1.凯氏定氮法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:NH3+H3BO3===NH3·H3BO3;NH3·H3BO3+HCl===NH4Cl+H3BO3。 回答下列问题: (1)a的作用是________。 (2)b中放入少量碎瓷片的目的是__________。f的名称是__________。 (3)清洗仪器:g中加蒸馏水;打开K1,关闭K2、K3,加热b,蒸气充满管路;停止加热,关闭K1,g中蒸馏水倒吸进入c,原因是________;打开K2放掉水。重复操作2~3次。 (4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d 注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭K3,d中保留少量水。打开K1,加热b,使水蒸气进入e。 ①d中保留少量水的目的是_____________________。 ②e中主要反应的离子方程式为_________________________, e采用中空双层玻璃瓶的作用是______________________。 (5)取某甘氨酸(C2H5NO2)样品m克进行测定,滴定g中吸收液时消耗浓度为c mol·L-1的盐酸V mL,则样品中氮的质量分数为________%,样品的纯度≤________%。 解析:(1)加热水蒸气时,若关闭K1,b中压强增大,a可起安全管的作用,防止烧瓶内压强过大,造成事故。 (2)碎瓷片可防止蒸馏水在加热时暴沸;f是直形冷凝管。
标准溶液 比均为:1) 计算(1- 解析:(1) 硫酸铝水解出的氢离子反应,
高考化学专题复习:物质的组成和分类
高考化学专题复习:物质的组成和分类 考点聚焦 1.掌握分子、原子、离子、原子团、元素等概念。 2.掌握混合物、纯净物、单质、化合物、金属、非金属的概念3.掌握氧化物、酸、碱、盐概念及相互关系。 4.了解同位素和同素异形体。 知识梳理 一、原子、分子、离子、元素、同位素、同素异形体的概念 1.原子是。 思考:为什么说原子是化学变化中的最小微粒?能否理解为原子是构成物质的最小微粒? 2.分子是。 思考:是否可理解为分子是保持物质性质的微粒? 3.离子是。 4.元素是。 元素存在形式。 思考:质子数相同的微粒一定是同一种元素吗? 5.比较元素和原子的区别 6.同位素是。 7.同素异形体是。 8.比较同位素、同素异形体的区别 二、物质的分类
1.将物质分为纯净物与混合物,是依据所含物质种类是不是一种来 区分的。 2.将纯净物分为单质和化合物,是依据组成纯净物的元素是不是一 种来区分的。要重点理解单质和化合物两个概念。 3.将化合物分为有机物与无机物,是依据组成元素中是否含碳元素 来区分的。一般把含碳元素的化合物称为有机物(CO、CO2、H2CO3及碳酸盐除外),将不含碳元素的化合物叫做无机物。 4.将无机物分为氧化物、酸、碱和盐四类,其依据是物质组成和性 质上的不同。 氧化物是指由___________种元素组成,且其中一种为 __________元素的化合物(注意氧化物与含氧化合物的区别和联系)。将氧化物分为酸性氧化物、碱性氧化物、两性氧化物、不成 盐氧化物,是依据氧化物跟酸或碱反应的情况来区分的。 酸性氧化物碱性氧化物两性氧化物 概念 性质 思考:酸性氧化物与非金属氧化物的关系,碱性氧化物与金属氧化物的关系。 酸可以从两个不同的角度进行分类:一是依据酸分子电离生成的 H+个数分为一元酸、二元酸、三元酸等;二是依据酸的组成元素中 是否含氧元素分为含氧酸和无氧酸。
2021高考化学知识点专题汇编 (11)
课时跟踪检测(二十六)以气体制备为主体的实验探究1.(2017·全国卷Ⅰ)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是() A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度 C.结束反应时,先关闭活塞K,再停止加热 D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 解析:选B制得的氢气中含有H2S、O2、HCl、H2O等杂质,由于酸性高锰酸钾溶液氧化氯化氢生成氯气,所以,应先用焦性没食子酸溶液吸收氧气,同时除去氯化氢(易溶于水),再用酸性高锰酸钾溶液吸收硫化氢,最后用浓硫酸干燥,A项错误;氢气中混有空气加热易发生爆炸,故加热管式炉前需对氢气进行验纯,其操作为在④处收集气体点燃,发出“噗”声,则证明制取的氢气较纯,B项正确;类似氢气还原氧化铜,实验完毕后,先停止加热,再继续通入氢气一段时间,C项错误;启普发生器不能加热,适合块状固体与液体在常温下反应,而实验室用二氧化锰与浓盐酸反应制氯气需要加热,且二氧化锰是粉末状固体,故不能用装置Q制备氯气,D项错误。 2.气体的收集、验满、转移过程中容易发生泄漏,对环境造成一定程度的污染,有的还不能控制反应的开始和结束,没有处理尾气。下面有一套改进的实验装置,装置中无机试剂任选,下列说法正确的是() A.通过关闭分液漏斗Ⅰ、Ⅱ的旋塞,用双手捂住三颈烧瓶Ⅶ,看Ⅴ中导管口有没有气泡,松手后Ⅴ中导管中有没有倒吸形成一段稳定的水柱,可以检查装置的气密性B.如果Ⅶ中发生反应NH3+HCl===NH4Cl,去掉Ⅳ,同样可以在Ⅶ中看到大量白雾C.如果Ⅶ中发生反应的气体是氨气与氯气,现象可能是产生大量白雾,也可能是产生大量白烟 D.Ⅶ中的现象不可能为生成大量红棕色气体 解析:选C用双手捂住三颈烧瓶Ⅶ,由于手的温度低,不能看到相应的现象,A不正
2019年高三化学有机化学基础专题复习
高三化学有机化学基础专题复习【04】 2019-5 【概要】: ①2019年考试说明②有机物基础知识复习③《2019年考试说明》样题④近三年有机高考真题【必修】⑤有机实验*⑥有机合成路线【选修】 二.有机物基础知识复习 【第二部分】:各类物质结构性质与制备 1.主线: 2.组成结构 3.物理性质及用途 4.主要化学性质 5.制备 (1)乙酸乙酯(2)乙烯(3)其它如溴代苯,硝基苯等【略】 三.《2019年考试说明》能力培养及样题【必修4题】【选修4题略】 1.能力培养 A.卤代羧酸 B.酯类 C.氨基酸 D.醇钠【答案:C】 【2】【例7-2013年全国I-13】下列实验中,所采取的分离方法与对应原理都正确的是 【3】【例4-1994年全国I-35】
2.样题 【1】【例2-2016年全国I 】下列关于有机化合物的说法正确的是() A.2-甲基丁烷也称异丁烷 B.由乙烯生成乙醇属于加成反应 C.C4H9Cl有3种同分异构体 D.油脂和蛋白质都属于高分子化合物 【答案】B 四.近三年有机高考真题 1.【2018新课标1卷】下列说法错误的是 A.蔗糖、果糖和麦芽糖均为双糖 B.酶是一类具有高选择催化性能的蛋白质 C.植物油含不饱和脂肪酸酯,能使Br?/CCl4褪色 D.淀粉和纤维素水解的最终产物均为葡萄糖 2.【2018新课标1卷】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷是最简单的一种。下列关于该化合物的说法错误的是 A.与环戊烯互为同分异构体 B.二氯代物超过两种 C.所有碳原子均处同一平面 D.生成1 molC5H12至少需要2 molH2 3.【2018新课标3卷】苯乙烯是重要的化工原料。下列有关苯乙烯的说法错误的是 A.与液溴混合后加入铁粉可发生取代反应 B.能使酸性高锰酸钾溶液褪色 C.与氯化氢反应可以生成氯代苯乙烯 D.在催化剂存在下可以制得聚苯乙烯
2019届高三化学选择题专题—有机选择专题练习(最新整理)
有机化学基础(选择题)专题 1.下列关于有机物的叙述不正确的是 A.乙酸的分子模型可表示为 B.糖类、油脂、蛋白质都是高分子化合物 C.新制的氢氧化铜可以鉴别乙酸、葡萄糖和乙醇 D.丁酸和乙酸乙酯互为同分异构体 2.指甲花中存在的β-紫罗蓝酮属于一种萜类化合物,可作为合成维生素A 的原料。下列有关β-紫罗蓝 酮的说法正确的是 A.β-紫罗蓝酮的分子式为C10H14O B.分子中所有碳原子可能处于同一平面 C.与足量的H2反应后,分子中官能团的种类减少一种 D.和酸性KMnO4溶液、溴的四氯化碳溶液发生的反应类型相同 3.某有机物的结构简式见图,下列说法正确的是 A.不能发生消去反应 B.分子式为C14H15O6NBr C.不能使酸性高锰酸钾溶液褪色 D.在一定条件下与氢氧化钠溶液反应,1mol 该有机物最多消耗4 mol NaOH 4.某抗肿瘤药物中间体的合成路线如下。下列说法正确的是( ) A.吲哚的分子式为C8H6N B.苯甲醛中所有原子不可能全部共平面 C.可用新制氢氧化铜悬浊液区分苯甲醛和中间体 D.1mol 该中间体,最多可以与9mol 氢气发生加成反应 5.下列关于有机化合物的说法正确的是 A.分子式为C3H6Cl2的有机物有4 种同分异构体(不考虑立体异构) B.和互为同系物 C.乙炔和溴的四氯化碳溶液反应生成1,2-二溴乙烷 D.甲苯分子中所有原子都在同一平面上
6. 下列关于有机化合物的说法正确的是 A .丙烷的二氯取代物有 3 种 B . 和苯乙烯互为同系物 C .饱和(NH 4)2SO 4 溶液和福尔马林均可使蛋白质溶液产生沉淀,其原理相同 D .聚合物(—[ C H 2—CH 2—CH —CH 2—]n )可由单体 CH 3CH =CH 2 和 CH 2=CH 2 加聚制得 C |H 3 7. 已知互为同分异构体,下列说法不正确的是 A .盆烯可与酸性高锰酸钾溶液反应 B .苯与棱晶烷的一氯代物均只有一种 C .上述三种物质中,与甲苯互为同系物的只有苯 D .上述三种物质中,只有棱晶烷的所有原子不处于同一平面内 8. 增塑剂 DCHP 可由环己醇制得。环已醇和 DCHP 的结构简式如图所示,下列说法正确的是 A.DCHP 的分子式为 C 20H 14O 4 B 环已醇和 DCHP 的二氯代物均有 4 种 C.1molDCHP 水解时消耗 2mol NaOH D.环已醇分子中的所有碳原子可能共平面 9、某抗癌药物的结构简式如图所示,下列有关说祛正确的是 A.能发生取代、氧化、加聚反应 B.分子中所有原子可能共平面 C.与苯甲酸苯甲酯属同系物 D.水解生成酸的同分异构体中含有苯环且能发生银镜反应的有 3 种 10. 化合物 X 是一种药物合成的中间体,其结构简式如图所示。下列有关化合物 X 的说法正确的是 ( ) A. 化合物 X 的分子式为 C 16H 16O 6 HO HO B. 能发生加成反应、取代反应、消去反应 O C. 1mol 化合物 X 最多可与 5molNaOH 、7mol H 2、4molBr 2 发生反应 D. 可与 FeCl 3 溶液发生显色反应,但不能发生氧化反应 H 3C O O OH CH 3
高考电化学专题复习知识点总结完美版(20200915005156)
一、原电池的工作原理 装置特点:化学能转化为电能。 ①、两个活泼性不同的电极; 形成条件:②、电解质溶液(一般与活泼性强的电极发生氧化还原反应); 原③、形成闭合回路(或在溶液中接触) 电④、建立在自发进行的氧化还原反应基础之上 池负极:用还原性较强的物质作负极,负极向外电路提供电子;发生氧化反应。原基本概念:正极:用氧化性较强的物质正极,正极从外电路得到电子,发生还原反应。理电极反应方程式:电极反应、总反应。 氧化反应负极铜锌原电池正极还原反应 反应原理 Zn-2e - =Zn2+ 2H ++2e- =2H↑ 溶 电解质溶液 二、常见的电池种类 电极反应:负极(锌筒)Zn-2e-=Zn2+ 正极(石墨) 2NH4++2e- =2NH3+H2↑ ①普通锌——锰干电池总反应:Zn+2NH4+=Zn2++2NH3+H2↑
干电池: 电解质溶液:糊状的 NH 4Cl 特点:电量小,放电过程易发生气涨和溶液 ② 碱性锌——锰干电池 电极反应: 负极(锌筒) Zn-2e -- 2 +2OH=Zn(OH) 正极(石墨) 2e - +2H 2 O +2MnO= 2OH-+2MnOOH ( 氢氧化氧锰 ) 总反应: 2 H 2O +Zn+2MnO= Zn(OH) 2+2MnOOH 电极:负极由锌改锌粉(反应面积增大,放电电流增加) ;使用寿命提高 电解液:由中性变为碱性(离子导电性好) 。 正极( PbO 2) PbO 2+SO 42- +4H ++2e - =PbSO 4+2HO 负极( Pb ) Pb+SO 4 2- -2e - =PbSO 4 铅蓄电池 总反应: PbO+Pb+2HSO 2PbSO 4 +2HO 2 4 电解液: 1.25g/cm 3~1.28g/cm 3 的 H 2SO 4 溶液 蓄电池 特点:电压稳定 , 废弃电池污染环境 Ⅰ、镍——镉( Ni —— Cd )可充电电池; 其它 负极材料: Cd ;正极材料:涂有 NiO ,电解质: KOH 溶液 2 NiO +Cd+2HO 放电 + Cd(OH) 2 Ni(OH) 2 2
有机化学复习专题(专题一)
专题X 有机化学 第一讲有机化学基本概念 【知识要点】 1.掌握有机物的结构特点及其结构与性质的关系;了解有机物与无机物的特点。 2.了解有机物化合物数目众多和同分异构现象普遍存在的本质原因。理解同分异构、同系物等概念,能够辨认同分异构体、同系物,能够书写、补写同分异构体及同分异构体种类。 3.掌握基本有机分子的空间构型,并能由此发散,应用到分析其它有机分子的空间构型。 【知识要点讲解】 一、有机物和无机物 1:定义:有机物:通常把含碳的化合物叫有机物。但CO、CO2、碳酸盐等除外 无机物:通常把不含碳的化合物叫无机物。但CO、CO2、碳酸盐等除外 2:有机化学:把研究有机物的化学叫有机化学 二、有机物的特点 1:元素组成特点:核心元素为碳,另外还有H、O、S、P等 2:结构特点: ①由于碳的最外层有4个价电子,所以碳常以四根共价键形成共价化合物。 ②有机物中,碳与碳之间以共价键形成碳链,这是有机物的基础。 ③有机物分子间通过分子间作用力形成分子晶体*。 3:数量特点:数量多,有机物目前发现上千万种,而无机物只有十万种。主要由于碳链的长度不同,而且有的有支链、双键、叁键。 4:性质特点: ①多数难溶于水,易溶于酒精、汽油、苯等有机溶剂。相似相溶原理。 ②多数为非电解质。不易导电。 ③多数熔沸点较低(分子晶体)。 ④多数易燃、易分解。 5:有机反应的特点:速度慢,副反应多。 三、有机物的分类体系 对各类有机物都要通过其重要代表物进行学习的。现将中学课本中各类有机物中主要代表物的组成和结构列于下表中:
有机物的主要类别的分子组成通式和分子结构特点(包括所含有的官能团)。 烃和烃的衍生物是中学有机化学的重点内容,现将其各类有机物的组成和结构特点列于下表中。
高考化学专题训练
考点专练1 物质的量 两年高考真题演练 1.(2015·课标全国Ⅰ,8)N A 为阿伏加德罗常数的值。下列说法正确的是( ) A .18 g D 2O 和18 g H 2O 中含有的质子数均为10N A B .2 L mol ·L -1 亚硫酸溶液中含有的H + 离子数为2N A C .过氧化钠与水反应时,生成 mol 氧气转移的电子数为 D .密闭容器中2 mol NO 与1 mol O 2充分反应,产物的分子数为2N A 2.(2015·课标全国Ⅱ,10)N A 代表阿伏加德罗常数的值。下列叙述正确的是( ) A .60 g 丙醇中存在的共价键总数为10N A B .1 L ·L -1 的NaHCO 3溶液中HCO -3和CO 2- 3的离子数之和为 | C .钠在空气中燃烧可生成多种氧化物,23 g 钠充分燃烧时转移电子数为1N A D .235 g 核素235 92U 发生裂变反应:235 92U +10n ――→裂变90 38Sr +136 54Xe +1010n ,净产生的中子(10n)数为10N A 3.(2015·四川理综,5)设N A 为阿伏加德罗常数的值,下列说法正确的是( ) A . g H 182O 与D 2O 的混合物中所含中子数为N A B .常温常压下, g 乙醛所含σ键数目为 C .标准状况下, L CO 2与足量Na 2O 2反应转移的电子数为 D .50 mL 12 mol/L 盐酸与足量MnO 2共热,转移的电子数为 4.(2015·广东理综,10)设n A 为阿伏加德罗常数的数值,下列说法正确的是( ) A .23 g Na 与足量H 2O 反应完全后可生成n A 个H 2分子 B .1 mol Cu 和足量热浓硫酸反应可生成n A 个SO 3分子 、 C .标准状况下, LN 2和H 2混合气中含n A 个原子 D .3 mol 单质Fe 完全转变为Fe 3O 4,失去8n A 个电子
高考化学知识点总结
高考化学复习总专题高考化学考试重点总结(考试重点模式) 一、俗名 无机部分: 纯碱、苏打、天然碱、口碱:Na2CO3 小苏打:NaHCO3 石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 碳铵:NH4HCO3 石灰石、大理石:CaCO3 生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2 芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FeSO4·7H2O 干冰:CO2 明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物) 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2 皓矾:ZnSO4·7H2O 硅石、石英:SiO2 水玻璃、泡花碱、矿物胶:Na2SiO3 铁红、铁矿:Fe2O3 磁铁矿:Fe3O4 黄铁矿、硫铁矿:FeS2 菱铁矿:FeCO3 赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2 天然气、沼气、坑气(主要成分):CH4 水煤气:CO和H2 硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体 王水:浓HNO3与浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。 尿素:CO(NH2) 2 有机部分:
氯仿:CHCl3 电石气:C2H2 (乙炔) 酒精、乙醇:C2H5OH 氟氯烃:是良好的制冷剂,有毒,但破坏O3层。 醋酸:冰醋酸、食醋CH3COOH 裂解气成分(石油裂化):烯烃、烷烃、炔烃、H2S、CO2、CO等。 甘油、丙三醇:C3H8O3 焦炉气成分(煤干馏):H2、CH4、乙烯、CO等。 石炭酸:苯酚 蚁醛:甲醛HCHO 福尔马林:35%—40%的甲醛水溶液 蚁酸:甲酸HCOOH 葡萄糖:C6H12O6 果糖:C6H12O6 蔗糖:C12H22O11 麦芽糖:C12H22O11 淀粉:(C6H10O5)n 硬脂酸:C17H35COOH 油酸:C17H33COOH 软脂酸:C15H31COOH 草酸:乙二酸HOOC—COOH 使蓝墨水褪色,强酸性,受热分解成CO2和水,使KMnO4酸性溶液褪色。 二、颜色 铁:铁粉是黑色的;一整块的固体铁是银白色的。Fe2+——浅绿色Fe3O4——黑色晶体Fe(OH)2——白色沉淀Fe3+——黄色Fe (OH)3——红褐色沉淀Fe (SCN)3——血红色溶液 FeO——黑色的粉末Fe2O3——红棕色粉末FeS——黑色固体 铜:单质是紫红色Cu2+——蓝色CuO——黑色Cu2O——红色CuSO4(无水)—白色CuSO4·5H2O——蓝色Cu(OH)2——蓝色 BaSO4、BaCO3、Ag2CO3、CaCO3、AgCl 、Mg (OH)2、三溴苯酚均是白色沉淀Al(OH)3白色絮状沉淀H4SiO4(原硅酸)白色胶状沉淀 Cl2、氯水——黄绿色F2——淡黄绿色气体Br2——深红棕色液体I2——紫黑色固体HF、HCl、HBr、HI均为无色气体,在空气中均形成白雾 CCl4——无色的液体,密度大于水,与水不互溶KMnO4--——紫色MnO4-——紫色 Na2O2—淡黄色固体Ag3PO4—黄色沉淀S—黄色固体AgBr—浅黄色沉淀 AgI—黄色沉淀O3—淡蓝色气体SO2—无色,有剌激性气味、有毒的气体 SO3—无色固体(沸点44.8 0C)品红溶液——红色氢氟酸:HF——腐蚀玻璃 N2O4、NO——无色气体NO2——红棕色气体NH3——无色、有剌激性气味气体 三、现象: 1、铝片与盐酸反应是放热的,Ba(OH)2与NH4Cl反应是吸热的; 2、Na与H2O(放有酚酞)反应,熔化、浮于水面、转动、有气体放出;(熔、浮、游、嘶、
- 高考化学复习专题:常见气体的制备与收集
- 高考化学专题复习.
- 最新高考化学专题复习试题及答案
- 高考化学专题复习——常见气体的制备学案
- 2018年高考化学专题复习突破《四大平衡常数》知识点总结
- 高考化学专题复习——化学反应速率
- 高考化学专题复习:化学与技术(
- 高考化学专题复习——有机化学
- 高考电化学专题-复习精华版
- 高考化学专题复习——化学计算
- 2022年江苏省高考化学专题复习:推断题
- 高考化学专题复习——有机学案
- 高考化学专题复习:化学与生活1
- 高考化学专题复习:选修模块复习题(
- 【专用试卷】高考化学复习高考化学专题复习题--化学原理题(复习必备)
- 高考化学专题复习——有机合成
- 高考化学专题复习训练题
- 高考化学专题复习:物质的组成和分类
- 高考化学专题复习——非金属元素
- 高考化学基本概念专题复习
