关于体外溶出中手动溶出仪和自动溶对比分析

关于体外溶出中手动溶出仪和
自动溶出仪对比分析
经过长得半年体外溶出试验,分析出手动溶出仪和自动溶出仪之间区别,证明自动溶出仪在体外溶出和处方工艺等方面优势。
我们以苯磺酸氨氯地平片的溶出曲线为研究对象,大连辉瑞和美国辉瑞及自制片对比溶出曲线,和手动溶出曲线的对比。
试验主要仪器:天大天发溶出仪(手动、自动)、安捷伦液相1260等。
溶出曲线测定方法:
苯磺酸氨氯地平片溶出曲线测定方法根据药物溶出曲线测定和相似性比较技术指导原则,主要参考日本橙皮书苯磺酸氨氯地平片溶出实验方法及液相色谱条件。
取本品12片,照溶出度测定法(中国药典2010年版二部附录X C 第二法),分别以四种溶剂900ml为溶出介质,转速为每分钟50转,依法操作,经5、10、15、30、45、60、90、120、180、240、300、360分钟时,取溶出液10ml,补溶出介质,精密量取5ml,置10ml量瓶中,加流动相稀释至刻度,摇匀,0.45μm 滤膜过滤,弃去初滤液5ml,续滤液作为供试品溶液。另精密称苯磺酸氨氯地平对照品19mg,置50ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,加溶出介质稀释至刻度,摇匀,再精密量取5ml,置10ml 量瓶中,加流动相稀释至刻度,摇匀,作为对照品溶液。另精密量取上述两种溶液各25μl,注入液相色谱仪,记录色谱图;按外标法以峰面积计算每片溶出量(结果乘以0.721,将苯磺酸氨氯地平换算成氨氯地平)。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂,以0.7%(v/v)三乙胺溶液(用磷酸调pH值至3.0)-甲醇-乙腈(50:30:20)为流动相,检测波长为238nm,柱温为35℃,调整流速使苯磺酸氨氯地平峰保留时间约为7.0分钟,理论板数按苯磺酸氨氯地平峰计算不低于3000,拖尾因子应不大于2.0。
四种溶出介质的配制方法:①水:实验用水(测PH值)。② pH 1.2盐酸溶液:取盐酸7.65ml,加水稀释至1000ml,摇匀,即得。③ pH 4.0磷酸盐缓冲液:取醋酸钠1.22g,与2mol/L醋酸溶液(取120.0g(114ml)冰醋酸用
水稀释至1000ml,即得)20.5ml,加水稀释至1000ml,即得。④ pH 6.8磷酸盐缓冲液: 取0.2mol/L磷酸二氢钾溶液(取27.22g磷酸二氢钾,用水溶解并稀释至1000ml)250ml,与0.2mol/L氢氧化钠溶液(取8.00g氢氧化钠,用水溶解并稀释至1000ml)112ml混合后,加水稀释至1000ml,即得。
注:色谱条件的选择、辅料干扰性试验、回收率试验、稳定性试验、线性范围不在本文中列出。
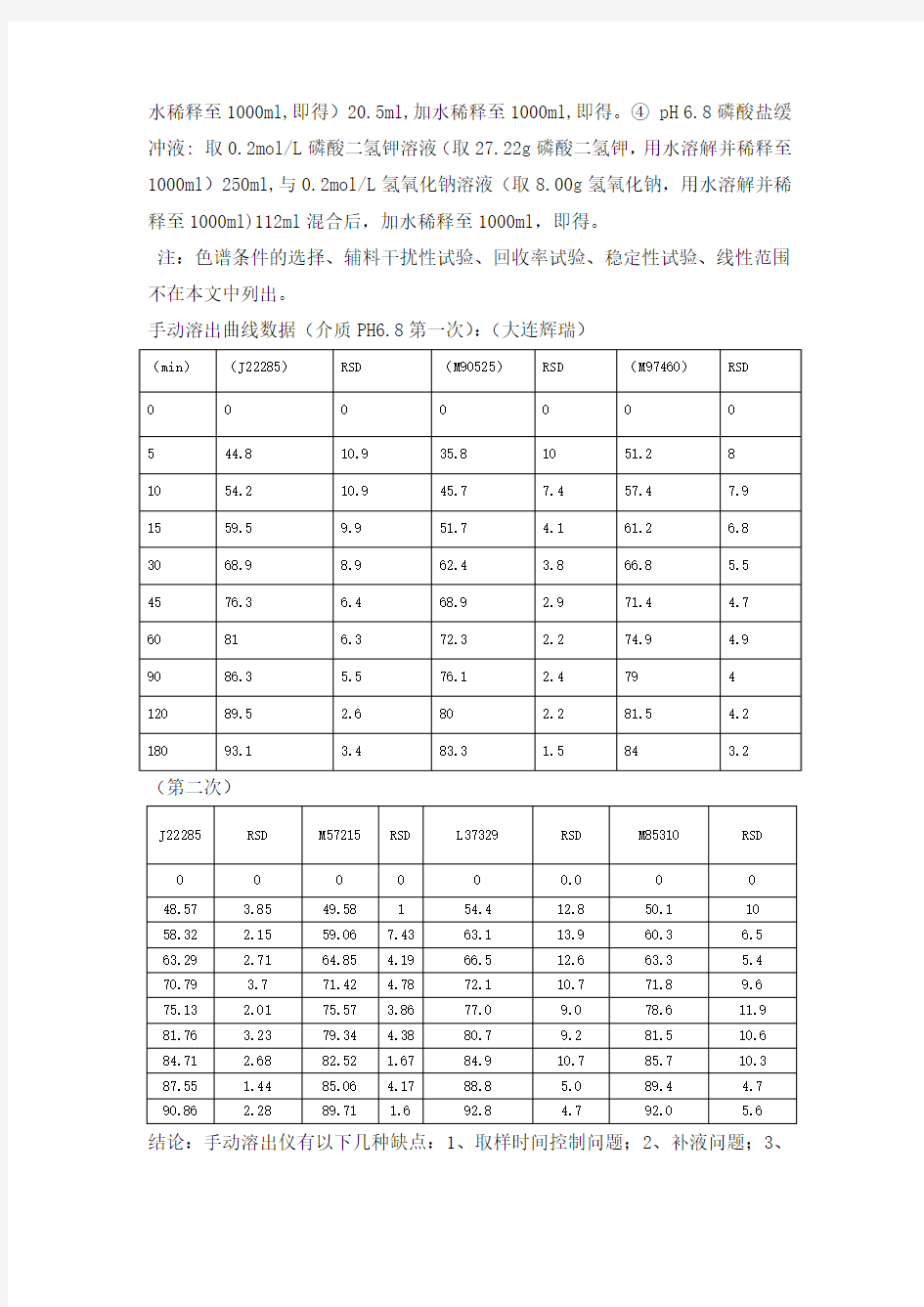
手动溶出曲线数据(介质PH6.8第一次):(大连辉瑞)
(第二次)
结论:手动溶出仪有以下几种缺点:1、取样时间控制问题;2、补液问题;3、
取样注射器问题;多批次差异较大;
自动溶出仪(介质PH6.8第一次)大连辉瑞N85310
大连辉瑞N11204
是溶出仪0.45滤膜吸附造成的。
结论:证明大连辉瑞比美国辉瑞产品在介质PH6.8中偏高。
美国进口和大连辉瑞对比(介质水)
综合结论:(因我个人时间关系许多数据未列出)1、手动做溶出曲线时许多条件的制约,多批次数据重现不好,同时无法有效评估出参比制剂的溶出曲线情况,会带来后面的处方工艺研究错误和原、辅料的选择问题;2、自动溶出仪使用时需要时间经验的结累和合理的应用及手、自动相互验证,和产品条件对应和溶出方法改进;3、进口参比制剂一定要确认来源和产地;4、因一致评价工作开展的原因,目前国内才重视体外溶出曲线,溶出仪选择是关键;5、不要犯我单位的错误,就是认为溶出曲线没什么技术含量,结果延后了项目进度大半年;(我单位刚开始也是选择手动溶出仪)
关于体外溶出中手动溶出仪和自动溶对比分析
关于体外溶出中手动溶出仪和 自动溶出仪对比分析 经过长得半年体外溶出试验,分析出手动溶出仪和自动溶出仪之间区别,证明自动溶出仪在体外溶出和处方工艺等方面优势。 我们以苯磺酸氨氯地平片的溶出曲线为研究对象,大连辉瑞和美国辉瑞及自制片对比溶出曲线,和手动溶出曲线的对比。 试验主要仪器:天大天发溶出仪(手动、自动)、安捷伦液相1260等。 溶出曲线测定方法: 苯磺酸氨氯地平片溶出曲线测定方法根据药物溶出曲线测定和相似性比较技术指导原则,主要参考日本橙皮书苯磺酸氨氯地平片溶出实验方法及液相色谱条件。 取本品12片,照溶出度测定法(中国药典2010年版二部附录X C 第二法),分别以四种溶剂900ml为溶出介质,转速为每分钟50转,依法操作,经5、10、15、30、45、60、90、120、180、240、300、360分钟时,取溶出液10ml,补溶出介质,精密量取5ml,置10ml量瓶中,加流动相稀释至刻度,摇匀,0.45μm 滤膜过滤,弃去初滤液5ml,续滤液作为供试品溶液。另精密称苯磺酸氨氯地平对照品19mg,置50ml量瓶中,加甲醇溶解并稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,加溶出介质稀释至刻度,摇匀,再精密量取5ml,置10ml 量瓶中,加流动相稀释至刻度,摇匀,作为对照品溶液。另精密量取上述两种溶液各25μl,注入液相色谱仪,记录色谱图;按外标法以峰面积计算每片溶出量(结果乘以0.721,将苯磺酸氨氯地平换算成氨氯地平)。 色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂,以0.7%(v/v)三乙胺溶液(用磷酸调pH值至3.0)-甲醇-乙腈(50:30:20)为流动相,检测波长为238nm,柱温为35℃,调整流速使苯磺酸氨氯地平峰保留时间约为7.0分钟,理论板数按苯磺酸氨氯地平峰计算不低于3000,拖尾因子应不大于2.0。 四种溶出介质的配制方法:①水:实验用水(测PH值)。② pH 1.2盐酸溶液:取盐酸7.65ml,加水稀释至1000ml,摇匀,即得。③ pH 4.0磷酸盐缓冲液:取醋酸钠1.22g,与2mol/L醋酸溶液(取120.0g(114ml)冰醋酸用
RC806D溶出仪说明书V1307-2
目录 1.仪器概述 (1) 2.性能指标 (3) 3.安装步骤 (4) 3.1开箱验收 (4) 3.2安置主机 (4) 3.3安装水浴箱 (4) 3.4安装溶出杯 (4) 3.5安装转杆 (6) 3.6安装打印机 (8) 3.7仪器试运行 (8) 4.使用方法 (9) 4.1操作界面 (9) 4.2基本试验 (9) 4.3程控参数 (11) 4.4程控试验 (12) 4.5定时关机 (14) 4.6自动预热 (15) 4.7仪器设置 (16) 5.溶出试验 (18) 5.1试验开始 (18) 5.2取样方法 (18) 5.3试验结束 (19) 5.4定时功能设置 (20) 5.5小杯法试验 (20) 5.6断电保护 (20) 6.维护保养 (21) 6.1注意事项 (21) 6.2故障处理 (21)
1.仪器概述 药物溶出试验仪(简称溶出仪)是专门用于检测口服固体制剂(如片剂、胶囊、颗粒剂等)溶出度的药物试验仪器。它能模拟人体的胃肠环境及消化运动过程,是一种控制药物制剂质量的体外试验装置,广泛应用于药物的研究、生产与检验。 RC806D溶出试验仪是按照中国药典和美国药典以及溶出仪物理性能验证的要求而设计的新型药物溶出试验仪。该仪器采用四柱支撑结构形式,双排八杯八杆,机头电动升降,其设计造型合理紧凑,美观大方,机械性能稳固;它还采用了多项新材料、新器件和新技术,其功能更强大、操作更简便、性能更稳定可靠。其主要特点有: ●可装配8个185mm高度新溶出杯、8个搅拌桨或转篮。 ●机头电动升降,自动化程度高。 ●转杆与溶出杯自动对中心定位,无须人工调整。 ●搅拌桨、篮杆和转篮及溶出杯架板均为优质不锈钢材料制造,耐腐蚀性能好。 ●水浴箱与循环管路的连接采用快速接嘴及专用排水口,便于水浴箱拆卸清洗。 ●配有最新设计的双层密封杯盖,可有效地防止溶出介质蒸发。 ●采用新型温度传感器温漂小,可靠性高,循环水浴升温快且稳定性好。 ●采用新型驱动电机转速高、噪音小,转杆最高稳定转速可达250转/分钟。 ●采用新型液晶显示屏,中文或英文菜单式显示,人机界面友好,使用更简便。 ●机头升降、转杆转动、启动计时各自用按键独立操作,符合药典要求。 ●“程控试验”功能可执行10组预置的取样程序,适于常规重复性试验。 ●“基本试验”功能可在试验过程中随时改变试验参数,便于研究性试验。 ●“定时关机”功能可在无人值守情况下自动终止溶出试验运行。 ●“自动预热”功能可在无人值守情况下定时开始预热水浴,节省人力和时间。 ●液晶屏显示的恒温水浴温度值若产生偏差,用户可自行校准。 ●仪器有内置时钟,液晶屏显示的日期、时间如有偏差,用户可自行校正。 ●用户预置的程序及试验参数自动存储于机内,下次开机无需重复设置。 ●具有断电保护功能:试验中若临时断电不超过5分钟,试验仍能继续运行。 ●仪器具有超低温报警(<3℃)、超高温报警(>47℃)及二次过热保护功能。 ●可选用小杯法配件在本仪器上进行中国药典溶出度测定法第三法试验。 ●可选配微型打印机打印试验过程中的时间、温度和转速等实时试验数据。 RC806D溶出试验仪主要由下部的机座、水浴箱、杯架板、溶出杯和上部的机头、
FDA-溶出度指导原则
Q8 Pharmaceutical Development U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) May 2006 ICH
Q8 Pharmaceutical Development Additional copies are available from: Office of Training and Communication Division of Drug Information, HFD-240 Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane Rockville, MD 20857 (Tel) 301-827-4573 https://www.wendangku.net/doc/1015778259.html,/cder/guidance/index.htm Office of Communication, Training and Manufacturers Assistance, HFM-40 Center for Biologics Evaluation and Research Food and Drug Administration 1401 Rockville Pike, Rockville, MD 20852-1448 https://www.wendangku.net/doc/1015778259.html,/cber/guidelines.htm. U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) May 2006 ICH
(整理)RC806D溶出实验仪使用说明书.
1.仪器概述 药物溶出试验仪(简称溶出仪)是专门用于检测口服固体制剂(如片剂、胶囊、颗粒剂等)溶出度的药物试验仪器。它能模拟人体的胃肠环境及消化运动过程,是一种控制药物制剂的体外试验装置,广泛应用于药物的研究、生产与检验。 RC806溶出试验仪是按照中国药典和美国药典的要求而设计的新型药物溶出试验仪。该仪器采用四柱支撑结构形式,双排八杯八杆,机头电动升降,其设计造型合理紧凑,美观大方,机械性能稳固;它还采用了多项新材料、新器件和新技术,其功能更强大、操作更简便、性能更稳定可靠。其主要特点有: ●可装配8个185mm高度新溶出杯、8个搅拌桨或转篮。 ●机头电动升降,自动化程度高。 ●转杆与溶出杯自动对中心定位,无须人工调整。 ●搅拌桨、篮杆和转篮及学名出杯架板均为优质不锈钢材料制造,耐腐蚀 性能好。 ●水浴箱与循环管路的连接采用快速接嘴及专用排水口,便于水浴箱拆卸 清洗。 ●配有最新设计的双层密封杯盖,可有效地防止溶出介质蒸发。 ●采用新型温度传感器温漂小,可靠性高,循环水浴升温快且稳定性好。 ●采用新型驱动电机转速高、噪音小,转杆最高稳定转速可达250转/分 钟。 ●采用新型液晶显示屏,中文或英文菜单式显示,人机界面友好,使用更 简便。 ●机头升降、转杆转动、启动计时各自用按键独立操作,符合药典要求。 ●“程控试验”功能可执行10组预置的取样程序,适于常规重复性试验。 ●“基本试验”功能可在试验过程中随时改变试验参数,便于研究性试验。 ●“定时关机”功能可在无人值守的情况下自动终止溶出试验进行。 ●“自动预热”功能可在无人值守情况下定时开始预热水浴,节省人力 和时间。 ●液晶屏显示的恒温水浴温度值若产生偏差,用户可自行校准。 ●仪器有内置时钟,液晶屏显示的日期。时间如有偏差,用户可自行校正。 ●用户预置的程序及试验参数自动存储于,下次开机无需重复设置。 ●具有断电保护功能:试验中若临时断电不超过5分钟,试验仍能继续运 行。 ●仪器具有超低温报警(<3℃)、超高温报警(>47℃)及二次过热保护功 能。 ●可选用小杯法配件在本仪器上进行中国药典溶出度测定法第三法试验。 ●可选配微型打印机打印试验过程中的时间、温度和转速等实时试验数 据。 ●可选配微型打印机打印试验过程中的时间、温度和转速等实时试验数 据。 RC806溶出试验仪主要由下部的机座、水浴箱、杯架板、溶出杯和上部的机头、转杆等各部分组成。 2.性能指标 RC806溶出试验仪的技术指标和安全性能完全符合2010版《中华人民共和
溶出度指导原则
附件1 普通口服固体制剂溶出度试验 技术指导原则 一、前言 本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。 本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。附录对溶出度试验的方法学、仪器和操作条件进行了概述。 二、背景 固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用: 1.评价药品批间质量的一致性; 2.指导新制剂的研发;
3.在药品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。 在药品批准过程中确定溶出度标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后药品质量的一致性。 对于新药申请,应提供关键临床试验和/或生物利用度试验用样品以及其他人体试验用样品的体外溶出度数据。对于仿制药申请,应在溶出曲线研究的基础上制定溶出度标准。无论是新药还是仿制药申请,均应根据可接受的临床试验用样品、生物利用度和/或生物等效性试验用样品的溶出度结果,制定溶出度标准。 三、生物药剂学分类系统 根据药物的溶解性和渗透性,推荐以下生物药剂学分类系统(BCS)(Amidon 1995): 1类:高溶解性–高渗透性药物 2类:低溶解性–高渗透性药物 3类:高溶解性–低渗透性药物 4类:低溶解性–低渗透性药物 上述分类原则可作为制定体外溶出度质量标准的依据,也可用于预测能否建立良好的体内-体外相关性(IVIVC)。在37±1℃下,测定最高剂量单位的药物在250mL pH值介于1.0和8.0之间的溶出介质中的浓度,当药物的最高剂量除以以上介质中的药物浓度小于或等于250mL时,可认为是高溶解性药物。一般情
药物溶出仪验证指导原则
药物溶出仪验证指导原则 一、概述 进一步推进仿制药与原研药品质量和疗效一致性评价工作的开展,根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)要求,制定本指导原则。 在仿制药质量和疗效一致性评价研究工作中,为保证体外溶出试验数据的准确性和重现性,所使用的溶出仪应能够通过本指导原则的各项机械验证技术指标,还应按《中国药典》的要求采用溶出度标准片(如水杨酸片)对仪器进行性能验证试验,均需符合规定。 本指导原则适用于仿制药质量和疗效一致性评价体外溶出试验中,《中国药典》2015年版通则0931溶出度与释放度测定法第一法(篮法)和第二法(桨法)所用溶出仪的机械验证。 二、机械验证的测量工具 溶出仪的机械验证,应将待测部件置于正常溶出试验位置,由相关技术人员使用适宜的测量工具测量各项机械参数。 可采用单一测量工具(如倾角仪、同轴度测量工具、摆度表、深度表、转速计和温度计等),也可采用模块化集成测量工具。
不论哪种测量工具,均应在检定合格周期内使用,并能够进行量值溯源。 三、机械验证的周期 溶出仪在安装、移动或维修后都应对其进行机械验证。除另有规定外,通常每六个月对溶出仪进行一次机械验证。如果在试验过程中发现异常现象,应立即对溶出仪进行机械验证。若溶出仪不常使用,可适当延长验证周期,一般不超过12个月。 四、机械验证前的检查 溶出仪的仪器装置除应符合现版《中国药典》2015年版通则0931溶出度与释放度测定法第一法(篮法)和第二法(桨法)的要求,还应目视检查以下部件: (一)溶出杯。杯体光滑,无凹陷或凸起,无划痕、裂痕、残渣等缺陷。 (二)转篮。篮体无锈蚀,无网眼堵塞或网线伸出,无网眼或篮体变形等现象。 (三)篮(桨)轴。篮(桨)轴上无锈蚀现象,桨面涂层(Teflon 或其他涂层)光滑、无脱落。 五、机械验证的流程 使用适宜的测量设备,按以下步骤对溶出仪进行机械验证。 (一)溶出仪的水平度 在溶出杯的水平面板上从两个垂直方向上测量,倾斜度均不
普通口服固体制剂溶出曲线测定与比较指导原则
附件2 普通口服固体制剂溶出曲线测定与比较 指导原则 本指导原则适用于仿制药质量一致性评价中普通口服固体制剂溶出曲线测定方法的建立和溶出曲线相似性的比较。 一、背景 固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透等,因此,药物的体内溶出和溶解对吸收具有重要影响。 体外溶出试验常用于指导药物制剂的研发、评价制剂批内批间质量的一致性、评价药品处方工艺变更前后质量和疗效的一致性等。 普通口服固体制剂,可采用比较仿制制剂与参比制剂体外多条溶出曲线相似性的方法,评价仿制制剂的质量。溶出曲线的相似并不意味着两者一定具有生物等效,但该法可降低两者出现临床疗效差异的风险。 二、溶出试验方法的建立 溶出试验方法应能客观反映制剂特点、具有适当的灵敏度和区分力。可参考有关文献,了解药物的溶解性、渗透性、pKa常
数等理化性质,考察溶出装置、介质、搅拌速率和取样间隔期等试验条件,确定适宜的试验方法。 (一)溶出仪 溶出仪需满足相关的技术要求,应能够通过机械验证及性能验证试验。必要时,可对溶出仪进行适当改装,但需充分评价其必要性和可行性。 溶出试验推荐使用桨法、篮法,一般桨法选择50—75转/分钟,篮法选择50—100转/分钟。在溶出试验方法建立的过程中,转速的选择推荐由低到高。若转速超出上述规定应提供充分说明。 (二)溶出介质 溶出介质的研究应根据药物的性质,充分考虑药物在体内的环境,选择多种溶出介质进行,必要时可考虑加入适量表面活性剂、酶等添加物。 1.介质的选择 应考察药物在不同pH值溶出介质中的溶解度,推荐绘制药物的pH-溶解度曲线。 在确定药物主成分稳定性满足测定方法要求的前提下,推荐选择不少于3种pH值的溶出介质进行溶出曲线考察,如选择pH值1.2、4.5和6.8的溶出介质。对于溶解度受pH值影响大
sotax溶出仪 收集器操作规程
操作手册 SOTAX C613/C615收集器 仪器数据 ?序列号: ___________________ ?工作电压: ___________________ ?功耗: ___________________ ?运抵日期: ___________________ 技术数据 ?试管数量:比如13或29×7,每个15毫升,比如16×7,每个65毫升?功耗:25伏安 ?三通阀压缩空气:至少5Bar 规格 ? C613 宽,深,高:480,355,205mm 重量:大约13.5千克 ? C615 宽,深,高:780,325,480mm 重量:大约18.5千克
目录 1. 信息 (3) 1.1 阅读 (3) 1.2 操作手册中用到的一些符号 (3) 2. 开始 (3) 1.1 运输(标准附件) (3) 1.2 开箱检查 (3) 1.3 C631/C615基本信息 (3) 1.4 安全指导 (4) 3. 安装 (4) 1.5 温度 (4) 1.6 湿度 (4) 1.7 环境 (4) 1.8 光照 (4) 1.9 空间要求 (5) 1.10 振动 (5) 4. 产品描述 (5) 1.11 C613 (5) 1.12 C615 (5) 1.13 模块图(适用于C613和C615) (5) 1.14 管路连接图 (7) 1.15 电源供应和保险丝 (7) 1.16 线路图 (8) 5. 使用 (8) 1.17 如何使用 (9) 1.18 准备取样 (9)
1. 信息 1.1 阅读 开始运行设备之前务必先阅读操作手册。 在运行设备时务必注意手册中提示的可能发生的危险情况。保证操作手册能随时取阅,其中有安全调整并且优化测试仪器的重要信息。 1.2 操作手册中用到的一些符号 危险: 该符号提示很有可能造成人身伤害。 警告: 该符号提示如果不注意这些则有可能对仪器造成损害。 重要: 该符号提示有关操作的重要的信息,不注意这些则有可能产生错误。 2. 开始 1.1 运输(标准附件) ?覆膜(编号B300-0100) 此处未标明的其他附件在随主机一起运输的运输单上列出。 1.2 开箱检查 小心打开每个部件的包装并保证包装材料完好,以留作备用。检查货物在运输过程中是否有损坏。拆包后认真检查仪器内外是否有损坏。如有损坏立即向经销商或者Sotax或者代表处,并更换外壳。将仪器放置稳定的平台上。 1.3 C631/C615基本信息 SOTAX C613/C615可以使用不同的试管架。C615比C613长30厘米,主要用于特殊场合,比如使用流通池法发布新药试验需要使用较大的试管(65毫升)。标准试管架如下所示:
溶出度
溶出度总结 一、溶出度方法的确立 1、溶出方法的选择 (1)篮法(B)/浆法(P),不提首选浆法或蓝法 非崩解型药物(B) 崩解型药物制剂中含有难以溶解、扩散的成分(P) 主药或辅料为一定胶性物质(P) 悬浮的制剂(B),如辅料易堵塞网孔(P,使用沉降篮) (2)小杯法:≥500ml浓度过低,较灵敏的方法仍难以进行定量测定(不能使用沉降篮,测定不能再稀释测定)。 2、溶出介质的选择 (1)水:不提以水为主(pH 值无法控制,在试验过程中易发生改变,适合非pH 依赖释药)(2)人工胃液(0.01~0.1mol/L盐酸溶液, 必要时可加胃蛋白酶)(3)人工肠液(必要时可加胰蛋白酶) (4)其他缓冲液(pH值一般不超过7.6)三羟甲基氨基甲烷(Tris):缓冲范围pH7.0~9.5,低离子强度(二氟尼柳胶囊) (5)其他: 低浓度表面活性剂; 醇溶液(一般<5%)人体生理pH值在胃内为1~3.5,小肠内约为7,结肠内约为7.5 (6)表面活性剂----尽量避免使用,种类和浓度需通过多个试验来验证。?FDA 溶出度指导原则:对于难溶性药物不提倡使用有机溶剂,推荐SDS,但必须证明表面活性剂的选择和用量的合理性。即应考察表面活性剂对药物的增溶量,以确定最少且最佳的使用浓度。 采用阳离子表面活性剂/非离子表面活性剂。十二烷基硫酸钠(Sodium laurylsulfate SLS或SDS) —纯度;pH≦2.5聚山梨酯(吐温)20-80 (Tween20-80 ) —茴三硫片/吉非替尼片/盐酸雷洛昔芬片等溴化十六烷基三甲胺—粘度大月桂基二甲基氧化铵—替代SDS 用于胶囊剂(可以与酶配伍) 3、溶出介质体积的选择 使药物符合漏槽条件小规格品种一般不提倡将2粒/片投入1个溶出杯中来满足测定的灵敏度需要。常用:大杯法:500 ~1000ml ,900ml为最普遍小杯
溶出仪机械校正文件
附件 药物溶出度仪机械验证指导原则 本指导原则适用于仿制药质量和疗效一致性评价研究工作中,口服固体制剂体外溶出试验所用溶出度仪的机械验证。 一、概述 本指导原则中的溶出度仪是指《中华人民共和国药典》(2015年版,以下简称《中国药典》)四部通则〈0931〉溶出度与释放度测定法中第一法和第二法的仪器装置。为保证体外溶出试验数据的准确性和重现性,所使用的溶出度仪应满足《中国药典》要求,同时还需满足本指导原则规定的各项技术要求。 二、验证前检查 目视检查以下部件: (一)溶出杯 杯体光滑,无凹陷或凸起,无划痕、裂痕、残渣等缺陷。 (二)篮 篮体无锈蚀,无网眼堵塞或网线伸出,无网眼或篮体变形等现象。 (三)篮(桨)轴 篮(桨)轴无锈蚀,桨面涂层(Teflon或其他涂层)光滑、
无脱落。(特氟隆涂层(Teflon Coating)特氟隆(Teflon)可是一个大名鼎鼎的商标名,碳氢树脂的总称) 三、测量工具 可采用单一测量工具(如倾角仪、百分表、转速表和温度计等),也可采用模块化的集成测量工具。各种测量工具均应符合相关的计量要求。 (倾角仪测量系统主要是用来测定固定或者转动的物体的倾斜度,物体斜转或转动时,传感器把检测到的角度转换为电信号,传输到控制、显示单元,最终提供一个倾斜的绝对值) (百分表的圆盘上印有100个等分刻度,每一分度值相当于量杆移动0.01mm,工作原理:是将被测尺寸引起的测杆微小直线移动,经过齿轮传动放大,变为指针在刻盘上的转动) 四、技术要求
对溶出度仪进行机械验证时,应将待测部件置于正常试验位置,按以下方法进行验证 (一)溶出度仪水平度(现在通过倾角仪来测定) 在溶出杯的水平面板上从两个垂直方向上测量?,两次测量的数值均不得超出0.5°。
溶出指导原则201211
普通口服固体制剂溶出度试验 技术指导原则 (初稿) 药品审评中心 2012年10月
目录 一、前言 (1) 二、背景 (1) 三、生物药剂学分类系统 (2) 四、溶出度质量标准的建立 (2) (一)新化合物制剂溶出度质量标准的建立 (3) (二)仿制药品溶出度质量标准的建立 (4) (三)特例 (5) (四)绘图或效应面优化法 (5) (五)体内-体外相关性 (5) (六)质量标准的验证和确认 (6) 五、溶出曲线的比较 (6) (一)非模型依赖法 (6) 1. 非模型依赖的相似因子法 (6) 2. 非模型依赖的多变量置信区间法 (7) (二)模型依赖法 (8) 六、普通口服固体制剂上市后变更的溶出度研究 (8) 七、体内生物等效性试验的豁免 (9) 附录
普通口服固体制剂溶出度试验技术指导原则 一、前言 本指导原则适用于普通口服固体制剂,包括以下内容:(1)溶出度试验的一般要求;(2)根据生物药剂学特性建立溶出度质量标准的方法;(3)溶出曲线比较的统计学方法;(4)体内生物等效性试验豁免(即采用体外溶出度试验代替体内生物等效性试验)的一般考虑。 本指导原则还针对药品的处方工艺在批准后发生变更时,如何通过溶出度试验确认药品质量和疗效的一致性提出了建议。附录对溶出度试验的方法学、仪器和操作条件进行了概述。 二、背景 固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透。由于药物的溶出和溶解对吸收具有重要影响,因此,体外溶出度试验有可能预测其体内行为。基于上述考虑,建立普通口服固体制剂(如片剂和胶囊)体外溶出度试验方法,有下列作用: (1)评价制剂批间质量的一致性; (2)指导新制剂的研发; (3)在产品发生某些变更后(如处方、生产工艺、生产场所变更和生产工艺放大),确认药品质量和疗效的一致性。 在药品批准过程中确定溶出度质量标准时,应考虑到药物的溶解性、渗透性、溶出行为及药代动力学特性等因素,以保证药品批间质量的一致性、变更以及工艺放大前后产品质量的一致性。 对于新药申请,应提供关键临床研究和/或生物利用度研究用样品以及其他人体研究用样品的体外溶出度数据。对于仿制药申请,应在溶出曲线研究的基础上制定溶出度质量标准。无论是新药还是仿制药申请,均应根据可接受的临床研究用样品、生物利用度和/或生物等效性研究用样品的溶出度结果,制定溶出度质量标准。
Distek symphony 7100药物溶出仪介绍
Symphony 7100 无水浴溶出系统可能是迄今为止最为先进的溶出仪产品,她将众多创新性的设计引入到了药物溶出仪器,它一经推出即技压群芳,举世瞩目! 基于Distek 最早面世的专利无水浴加热技术, 第三代无水浴系统不仅有更快的溶媒加热速率,还能在系统上同时运行三种溶出度测试方法,每个溶出单元都是独立的模块化设计 。非水浴型药物溶出仪 SYMPHONY 7100?专利无水浴技术 免去了水浴加热组件的同时也省去了水浴系统相应的繁 杂维护工作,更可将室温下900mL 的溶媒在15分钟内快速加 热37℃。 ?转轴内置温度传感器 转轴内置式温度探头符合溶出试验的流体动力学要 求,也能对溶媒温度进行持续的实时监控。 ?同时运行多种测试方法 最多可同时运行三种不同的试验方法,节约了研发时 间,提高了工作效率 ?独立的模块化设计 可配置至多8个杯位,模块化的溶出单元设计,能 简单、灵活地对溶出单元进行扩展。 ?彩色触屏显示 直观的图形交互界面犹如平板电脑,只需简单的培训就 能上手。轻触彩色图标即能完成对溶出仪的各种操控。 ?转速实时监控 基于获得专利的D-Drive技术, symphony 7100 可以三种 速度升降转轴,也可以实时监控每个杯位的搅拌速度。 ?半圆形外形设计 symphony 7100新颖的半圆形外形设计更便于取样及更 换溶出杯。 https://www.wendangku.net/doc/1015778259.html,
888.2.DISTEK https://www.wendangku.net/doc/1015778259.html, ? info@https://www.wendangku.net/doc/1015778259.html, 121 North Center Drive North Brunswick, NJ 08902 SEG 12/19/14
实时溶出度测定法
实时溶出度测定法 实时溶出度测定即指直接在药物溶出液中实时、连续、定量地监测药物的溶出过程,从而得到完整的药物溶出度曲线,以评价药品的内在质量。与目前常用的单点溶出度测定相比,这种实时测定方法能更加全面准确地反映药物的溶出性能和内在质量,特别是能反映出产品之间的质量差异,对于考察药物体外释药情况,控制药品内在质量是一种更加有效的手段。 随着药物溶出度检查方法的发展,为满足溶出度检查的要求,对溶出度测定仪的设计要求也越来越高。尤其是80年代以来,随着计算机技术,传感器技术和其它高新技术的发展,溶出度检查技术有了更大的飞跃,药物溶出度检测仪器也向自动化方向发展,能够实现药物溶出过程的实时在线监测。 目前能进行原位、实时、自动化检测的溶出度检测仪器有美国Hanson公司的Fiber Optic Dissolution System、西德Pharma-Test 公司的IDS-1000 In-Situ Dissolution Test System和国产的FODT-601光纤药物溶出度实时测定仪。其中光纤原位药物溶出度试验改变了传统的溶出度测定方法,将药物溶出仪和光谱分析仪结为一体,探头浸入溶出杯中,光源发出的光通过光纤照射到探头,然后经探头反射,将液体的光谱信号通过光纤输入检测系统并由计算机对数据进行处理,实现药物溶出过程的原位、实时监测。下面主要介绍国产实时溶出度测定仪对药物溶出度的实时监测。 1、FODT-601仪器的应用特点 光纤药物溶出度实时监测试验是集光导纤维浸入式探头、光导纤维传输系统、CCD检测、计算机软件处理数据一体化的自动溶出度测定方法。FODT-601光纤药物溶出度实时测定仪的应用特点: (1)光纤传感原位在线检测、可变光程,勿需取样、过滤、稀释; (2)6通道CCD全光谱数据采集,可得到即时UV/VIS光谱; (3)触摸屏智能工作站,自动输出溶出曲线和回归方程。 2、FODT-601仪器检测原理 根据Lamber-Beer定律A=ECL(A:吸光度,E:吸光系数,C:溶液浓度,L:光通过厚度),可知单色光通过吸光介质后,吸光度A与浓度或厚度之间是简单地正比关系。E称为吸光系数,在给定单色光、溶剂和温度等条件下,吸光系数是物质的特征常数,表明物质对某一特定波长的吸收能力。因此,只要选择一定
溶出度指导原则精选版
溶出度指导原则 Document serial number【KKGB-LBS98YT-BS8CB-BSUT-BST108】
普通口服固体制剂溶出曲线?测定与比较指导原则 (2015-11-09 16:15:30) 分类: 普通口服固体制剂溶出曲线测定与比较指导原则 一、概述 为进一步推进仿制药与原研药品质量和疗效一致性评价工作的开展,根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)要求,制定本指导原则。 本指导原则适用于仿制药质量一致性评价中普通口服固体制剂溶出曲线测定方法的建立和溶出曲线相似性的比较。 二、背景 固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透等,因此,药物的体内溶出和溶解对吸收具有重要影响。 体外溶出试验常用于指导药物制剂的研发、评价制剂批内批间质量的一致性、评价药品处方工艺变更前后质量和疗效的一致性等。
普通口服固体制剂,可采用比较仿制制剂与参比制剂体外多条溶出曲线相似性的方法,评价仿制制剂的质量。溶出曲线的相似并不意味着两者一定具有生物等效,但该法可降低两者出现临 床疗效差异的风险。 三、溶出试验方法的建立 溶出试验方法应能客观反映制剂特点、具有适当的灵敏度和区分力。可参考有关文献,了解药物的溶解性、渗透性、pKa常数等理化性质,考察溶出装置、介质、搅拌速率和取样间隔期等试验条件,确定适宜的试验方法。 (一)溶出仪 溶出仪需满足相关的技术要求,应能够通过机械验证及性能验证试验。必要时,可对溶出仪进行适当改装,但需充分评价其必要性和可行性。 溶出试验推荐使用桨法、篮法,一般桨法选择50~75转/分钟,篮法选择50~100转/分钟。在溶出试验方法建立的过程中,转速的选择推荐由低到高。若转速超出上述规定应提供充分说明。 (二)溶出介质
仿制药生物等效性试验指导原则(日本)
药食审发第1124004号文 2006年11月24日尊敬的各省市县医药卫生主管部门领导 厚生劳动省医药品食品卫生管理局管理科科长签发有关仿制药生物等效性试验等指导原则的一系列制订与修订事宜 在药品申报时、对于所应交付的仿制药生物等效性试验资料要求,曾在1997年12月22日医药审发第487号文“仿制药生物等效性试验指导原则”、2000年2月14日医药审发第64号文“含量规格不同的口服固体制剂生物等效性试验指导原则”、2000年2月14日医药审发第67号文“口服固体制剂更改处方后生物等效性试验指导原则”、2001年5月31日医药审发第786号文“仿制药生物等效性试验等一系列指导原则的修订事宜(即增补版)”及2003年7月7日药食审发第0707001号文“局部皮肤用药的仿制药生物等效性试验指导原则”等一系列文件中公布出来。此次对以上各指导原则再次进行了修订,详见附件-1、2、3和4。其中所附事项,请各相关单位敬请留意并遵照执行。 序 1.此次变更的指导原则 (1) 仿制药生物等效性试验指导原则 (2) 含量规格不同的口服固体制剂生物等效性试验指导原则 (3) 口服固体制剂更改处方后生物等效性试验指导原则 (4) 局部皮肤用药的仿制药生物等效性试验指导原则 2.以上各指导原则的执行时间 自2006年11月24日起执行。但原指导原则仍可并行使用至2007年11月24日。
附件-1 《仿制药生物等效性试验指导原则》 目录 第1章序言 第2章专业用语 第3章试验部分 A.口服普通制剂与肠溶制剂 I. 参比制剂与仿制制剂 II. 生物等效性试验 1.试验方法 1)试验计划 2)试验例数 3)受试者 4)给药条件 a. 给药量 b. 给药方法 ①单次给药 ②多次给药 5)测定 a. 体液采集 b. 采集次数与时间 c. 检测组分 d.分析方法 6)停止给药时间 2.评价方法 1)等效性评价指标 2)生物学同等性判定范围 3)统计学分析 4)同等性判定 III. 药力学试验
药物溶出仪验证指导原则
药物溶出仪验证指导原则 一、概述进一步推进仿制药与原研药品质量和疗效一致性评价工作的开展,根据《国务院关于号)要求,制定本指导原则。44(国发〔2015〕改革药品医疗器械审评审批制度的意见》在仿制药质量和疗效一致性评价研究工作中,为保证体外溶出试验数据的准确性和重现性,所使用的溶出仪应能够通过本指导原则的各项机械验证技术指标,还应按《中国药典》的要求采用溶出度标准片(如水杨酸片)对仪器进行性能验证试验,均需符合规定。本指导原则适用于仿制药质量和疗效一致性评价体外溶出试验中,《中国药典》2015年版通则0931溶出度与释放度测定法第一法(篮法)和第二法(桨法)所用溶出仪的机械验证。二、机械验证的测量工具溶出仪的机械验证,应将待测部件置于正常溶出试验位置,由相关技术人员使用适宜的测量工具测量各项机械参数。可采用单一测量工具(如倾角仪、同轴度测量工具、摆度表、深度表、转速计和温度计等),也可采用模块化集成测量工具。不论哪种测量工具,均应在检定合格周期内使用,并能够进行量值溯源。三、机械验证的周期溶出仪在安装、移动或维修后都应对其进行机械验证。除另有规定外,通常每六个月对溶出仪进行一次机械验证。如果在试验过程中发现异常现象,应立即对溶出仪进行机械个月。验证。若溶出仪不常使用,可适当延长验证周期,一般不超过12四、机械验证前的检查溶出仪的仪器装置除应符合现版《中国药典》2015年版通则0931溶出度与释放度测定法第一法(篮法)和第二法(桨法)的要求,还应目视检查以下部件:(一)溶出杯。杯体光滑,无凹陷或凸起,无划痕、裂痕、残渣等缺陷。. (二)转篮。篮体无锈蚀,无网眼堵塞或网线伸出,无网眼或篮体变形等现象。(三)篮(桨)轴。篮(桨)轴上无锈蚀现象,桨面涂层(Teflon或其他涂层)光滑、无脱落。五、机械验证的流程使用适宜的测量设备,按以下步骤对溶出仪进行机械验证。(一)溶出仪的水平度0.5°。在溶出杯的水平面板上从两个垂直方向上测量,倾斜度均不得超过(二)篮(桨)轴垂直度紧贴篮(桨)轴测量垂直度,再沿篮(桨)轴旋转90°测量,每根篮(桨)轴两次测0.5°。量数值均不得超过(三)溶出杯的垂直度沿溶出杯内壁(避免触及溶出杯底部圆弧部分)测量垂直度,再沿内壁旋转90°测量, 1.0°。每个溶出杯两次测量数值均不得超过(四)溶出杯与篮(桨)轴的同轴度。60mm2mm,另一个测量点位于篮上方距篮上缘篮法:一个测量点位于篮上方距篮上缘桨法:一个测量点位于桨叶上方距桨叶上缘2mm,另一个测量点位于桨叶上方距桨叶。80mm上缘。在上述两个测量点,每个溶出杯轴心与篮(桨)轴轴心的偏差均不得超过1.0mm通过了垂直度与同轴度验证的篮轴、桨和溶出杯均应编号,在溶出杯上缘与固定装置相连的位置上做好标记。在进行溶出度试验时,应将各篮轴、桨和溶出杯放在原已通过验证的位置上,保持各溶出杯与固定装置的相对位置不变。为满足同轴度要求,在调整了溶出杯的位置后应重新验证其垂直度。. (五)篮(桨)轴的摆动在篮(桨叶)上方20mm处测量。篮(桨)轴以每分钟50转旋转时,连续测量15秒钟,。每根篮(桨)轴的摆动不得超过1.0mm(六)篮的摆动在篮下缘处测量。篮轴以每分钟50转旋转时,连续测量15秒钟,每个
药物溶出度仪机械验证指导原则2016年
2016年78号 附件 药物溶出度仪机械验证指导原则 本指导原则适用于仿制药质量和疗效一致性评价研究工作中,口服固体制剂体外溶出试验所用溶出度仪的机械验证。 一、概述 本指导原则中的溶出度仪是指《中华人民共和国药典》(2015年版,以下简称《中国药典》)四部通则〈0931〉溶出度与释放度测定法中第一法和第二法的仪器装置。为保证体外溶出试验数据的准确性和重现性,所使用的溶出度仪应满足《中国药典》要求,同时还需满足本指导原则规定的各项技术要求。 二、验证前检查 目视检查以下部件: (一)溶出杯 杯体光滑,无凹陷或凸起,无划痕、裂痕、残渣等缺陷。 (二)篮 篮体无锈蚀,无网眼堵塞或网线伸出,无网眼或篮体变形等现象。 (三)篮(桨)轴
篮(桨)轴无锈蚀,桨面涂层(Teflon或其他涂层)光滑、无脱落。 三、测量工具 可采用单一测量工具(如倾角仪、百分表、转速表和温度计等),也可采用模块化的集成测量工具。各种测量工具均应符合相关的计量要求。 四、技术要求 对溶出度仪进行机械验证时,应将待测部件置于正常试验位置,按以下方法进行验证。 (一)溶出度仪水平度 在溶出杯的水平面板上从两个垂直方向上测量,两次测量的数值均不得超出0.5°。 (二)篮(桨)轴垂直度 紧贴篮(桨)轴测量垂直度,再沿篮(桨)轴旋转90°测量,每根篮(桨)轴两次测量的数值均不得超出90.0°±0.5°。 (三)溶出杯垂直度 沿溶出杯内壁(避免触及溶出杯底部圆弧部分)测量垂直度,再沿内壁旋转90°测量,每个溶出杯两次测量的数值均不得超出90.0°±1.0°。 (四)溶出杯与篮(桨)轴同轴度 可通过在溶出杯圆柱体内的篮(桨)轴上下各取一个点,以篮(桨)轴为中心旋转一周,测量篮(桨)轴与溶出杯内壁距离
溶出度指导原则
溶出度指导原则 Document number:PBGCG-0857-BTDO-0089-PTT1998
普通口服固体制剂溶出曲线测定与比较指导原则 (2015-11-09 16:15:30) 分类: 普通口服固体制剂溶出曲线测定与比较指导原则 一、概述 为进一步推进仿制药与原研药品质量和疗效一致性评价工作的开展,根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)要求,制定本指导原则。 本指导原则适用于仿制药质量一致性评价中普通口服固体制剂溶出曲线测定方法的建立和溶出曲线相似性的比较。 二、背景 固体制剂口服给药后,药物的吸收取决于药物从制剂中的溶出或释放、药物在生理条件下的溶解以及在胃肠道的渗透等,因此,药物的体内溶出和溶解对吸收具有重要影响。 体外溶出试验常用于指导药物制剂的研发、评价制剂批内批间质量的一致性、评价药品处方工艺变更前后质量和疗效的一致性等。
普通口服固体制剂,可采用比较仿制制剂与参比制剂体外多条溶出曲线相似性的方法,评价仿制制剂的质量。溶出曲线的相似并不意味着两者一定具有生物等效,但该法可降低两者出现临 床疗效差异的风险。 三、溶出试验方法的建立 溶出试验方法应能客观反映制剂特点、具有适当的灵敏度和区分力。可参考有关文献,了解药物的溶解性、渗透性、pKa常数等理化性质,考察溶出装置、介质、搅拌速率和取样间隔期等试验条件,确定适宜的试验方法。 (一)溶出仪 溶出仪需满足相关的技术要求,应能够通过机械验证及性能验证试验。必要时,可对溶出仪进行适当改装,但需充分评价其必要性和可行性。 溶出试验推荐使用桨法、篮法,一般桨法选择50~75转/分钟,篮法选择50~100转/分钟。在溶出试验方法建立的过程中,转速的选择推荐由低到高。若转速超出上述规定应提供充分说明。 (二)溶出介质
FODT-601 光纤药物溶出度实时测定仪操作规程
1仪器及配置 FODT-601 光纤药物溶出度实时测定仪主要由FODT-601RC 溶出仪和 FODT-601FX 分析仪两部分组成. 2 操作方法 2.1接通电源 2.1.1按电源开关以接通电源。此时,仪器控制面板指示红灯亮2.1.2 再按加热组件上的电源开关。此时,该开关上的电源指示灯应亮,同时水泵应运转。 2.1.2 按下仪器开关,只是绿灯亮,仪器开始启动。 2.2 对照品测定 2.2.1点击主界面下的“标准品/对照品测定”进入标准品/对照品测定模式, 2.2.2点击界面下的“检品信息”,选择检品的名称和规格,并进行药品的相关参数设定。 按上升按钮,使机头上升至适当位置,再按上升按钮机头停止。由下往上装入转杆。 2.2.3根据药品参数的提示,选择合适的探头,并安装在探测端。 按[下降]键,使机头下降,自动停止在基准位置。此时下压转杆使各桨叶或转篮底部与溶出杯底部恰好接触,在转杆顶部套上离合器,逆时针旋紧。 2.2.4 点击界面下的“初始化”,并在弹出的窗口中打开仪器的加热开关和光源开关。30min后,初始化完成。
2.2.5配置溶出介质并脱气,将溶出介质按规定体积倒入溶出杯中, 2.2.6 点击界面下的下降按钮,待下降停止后,用弯头滴管除去探头侧窗间隙的气泡。完成后点击界面下的扫描空白按钮.待扫描完成后,点击确定。 2.2.7 将对照品试验架固定于水槽上方,连接控制线缆。将配置好的对照品溶液和磁力转子置于烧杯中。再将烧杯放置于对照品试验架的指定位置。.点击界面下的下降按钮, 待下降停止后,用弯头滴管除去探头侧窗间隙的气泡。完成后点击界面下的开始按钮。 2.2.8 点击吸收光谱按钮,显示吸收光谱;点击实时吸光度按钮,则显示当前的吸光度值。 2.2.9 点击线性方程按钮,进入线性方程界面。在该界面下,点击浓度输入,输入对照品溶液的相对百分浓度后,点击确定按钮。在点击单点法按钮后,生成标准曲线,点击数据保存按钮即可。 2.3样品测试 2.3.1 点击上升,再点击退出按钮,回到主界面下。点击溶出度测定按钮,进入样品测定界面下。 2.3.2 用盛有水的烧杯和弯头滴管清洗探头,然后滤纸轻轻的吸去探头侧窗的水,即完成对探头的清洗。 2.3.3.1 若为第一法,将药品装入干燥转篮,固定于转轴上.用溶出介质润洗探头并注满探头侧窗间隙。点击下降按钮,待转篮底部接触溶出介质液面,点击开始按钮,开始测定溶出度。 2.3.3.2 若为第二法,点击下降按钮,待下降完成后,用弯头滴管除去探头侧窗间隙中的气泡。投入药品(若有必要,胶囊需置于沉降篮中),点击开始按钮,开始测定溶出度。 2.3.4 点击吸收光谱按钮,显示吸收光谱;点击实时吸光度按钮,则显示当前的吸光度值。 2.3.5 检测完成后,点击停止按钮以停止检测。点击数据保存按钮以完
- 药物溶出仪使用方法
- 药物溶出仪验证指导原则
- RC806D溶出实验仪使用说明书(参考Word)
- FODT-601光纤药物溶出度实时测定仪操作规程
- 药物溶出仪机械验证指导原则
- Distek symphony 7100药物溶出仪
- ZRS-8G 智能药物溶出仪标准操作规程
- (整理)RC806D溶出实验仪使用说明书.
- 药物溶出仪验证指导原则
- RC806D溶出实验仪使用说明书
- sotax溶出仪 收集器操作规程
- 药物溶出度仪机械验证指导原则2016年
- 药物溶出仪机械验证指导原则
- RC806D溶出仪说明书V1307-2
- Distek symphony 7100药物溶出仪介绍
- 最新药物溶出仪验证指导原则.pdf
- 药物溶出仪验证指导原则
- 药物溶出度仪机械验证指导原则
- 3-固体制剂溶出度方法开发及溶出仪校正要求
- SOTAX溶出仪使用说明书
