只用_mega5.0_做进化树步棸

只用mega 5.0做进化树
1. 打开mega 点击Align 选种Edit/Bulid Alignment
点击OK
如果是DNA序列就点击DNA 蛋白质则点击Protein,,出来下面界面,以DNA 为例
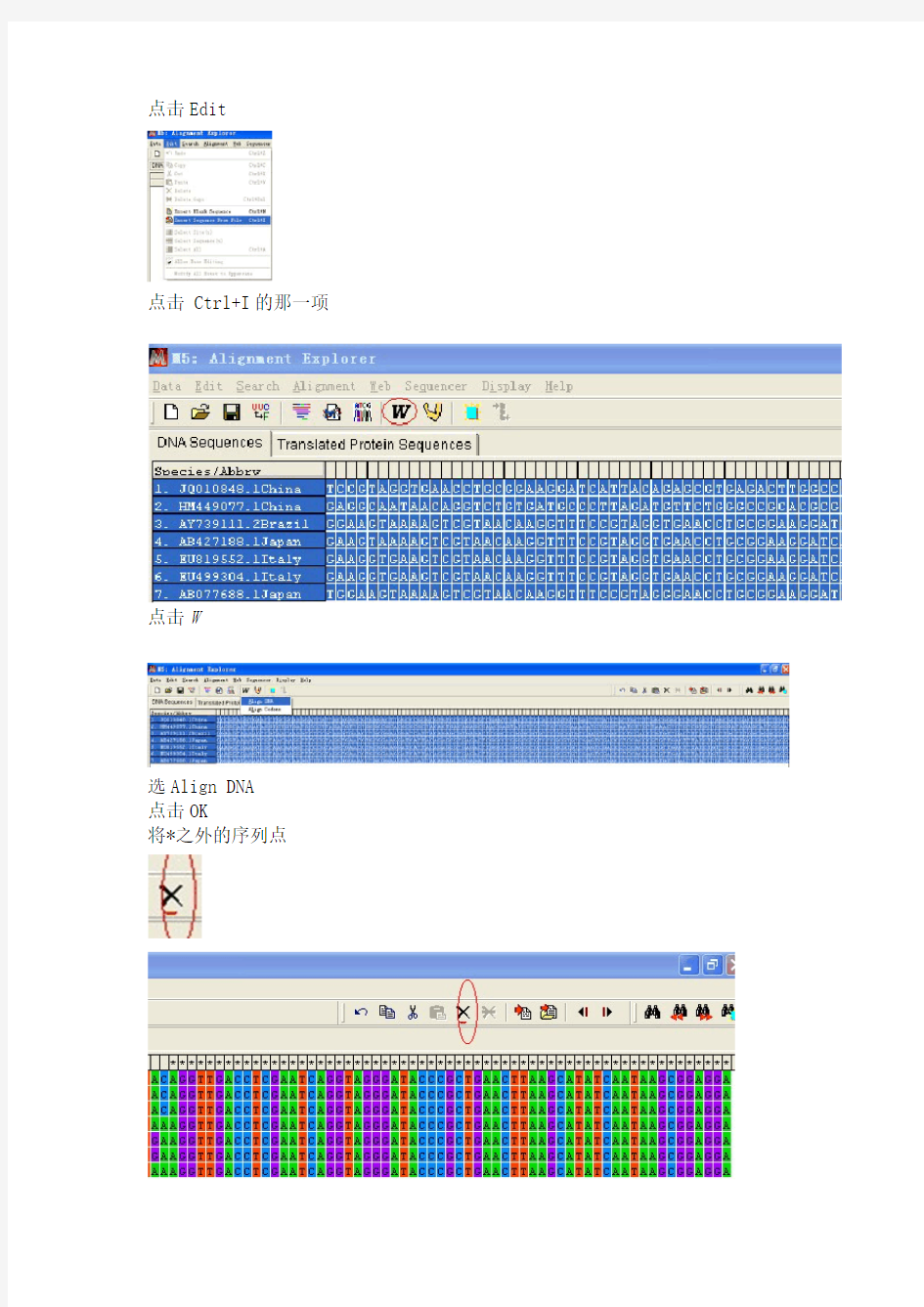
点击Edit
点击 Ctrl+I的那一项
点击W
选Align DNA
点击OK
将*之外的序列点
Date save session 随便命个名
保存的文件是
然后点击
选All file 选中刚才你命名的文件
修改一下蓝色图标(boot trap method)的值我修改的是100
这样进化树就做好了
如何做系统进化树
大家好: 我在此介绍几个进化树分析及其相关软件的使用和应用范围。这几个软件分别是PHYLIP、PUZZLE、PAUP、TREEVIEW、CLUSTALX和PHYLO-WIN (LINUX)。 在介绍软件之前,我先简要地叙述一下有关进化树分析的一些方法学问题。进化树也称种系树,英文名叫“Phyligenetic tree”。对于一个完整的进化树分析需要以下几个步骤:⑴要对所分析的多序列目标进行排列(To align sequences)。做ALIGNMENT的软件很多,最经常使用的有CLUSTALX和CLUSTALW,前者是在WINDOW下的而后者是在DOS下的。⑵要构建一个进化树(To reconstrut phyligenetic tree)。构建进化树的算法主要分为两类:独立元素法(discrete character methods)和距离依靠法(distance methods)。所谓独立元素法是指进化树的拓扑形状是由序列上的每个碱基/氨基酸的状态决定的(例如:一个序列上可能包含很多的酶切位点,而每个酶切位点的存在与否是由几个碱基的状态决定的,也就是说一个序列碱基的状态决定着它的酶切位点状态,当多个序列进行进化树分析时,进化树的拓扑形状也就由这些碱基的状态决定了)。而距离依靠法是指进化树的拓扑形状由两两序列的进化距离决定的。进化树枝条的长度代表着进化距离。独立元素法包括最大简约性法(Maximum Parsimony methods)和最大可能性法(Maximum Likelihood methods);距离依靠法包括除权配对法(UPGMAM)和邻位相连法(Neighbor-joining)。⑶对进化树进行评估。主要采用Bootstraping法。进化树的构建是一个统计学问题。我们所构建出来的进化树只是对真实的进化关系的评估或者模拟。如果我们采用了一个适当的方法,那么所构建的进化树就会接近真实的“进化树”。模拟的进化树需要一种数学方法来对其进行评估。不同的算法有不同的适用目标。一般来说,最大简约性法适用于符合以下条件的多序列:i 所要比较的序列的碱基差别小,ii 对于序列上的每一个碱基有近似相等的变异率,iii 没有过多的颠换/转换的倾向,iv 所检验的序列的碱基数目较多(大于几千个碱基);用最大可能性法分析序列则不需以上的诸多条件,但是此种方法计算极其耗时。如果分析的序列较多,有可能要花上几天的时间才能计算完毕。UPGMAM(Unweighted pair group method with arithmetic mean)假设在进化过程中所有核苷酸/氨基酸都有相同的变异率,也就
乳酸菌系统进化树
Lactobacillus.plantarum 204Lactobacillus.pentosus Lactobacillus.paraplantarum 575Lactobacillus.collinoides Lactobacillus.brevis Lactobacillus.farciminis Lactobacillus.alimentarius Lactobacillus.paralimentarius Lactobacillus.kimchii Lactobacillus.sanfranciscensis Lactobacillus.lindneri Lactobacillus.fructivorans Lactobacillus.hilgardii Lactobacillus.parakefiri Lactobacillus.buchneri Lactobacillus.parabuchneri Lactobacillus.kefiri Lactobacillus.kunkeei P.selangorensis Lactobacillus.perolens Lactobacillus.algidus Lactobacillus.mali Lactobacillus.nagelii Lactobacillus.murinus Lactobacillus.animalis Lactobacillus.ruminus Lactobacillus.equi Lactobacillus.agilis Lactobacillus.cypricasei Lactobacillus.acidipiscis Lactobacillus.salivarius Lactobacillus.salicinius Lactobacillus.aviarius Lactobacillus.araffinosus Lactobacillus.coryniformis Lactobacillus.bifermentans Lactobacillus.sakei Lactobacillus.curvatus Lactobacillus.sharpeae Lactobacillus.manihotivorans Lactobacillus.rhamnosus Lactobacillus.zeae Lactobacillus.casei Lactobacillus.panis Lactobacillus.frumenti Lactobacillus.oris Lactobacillus.vaginalis Lactobacillus.pontis Lactobacillus.reuteri Lactobacillus.colehominis Lactobacillus.mucosae Lactobacillus.fermentum Lactobacillus.amylophilus Lactobacillus.johnsonii Lactobacillus.gasseri Lactobacillus.iners Lactobacillus.jensenii Lactobacillus.fornicalis Lactobacillus.psittaci https://www.wendangku.net/doc/1816066652.html,ctis Lactobacillus.delbrueckii Lactobacillus.bulgaricus Lactobacillus.acetotolerans Lactobacillus.hamsteri Lactobacillus.amylolyticus Lactobacillus.intestinalis Lactobacillus.gallinarum Lactobacillus.helveticus Lactobacillus.acidophilus Lactobacillus.crispatus Lactobacillus.amylovorus Lactobacillus.fructosus B.subtilis 99579999 99 704924 98 90 79 999999859996949999 9955 99 85746473999985 999445 404332 67 89 7599 998475999972 6599 5799 52 4798 92 97 91853836481621 59 49 3943 358829 37 12 16 0.01
Mega的使用以及进化树的绘制
1.MEGA构建系统进化树的步骤 2.CLUSTALX进行序列比对 1.MEGA构建系统进化树的步骤 1. 将要用于构建系统进化树的所有序列合并到同一个fasta格式文件,注意:所有序列的方向都要保持一致( 5’-3’)。如图: 2. 打开MEGA软件,选择"Alignment" - "Alignment Explorer/CLUSTAL",在对话框中选择Retrieve sequences from a file, 然后点OK,找到准备好的序列文件并打开,如图: 。 3. 在打开的窗口中选择”Alignment”-“Align by ClustalX” 进行对齐,对齐过程需要一段时间,对齐完成后,最好将序列两端切齐,选择两端不齐的部分,
单击右键,选择delete即可,如图: 。 4. 关闭当前窗口,关闭的时候会提示两次否保存,第一次无所谓,保存不保存都可以,第二次一定要保存,保存的文件格式是.meg。根据提示输入Title,然后会出现一个对话框询问是否是Protein-coding nucleotide sequence data, 根据情况选择Yes或No。最后出现一个对话框询问是否打开,选择Yes,如图: 。 5. 回到MEGA主窗口,在菜单栏中选择”Phylogeny”-“Bootstrap Test of Phylogeny” -“Neighbor-joining”,打开一个窗口,里面有很多参数可以设
置,如何设置这些参数请参考详细的MEGA说明书,不会设置就暂且使用默认值,不要修改,点击下面的Compute按钮,系统进化树就画出来了,如图: 在菜单栏中选择”Phylogeny”-“Bootstrap Test of Phylogeny” –“Minimun-evolution”,如图: 在菜单栏中选择”Phylogeny”-“Bootstrap Test of Phylogeny” –“Maximun-parsimony”,如图: 在菜单栏中选择”Phylogeny”-“Bootstrap Test of Phylogeny” –“UPGMA”,
进化树的建立过程
进化树的建立过程 1, 通过测序后,在NCBI 中进行BLAST 比对,看和哪个属中的种最近,从而确定进化树 中需比较的菌种,然后可以在权威的International Journal of Systematic and Evolutionary Microbiology 杂志中看最近是否有你要建树的菌的图,从而更捷径的得到典型的建树对比菌株(一般上标为T) 2, 打开MEGA 4在Alignment →Query Databank s → 在上图红色圈出的空格处添加建树对比菌的登入号,然后直接点击上头的Add to Alignment ,以此添加,当然添加的量可多也可少,按照自己的要求,建的树越大需要比对的就越多,反之,亦然。添加完之后会是如下的图形,可以参照 。 3 添加完对比的后,将自己测序菌株序列导入 如果拿回来后的序列是文本文档,就需要将它转化成fasta 格式,其实也就是在文本文档上头加个“>”号就可以,但是序列字母必须是大写的,如果是小写的,可以在DNAman 中转化成大写的(或者在EditSeq 中的先全选择序列后在edit 的reverse case 中转变,后如下操作),并且需每列中的数字去掉,保存为fasta 格式后, 这里输入建树的登入号
在MEGA的Edit→insert sequences to file将保存的fasta文件导入MEMA中,如果导入的序列是互补链的话,直接在添加的里面,点击导入链,右击后点击互补就行,选中所有的序列后,在Alignmen t选项中选中Align by clustalw让其自动分析后,出现这样的界面,然后在Date选项中输出格式选择为MEGA格式保存 4 再一次启动软件将上一步保存的文件打开,然后在我红色标记的采用的是“邻接法”建树。 然后点击“computer“就可以输出图了
运用mega5构建系统发生进化树.
1.准备序列文件 准备fasta格式序列文件(fasta格式:大于号>后紧跟序列名,换行后是序列。举例如下)。每条序列可以单独为一个文件,也可以把所有序列放在同一文件内。 核酸序列: >sequence1_name CCTGGCTCAGGATGAACGCT 氨基酸序列: >sequence2_name MQSPINSFKKALAEGRTQIGF 2.多序列比对 打开MEGA 5,点击Align,选择Edit/Build Alignment,选择Create a new alignment,点击OK。
这时需要选择序列类型,核酸(DNA)或氨基酸(Protein)。 选择之后,在弹出的窗口中直接Ctrl + V粘贴序列(如果所有序列在同一个文件中,即可全选序列,复制)。也可以:点击Edit,选择Insert Sequence From File,选择序列文件(可多选)。
序列文件加载之后,呈蓝色背景(为选中状态)。点击按钮,选择Align DNA (如果是氨基酸序列,则会出现Align Protein)。弹出的窗口中设置比对参数,一般都是采用默认参数即可。点击OK,开始多序列比对。
比对完成后,呈现以下状态。 这时需要截齐两端含有---的序列:选中含有---的序列,按键Delete删除(注意:两端都需要截齐)。截齐之后,保存文件为:filename.mas
3.构建系统进化树 多序列比对窗口,点击Data,选择Phylogenetic Analysis,弹出窗口询问:所用序列是否编码蛋白质,根据实际情况选择Yes或No。此时,多序列比对文件就激活了,可以返回MEGA 5主界面建树了。
MEGA构建系统进化树的步骤(以MEGA7为例)
MEGA构建系统进化树的步骤(以MEGA7为例) 本文是看中国慕课山东大学生物信息学课程总结出来的 分子进化的研究对象是核酸和蛋白质序列。研究某个基因的进化,是用它的DNA序列,还是翻译后的蛋白质序列呢?序列的选取要遵循以下原则:1)如果DNA序列的两两间的一致度≥70%,选用DNA 序列。因为,如果DNA序列都如此相似,它的蛋白质会相似到看不出区别,这对构建系统发生树是不利的。所以这种情况下应该选用DNA序列,而不选蛋白质序列。2)如果DNA序列的两两间的一致度≤70%,DNA序列和蛋白质序列都可以选用。 1. 将要用于构建系统进化树的所有序列合并到同一个fasta格式文件,注意:所有序列的方向都要保持一致( 5’-3’)。 想要做系统发生树先要做多序列比对,然后把多序列比对的结果提交给建树软件进行建树,所以在用MEGA建树时可以输入一个已经比对好的多序列比对,也可以输入一条原始序列,让MEGA先来做多序列比对,再建树(一般我们都是原始序列)。所以我们以后者为例。 2.打开MEGA软件,选择主窗口的”File”→“Open A File”→找到并打开fasta文件,这时会询问以何种方式打开,我们是原始序列,需要先进行多序列比对,所以选择“Align”。如果是比对好的多序列比对可以直接选择“Analyze”。 3.在打开的Alignment Explorer窗口中选择”Alignment”-“Align by ClustalW”进行多序列比对(MEGA提供了ClustalW和Muscle两种多序列比对方法,这里选择熟悉的ClustalW),弹出窗口询问“Nothing selected for alignment,Select all?”选择“OK”。 4. 之后,弹出多序列比对参数设置窗口。这个窗口和EMBL在线多序列比对一样,可以设置替换记分矩阵、不同的空位罚分(罚分填写的是正数,计算时按负数计算)等参数。MEGA的所有默认参数都是经过反复考量设置的,这保证了MEGA傻瓜机全自动档的品质,所以当你无从下手,或者没有什么特别要求的时候,直接点击“OK”,接受这些默认参数,开始多序列比对。
进化树软件MEGA最新6.06说明书
第一步:打开软件 下面介绍菜单的使用: Data菜单: Creat a new :创建一个新的数据比对文件,也就是说当我们比对完一组后,想接着比对另一组,那么使用它就可以不用退出直接把数据文件导入; Open :打开先前已经比对并保存好的文件,它包含两个子菜单:retive sequence from file 和saved aligment session ; Close: 关闭当前的比对数据文件;
Save session :保存当前比对结果,可以给比对的结果一个文件名; Export alignment :将当前的序列比对结果输出到指定文件,有两种输入格式可供选 择:MGTA 和FASTA. DNA sequence :使用它来选择输入的数据DNA 序列,这里需要说明的是如果你输入的数据是氨基酸序列的话,比对窗口只显示一个标签,若是DNA 序列的话则显示两个标签,一个是DNA 序列的,另一个是氨基酸序列的。 Protein sequences :选择输入的氨基酸序列,选择后,所以的位点就被当作氨基酸残 基位点来对待。 Translate/untranslate :只有比对的序列是编码蛋白的DNA序列的时候才可用。它可以根据指定的遗传密码表将DNA 序列翻译成特定的氨基酸序列。 Select genetic code table :使用它将编码蛋白的DNA 翻译成特定的蛋白序列。 R everse complement :将选择的一整行的DNA 序列变为与之互补配对碱基序列。Exit alignment explorer :退出序列比对的资源管理窗口 Edit 菜单: 使用这个菜单可以对我们的比对序列进行想要的一些编辑工作具体为 Undo:撤销上一步操作; Copy:复制;Cut:剪切;Paste:粘贴;这三个操作都可以只针对一个碱基或 氨基酸残基也可以是一段甚至是整个序列; Delete:从比对表格中删除一段序列; Delete gaps:去掉序列中的空缺; Insert blank sequence:重新插入一空行;标签和序列都是空的; Insert sequence from file :从已保存的文件中插入新的序列;
构建系统进化树的方法步骤
构建系统进化树的方法步骤 1. 建树前的准备工作 1.1 相似序列的获得——BLAST BLAST是目前常用的数据库搜索程序,它是Basic Local Alignment Search Tool的缩写,意为“基本局部相似性比对搜索工具”(Altschul et al.,1990[62];1997[63])。国际著名生物信息中心都提供基于Web的BLAST服务器。BLAST算法的基本思路是首先找出检测序列和目标序列之间相似性程度最高的片段,并作为内核向两端延伸,以找出尽可能长的相似序列片段。 首先登录到提供BLAST服务的常用网站,比如国内的CBI、美国的NCBI、欧洲的EBI和日本的DDBJ。这些网站提供的BLAST服务在界面上差不多,但所用的程序有所差异。它们都有一个大的文本框,用于粘贴需要搜索的序列。把序列以FASTA格式(即第一行为说明行,以“>”符号开始,后面是序列的名称、说明等,其中“>”是必需的,名称及说明等可以是任意形式,换行之后是序列)粘贴到那个大的文本框,选择合适的BLAST程序和数据库,就可以开始搜索了。如果是DNA序列,一般选择BLASTN搜索DNA数据库。 这里以NCBI为例。登录NCBI主页-点击BLAST-点击Nucleotide-nucleotide BLAST (blastn)-在Search文本框中粘贴检测序列-点击BLAST!-点击Format-得到result of BLAST。 BLASTN结果如何分析(参数意义): >gi|28171832|gb|AY155203.1| Nocardia sp. ATCC 49872 16S ribosomal RNA gene, complete sequence Score = 2020 bits (1019), Expect = 0.0 Identities = 1382/1497 (92%), Gaps = 8/1497 (0%) Strand = Plus / Plus Query: 1 gacgaacgctggcggcgtgcttaacacatgcaagtcgagcggaaaggccctttcgggggt 60 |||||||||||||||||||||||||||||||||||||||||| ||||||||| ||||| Sbjct: 1 gacgaacgctggcggcgtgcttaacacatgcaagtcgagcggtaaggcccttc--ggggt 58 Query: 61 actcgagcggcgaacgggtgagtaacacgtgggtaacctgccttcagctctgggataagc 120 || ||||||||||||||||||||||||||||||| | |||||| ||||||||||||| Sbjct: 59 acacgagcggcgaacgggtgagtaacacgtgggtgatctgcctcgtactctgggataagc 118 Score :指的是提交的序列和搜索出的序列之间的分值,越高说明越相似;
用MEGA构建进化树
如何用MEGA构建进化树 MEGA3、1就是一个关于序列分析以及比较统计得工具包,其中包括有距离建树法与MP建树法;可自动或手动进行序列比对,推断进化树,估算分子进化率,进行进化假设测验,还能联机得Web数据库检索。下载后可直接使用,主要包括几个方面得功能软件:i)DNA与蛋白质序列数据得分析软件。ii)序列数据转变成距离数据后,对距离数据分析得软件。iii)对基因频率与连续得元素分析得软件。iv)把序列得每个碱基/氨基酸独立瞧待(碱基/氨基酸只有0与1得状态)时,对序列进行分析得软件。v)绘制与修改进化树得软件,进行网上blast搜索。 用MEGA构建进化树有以下步骤: 1、16S rDNA测序与参考序列选取 从环境中分离到单克隆,去重复后扩增16S rDNA序列并测序,然后与数据库比对,找到相似度最高得几个序列,确定一下您分离得细菌大约属于哪个科哪个属,如果相似度达到百分之百那基本可以确定您分离得到得就就是Blast到得那个,然后找一到两个同科得,再找一到两个同目得,再找一到两个同纲得细菌,把序列全部下下来,以FSATA形式整合在TXT文档中,如 >TS1 GCAGTCGAACGATGAAGCCCAGCTTGCTGGGTGGA TTAGTGGCGAACGGGTGAGTAACACGTGGGTGATCTGCCCTGCACTTCGGGATAAGCCTGGGAAACTGGGTCTAATACCGGATAGGACCTCGGGA TGCATGTTCCGGGGTGGAAAGGTTTTCCGGTGCAGGATGGGCC >gi|117572706|gb|EF028124、1| Rhodococcus sp、Atl25 16S ribosomal RNAgene,partial sequence CGATTAGAGTTTGATCCTGGCTCAGGACGAACGCTGGCGGCGTGCTTAACACATGCAAGTCGAACGATGAAGCCCAGCTTGCTGGGTGGATTAGTGGCGAACGGGTGAGTAACACGTGGGTGA TCTGCCCTGCACTTCGGGATAAGCCTGGGAAACTGGGTCTAATACCGGAT >TS2 TGCAAGTCGAGCGAATGGA TTAAGAGCTTGCTCTTATGAAGTTAGCGGCGGA CGGGTGAGTAACACGTGGGTAACCTGCCCATAAGACTGGGATAACTCCGG GAAACCGGGGCTAATACCGGATAACATTTTGAACTGCATGGTTCGAAATTGAAAGGCGGCTTCGGCTGTCACT >gi|56383044|emb|AJ809498、1|Bacillus cereus partial16S rRNA gene, strainTMW 2、383 GA TGAACGCTGGCGGCGTGCCTAATACATGCAAGTCGAGCGAATGGATTAAGAGCTTGCTCTTATGAAGTTAGCGGCGGACGGGTGAGTAACACGTGGGTAACCTGCCCATAAGACTGGGA TAACTCCGGGAAACCGGGGCTAA TACCGGATAACA TTTTGAACYGCA TGGTTC…………………………、 …………………………、 参考序列选择有几个原则:a,不选非培养(unclutured)微生物为参比;b,所选参考序列要正确,里面无错误碱基;c,在保证同属得前提下,优先选择16S rDNA全长测序或全基因组测序得种;d,每个种属选择一个参考序列,如果自己得序列中同一属得较多,可适当选择两个参考序列。 2、序列比对
应用PHYLIP构建进化树的完整详细过程
一、获取序列 一般自己通过测序得到一段序列(已知或未知的都可以),通过NCBI的BLAST获取相似性较高的一组序列,下载保存为FASTA格式。用BIOEDIT等软件编辑序列名称,注意PHYLIP在DOS下运行,文件名不能超过10位,超过的会自动截留前面10位。 二、多序列比对 目前一般应用CLASTAL X进行,注意输出格式选用PHY格式。生成的指导树文件(DND文件)可以直接用TREEVIEW打开编辑,形式上和最终生成的进化树类似,但是注意不是真正的进化树。 三、构建进化树 1.N-J法建树 依次应用PHYLIP软件中的SEQBOOT.EXE、DNADIST.EXE、NEIGHBOR.EXE和 CONSENSE.EXE打开。具体步骤如下: (1)打开seqboot.exe 输入文件名:输入你用CLASTAL X生成的PHY文件(*.phy)。 R为bootstrap的次数,一般为1000 (设你输入的值为M,即下两步DNADIST.EXE、NEIGHBOR.EXE中的M值也为1000) odd number: (4N+1)(eg: 1、5、9…) 改好了y 得到outfile(在phylip文件夹内) 改名为2 (2)打开Dnadist.EXE 输入2 修改M值,再按D,然后输入1000(M值) y 得到outfile(在phylip文件夹内) 改名为3 (3)打开Neighboor.EXE 输入3 M=1000(M值) 按Y 得到outfile和outtree(在phylip文件夹内) 改outtree为4,outfile改为402 (4)打开consense.exe 输入4 y 得到outfile和outtree(在phylip文件夹内) Outfile可以改为*.txt文件,用记事本打开阅读。 四、进化树编辑和阅读 outtree可改为*.tre文件,直接双击在treeview里看;也可以不改文件扩展名,直接用treeview、PHYLODRAW、NJPLOT等软件打开编辑。TREEVIEW可以显示BOOTSTRAN值,序列较多(60条以上)的时候打开直接显示有明显的重叠,可以在打印预览中显示,或输出为EMF WMF图片文件看,但是序列较多时BOOTSTRAN值的显示位置比较乱,和序列名称有重叠。 PHYLODRAW的编辑功能较强,可以自由调节X、Y轴的长度。输出格式为BMP、PS格式。缺点是不能直接显示BOOTSTRAN值,包括打开TREEVIEW输出的NEX文件,而且输出的BMP文件不全,类似截屏文件,我用PHOTOSHOP进行拼接合成,添加BOOTSTRAN值和注解符号等。据说也可以将PS文件用记事本打开,改变其中的字号,然后通过ADOBE DISTRILLOR将PS转化为P DF,就可以解决问题。如果发现还有重叠,可以再次改变PS文件中的字号大小,直到合适为止。 NJPLOT可以显示BOOTSTRAN值和分值长度。但是不能调节图片X、Y轴的长度。
MEGA构建系统进化树的步骤(以MEGA7为例)教学文案
M E G A构建系统进化树的步骤(以M E G A7为 例)
MEGA构建系统进化树的步骤(以MEGA7为例) 本文是看中国慕课山东大学生物信息学课程总结出来的 分子进化的研究对象是核酸和蛋白质序列。研究某个基因的进化,是用它的DNA序列,还是翻译后的蛋白质序列呢?序列的选取要遵循以下原则:1)如果DNA序列的两两间的一致度≥70%,选用DNA序列。因为,如果DNA序列都如此相似,它的蛋白质会相似到看不出区别,这对构建系统发生树是不利的。所以这种情况下应该选用DNA序列,而不选蛋白质序列。2)如果DNA 序列的两两间的一致度≤70%,DNA序列和蛋白质序列都可以选用。 1. 将要用于构建系统进化树的所有序列合并到同一个fasta格式文件,注意:所有序列的方向都要保持一致 ( 5’-3’)。 想要做系统发生树先要做多序列比对,然后把多序列比对的结果提交给建树软件进行建树,所以在用MEGA建树时可以输入一个已经比对好的多序列比对,也可以输入一条原始序列,让MEGA先来做多序列比对,再建树(一般我们都是原始序列)。所以我们以后者为例。 2.打开MEGA软件,选择主窗口的”File”→“Open A File”→找到并打开fasta文件,这时会询问以何种方式打开,我们是原始序列,需要先进行多序列比对,所以选择“Align”。如果是比对好的多序列比对可以直接选择“Analyze”。 3.在打开的Alignment Explorer窗口中选择”Alignment”-“Align by ClustalW”进行多序列比对(MEGA提供了ClustalW和Muscle两种多序列比对方法,这
phylip构建进化树详细操作过程
一、获取序列 将要比对的序列放到一个fasta文件中,文件内容类似如下: >gi|213627058|gb|热带爪蟾BC170657.1| Xenopus tropicalis ABO blood group (transferase A, alpha 1-3-N-acetylgalactosaminyltransferase; transferase B, alpha 1-3-galactosyltransferase), mRNA (cDNA clone MGC:197384 IMAGE:9039915), complete cds MVAFFCSLSWYAVKDRKWDPSIQHSCEEYWFRINGQKENRLQRMLYPKPETLKPPRTDVLTVSPWLAPI VWEGSFNTEILNNQFRQKGWRVGLTTFAIKKYIRFLKPFIETAEKFFMVGLPVNYYVFTDQASNVTDLN IIVGTGRQIIILEVPSYERWQDVTMRRMQMISDVCQQRFASEVDYLVCVDVDMRFQDHVGVEILSDVFG TLHPAFFVKGRDKFTYERRPESQAYIPEDEGDFYYAGGYFGGKVEEVYKLTNHCHHAMLTDKANNIEAI WHDESYLNSYFLYNKKPTKILSPEYLWNEMDGTAFYLRKIRFIALQKNMAEVRT >gi|homo MAEVLRTLAGKPKCHALRPMILFLIMLVLVLFGYGVLSPRSLMPGSLERGFCMAVREPDHLQRVSLPRM VYPQPKVLTPCRKDVLVVTPWLAPIVWEGTFNIDILNEQFRLQNTTIGLTVFAIKKYVAFLKLFLETAE KHFMVGHRVHYYVFTDQPAAVPRVTLGTGRQLSVLEVRAYKRWQDVSMRRMEMISDFCERRFLSEVDYL VCVDVDMEFRDHVGVEILTPLFGTLHPGFYGSSREAFTYERRPQSQAYIPKDEGDFYYLGGFFGGSVQE VQRLTRACHQAMMVDQANGIEAVWHDESHLNKYLLRHKPTKVLSPEYLWDQQLLGWPAVLRKLRFTAVP KNHQAVRNP 注意PHYLIP在DOS下运行,文件名不能超过10位,超过的会自动截留前面10位。 二、多序列比对 目前一般应用CLASTAL X进行,打开ClustalX 2.1,load sequence——save as (phylip)——Do complete alignment——获得*.Phy和*.dnd两个文件,生成的指导树文件(DND文件)可以直接用TREEVIEW打开编辑,形式上和最终生成的进化树类似,但是注意不是真正的进化树。 三、构建进化树 把文件拷贝到PHYLIP的exe文件夹目录下 1.N-J法建树 依次应用PHYLIP软件中的SEQBOOT.EXE、DNADIST.EXE、NEIGHBOR.EXE和CONSENSE.EXE打开。具体步骤如下: (1)打开seqboot.exe 输入文件名:输入你用CLASTALX生成的PHY文件(*.phy); 按 R; 输入1000; Random number seed(must be odd): 本人一般设为5; 按Y; 得到outfile(在phylip的exe文件夹内),outfile改名为2; (2)打开Dnadist.EXE(若为蛋白序列,打开PROTDIST) 输入2; 按M; 再按D; 输入1000; 按Y; 得到outfile(在phylip的exe文件夹内),改名为3;
一步一步教你如何做系统进化树
一步一步教你如何做系统进化树 在此介绍几个进化树分析及其相关软件的使用和应用范围。这几个软件分别是PHYLIP 、PUZZLE 、PAUP 、TREEVIEW 、CLUSTALX 和PHYLO-WIN (LINUX )。 在介绍软件之前,我先简要地叙述一下有关进化树分析的一些方法学问题。 进化树也称种系树,英文名叫“Phyligenetic tree ”。对于一个完整的进化树分析需要以下几个步骤:⑴ 要对所分析的多序列目标进行排列(To align sequences )。做ALIGNMENT 的软件很多,最经常使用的有CLUSTALX 和CLUSTALW ,前者是在WINDOW 下的而后者是在DOS 下的。⑵ 要构建一个进化树(To reconstrut phyligenetic tree )。构建进化树的算法主要分为两类:独立元素法(discrete character methods )和距离依靠法(distance methods )。所谓独立元素法是指进化树的拓扑形状是由序列上的每个碱基/氨基酸的状态决定的(例如:一个序列上可能包含很多的酶切位点,而每个酶切位点的存在与否是由几个碱基的状态决定的,也就是说一个序列碱基的状态决定着它的酶切位点状态,当多个序列进行进化树分析时,进化树的拓扑形状也就由这些碱基的状态决定了)。而距离依靠法是指进化树的拓扑形状由两两序列的进化距离决定的。进化树枝条的长度代表着进化距离。独立元素法包括最大简约性法(Maximum Parsimony methods )和最大可能性法(Maximum Likelihood methods );距离依靠法包括除权配对法(UPGMAM )和邻位相连法(Neighbor-joining )。⑶ 对进化树进行评估。主要采用Bootstraping 法。进化树的构建是一个统计学问题。我们所构建出来的进化树只是对真实的进化关系的评估或者模拟。如果我们采用了一个适当的方法,那么所构建的进化树就会接近真实的“进化树”。模拟的进化树需要一种数学方法来对其进行评估。不同的算法有不同的适用目标。一般来说,最大简约性法适用于符合以下条件的多序列:i 所要比较的序列的碱基差别小,ii 对于序列上的每一个碱基有近似相等的变异率,iii 没有过多的颠换/转换的倾向,iv 所检验的序列的碱基数目较多(大于几千个碱基);用最大可能性法分析序列则不需以上的诸多条件,但是此种方法计算极其耗时。如果分析的序列较多,有可能要花上几天的时间才能计算完毕。UPGMAM (Unweighted pair group method with arithmetic mean )假设在进化过程中所有核苷酸/氨基酸都有相同的变异率,也就是存在着一个分子钟。这种算法得到的进化树相对来说不是很准确,现在已经很少使用。邻位相连法是一个经常被使用的算法,它构建的进化树相对准确,而且计算快捷。其缺点是序列上的所有位点都被同等对待,而且,所分析的序列的进化距离不能太大。另外,需要特别指出的是对于一些特定多序列对象来说可能没有任何一个现存算法非常适合它。最好是我们来发展一个更好的算法来解决它。但无疑这是非常难的。我想如果有人能建立这样一个算法的话,那他(她)完全可以在 生 物秀-专心做生物 w w w .b b i o o .c o m
序列谱进化树方法
活性中心序列谱及系统发育树的制作 杨曼丽 1 序列谱的制作 1.1 搜集数据 查找数据。在CAZy数据库(https://www.wendangku.net/doc/1816066652.html,)中找到目标家族。All显示的是该家族所有的序列条目,Structure显示的是结构已经被实验解析的条目,Characterized显示的是有功能标注的条目。数据显示按Archaea、Bacteria和Eukaryota分类。排列按字母顺序。数据库中分别显示蛋白的名称、EC号、来源、GeneBank、Uniprot及PDB数据。 图1 下载PDB文件。将目标PDB文件下载。在同种蛋白含有不同PDB文件的时候注意文件的选取。可以通过上传时间、发表文献等找出最原始的结构,其他相关结构一般为该原始结构的突变结构。 下载Uniprot序列。将目标Uniprot文件下载,保存为Fasta格式。一般文件命名原则为:物种_EC号_Uniprot 号_PDB号(如果有的话)。物种用A、B、E标注。没有Uniprot号的用GenBank号代替。为了方便后续的建树,可以先将每个序列文件抬头(一般为第一行”>”标识)名称改为文件所命之名,这样可以省去在建树后改leaf名称的麻烦 1.2 活性中心架构的获取 底物的选取。用Pymol打开下载好的PDB文件,用present->ligands找出底物。也可显示全序列,查找序列末端。注意一般底物为BGC等糖环,而非ACT等小分子。有的底物在结构解析时有丢失,因此需要详细研究整个家族的PDB,以便将一些底物进行拼接。
图2 切点和方向的确定。找好底物后将整条糖链横向放置,找出非还原端和还原端(一般非还原端在左,还原端在右)。查找原始文献,找到切点位置,记录为0点。0点往非还原端方向的糖环分别为-1、-2、-3、-4……,往还原端方向的糖环分别为+1、+2、+3、+4……。 活性中心氨基酸的筛选。从一个糖环开始选取其邻近氨基酸。以5埃为例。选择第一个糖环的氧原子(如O6),Pymol的log会显示该原子的序号(如6006)。在CUI中输入命令:select near O6, resi 6006 around 5 。将选取出来的氨基酸保存后进行下一个原子周围的选取。 统计。用EXCEL对数据进行统计。一般首列为PDB号,首行为相对位置。比如一个氨基酸离-4位糖环的O4比较近,则命名此列为-4 O4。氨基酸的命名方法是位置号码+氨基酸名,如111A指的是111位的丙氨酸。将不同PDB的底物和相关氨基酸进行拼凑,至少保证每个位点上有一个氨基酸。 结构比对。打开VMD,Extension->Analysis->Multiseq. 输入PDB文件。选择Tools->Stamp Structural Alignment进行结构比对。比对完后找到目标氨基酸,将其同一位点所有结果都记录在EXCEL中。注意,空位点用“-”表示。 图3 注意:VMD使用的一些问题。 ①文件名不要超过8个字符否则会报错。因此之前为了建树方便的命名需要进行删减 ②在随后的结构模建中,用Swiss-model模建的结构有时候会有配体,而配体在源代码中显示为Z轴。这是VMD所不能识别的。因此,在结构比对之前需要把配体删除(如果是带有配体的PDB原文件则不影响)
用MEGA作进化树[2]
用MEGA2做进化树的步骤(图示) 1、打开程序 如下图所示: 2、MEGA2只能打开meg格式的文件,但是它可以把其他格式的多序列比对文件转换过来,我们在这里用aln格式(Clustal的输出文件)转换meg文件。点File:Convert to MEGA Format...打开转换文件对话框 如下图所示:
3、选择文件和转换文件对话框,选择aln文件,点OK 如下图所示: 4、转换好的meg文件,点存盘保存meg文件,meg文件会和aln文件保存在同一个目录 如下图所示: 5、关闭转换窗口,回到主窗口,现在点面板上的“Click me to activate a data file”打开刚才的meg 文件 如下图所示:
6、选择meg文件,点“打开” 如下图所示: 7、程序会自动识别序列的类型,如果识别错误,请手工选择数据类型。然后点OK就行了如下图所示:
8、数据输入之后的样子,窗口下面有序列文件名和类型 如下图所示: 9、现在终于可以开始做Bootstrap验证和进化树了,MEGA的主要功能就是做Bootstrap验证的进化树分析,Bootstrap验证是对进化树进行统计验证的一种方法,可以作为进化树可靠性的一个度量。各种算法虽然不同,但是操作方法基本一致,我们在此以UPGMA方法为例进行演示。点下图所示的菜单项。 如下图所示:
10、...会弹出如下的对话框,在此你可以选择计算参数。 如下图所示: 11、Distance Options标签页中的Models可以下拉,其中有若干个计算距离的方法可以选择,在此默认泊松校验(Poisson Correction)作为计算距离的方法。 如下图所示:
构建系统进化树的详细步骤
构建系统进化树的详细步骤 1. 建树前的准备工作 1.1 相似序列的获得——BLAST BLAST是目前常用的数据库搜索程序,它是Basic Local Alignment Search Tool 的缩写,意 为“基本局部相似性比对搜索工具”(Altschul et al.,1990[62];1997[63])。国际著名生物信息中心 都提供基于Web的BLAST服务器。BLAST算法的基本思路是首先找出检测序列和目标序 列之间相似性程度最高的片段,并作为核向两端延伸,以找出尽可能长的相似序列片段。 首先登录到提供BLAST服务的常用,比如国的CBI、美国的NCBI、欧洲的EBI和日本的DDBJ。这些提供的BLAST服务在界面上差不多,但所用的程序有所差异。它 们都有一个大的文本框,用于粘贴需要搜索的序列。把序列以FASTA格式(即第一行为说明 行,以“>”符号开始,后面是序列的名称、说明等,其中“>”是必需的,名称及说明等可以是 任意形式,换行之后是序列)粘贴到那个大的文本框,选择合适的BLAST程序和数据库,就 可以开始搜索了。如果是DNA序列,一般选择BLASTN搜索DNA数据库。 这里以NCBI为例。登录NCBI主页-点击BLAST-点击Nucleotide-nucleotide BLAST (blastn)-在Search文本框中粘贴检测序列-点击BLAST!-点击Format-得到result of BLAST。 BLASTN结果如何分析(参数意义): >gi|28171832|gb|AY155203.1| Nocardia sp. ATCC 49872 16S ribosomal RNA gene, complete sequence Score = 2020 bits (1019), Expect = 0.0 Identities = 1382/1497 (92%), Gaps = 8/1497 (0%) Strand = Plus / Plus
- 建树方法进化树的建立过程
- 应用PHYLIP构建进化树的完整详细过程
- mega建树方法 进化树的建立过程
- 进化树绘制过程
- 系统进化树的制作
- 系统进化树的制作 PPT
- 序列谱进化树方法
- mega操作过程-多序列比对、进化树
- 系统进化树制作步骤MEGA5.10
- 进化树的建立过程
- MEGA构建系统进化树的步骤(以MEGA7为例)
- 系统进化树的制作 ppt课件
- 进化树(精美自制)PPT
- 最新手把手教你构建系统进化树
- phylip构建进化树详细操作过程
- MEGA构建系统进化树的步骤(以MEGA7为例)
- 手把手教你构建系统进化树
- mega操作过程-多序列比对、进化树、讲述
- mega操作过程 多序列比对 进化树
- 系统进化树的构建
