响应面法优化超声波辅助提取石榴籽中原花青素工艺的研究_李茜

响应面法优化超声波辅助提取石榴籽中原花青素工艺的研究
李茜,吕萍,薛波,孙潇辉,丁之恩
(安徽农业大学茶与食品科技学院,安徽合肥230036)
摘
要:以安徽怀远石榴的薄皮糙品种为原料,研究石榴籽中原花青素的提取工艺。在单因素实验基础上选取提取功
率、
pH 、液料比和提取溶剂浓度四个实验因素。根据中心组合(Box-Behnken )实验设计原理,采用四因素三水平的响应面分析方法,对各因素的显著性和交互作用进行分析,优化石榴籽中原花青素的提取工艺。结果表明:超声波辅助
提取石榴籽中原花青素的最佳工艺条件为功率125W 、pH5.0、料液比1?33、乙醇浓度51%,在此提取条件下,原花青素的得率最高达4.40%,
相对误差0.23%。关键词:响应面法,超声波,石榴籽,原花青素
Study on optimization of the process of ultrasonic assisted extraction of proanthocyanidins in pomegranate seeds by response surface methodology
LI Qian ,LV Ping ,XUE Bo ,SUN Xiao -hui ,DING Zhi -en
(College of Tea &Food Science and Technology ,Anhui Agricultural University ,Hefei 230036,China )
Abstract :In this paper ,thin -skinned rough of Anhui Huaiyuan pomegranate varieties was selected as raw materials to research proanthocyanidin extraction process in pomegranate seeds .Four factors such as extraction power ,pH ,solid -liquid ratio and extraction solvent concentration were selected based on single -factor tests .Response surface methodology of four factors and three levels was used to analyze significance and interaction of every factor according to the center combination (Box -Behnken )experimental design principles ,and to optimize the extraction process of procyanidins in pomegranate seeds .The results showed that the optimum conditions for ultrasonic assisted extraction of procyanidins in pomegranate seed was power 125W ,
pH 5.0,solid -liquid ratio 1?33,ethanol concentration of 51%,and the extraction rate of proanthocyanidins was up to 4.40%,relative error of 0.23%under this extraction conditions .
Key words :response surface methodology ;ultrasound ;pomegranate seeds ;procyanidins 中图分类号:TS201.4
文献标识码:B
文章编号:1002-0306(2013)09-0224-06
收稿日期:2012-10-30
作者简介:李茜(1987-),女,在读硕士研究生,研究方向:营养与食品
卫生。
基金项目:国家自然科学基金(30571520)。
石榴(Punica granatum L .)又名海榴、若榴等,为
石榴科石榴属落叶灌木或小乔木,具有降血糖、血脂和抗菌、
抗肿瘤等功效[1-2]
。石榴汁中含丰富的维生素和矿物质,
如V A 、V B1、V B2、V C 、钙、铁、钾、锌等[3-4]
;石榴籽中主要含有棕榈酸、硬脂酸、亚油酸、油酸、花
生酸、山嵛酸、石榴酸、α-桐酸等脂肪酸[5]
;果皮中富含黄酮类化合物。原花青素(Proanthocyanidins ,PC )是从植物中分离得到,在酸性条件下经醇加热处理后能产生花色素的多酚类物质,
包括单体和聚合体:单体包含黄烷-4-醇和黄烷-3,
4-二醇;聚合体由黄烷-3-醇的单体结构单位聚合而成[6]
。原花青素抗氧化活性极强,可清除人体自由基,降低毛细血管通
透性,缓解心血管疾病,改善视觉功能,抗辐射,抗过
敏,还具有皮肤保健及美容作用[7]
。本实验以怀远石榴(薄皮糙品种)为原料,对其原花青素的提取工艺
进行探讨,
并利用响应面法对提取参数进行优化,为石榴的深度开发提供科学依据。
1
材料与方法
1.1
材料与仪器
安徽怀远涂山石榴(品种:薄皮糙)安徽省怀远县涂山石榴专业合作社提供;原花青素标准品、甲醇、乙醇、丙酮、乙酸乙酯、乙腈、香草醛、浓硫酸、六
偏磷酸钠(SH )、
HCl 、NaOH 均为分析纯。ML204/02精密电子天平梅特勒-托利多仪器
(上海)有限公司;KQ -250DE 型数控超声波清洗器昆山市超声仪器有限公司;GZX -9146MBE 数显鼓风干燥箱上海博迅实业有限公司医疗设备厂;UV-1800紫外可见分光光度计上海美诺达仪器有限公司;DL-5-B 飞鸽离心机上海安亭科学仪器厂;RV10旋转蒸发仪广州仪科实验室技术有限公司;DK-S24型电热恒温水浴锅上海精宏实验设
备有限公司;SHA-B 双功能水浴恒温振荡器金坛市杰瑞尔电器有限公司;FDU -2100真空冷冻干燥机
上海爱朗仪器有限公司。
1.2
实验方法
1.2.1
标准曲线的建立[8]
配制0.1mg /mL 原花色
素标准溶液,分别吸取0.0、
1.0、
2.0、
3.0、
4.0、
5.0mL 置于6个10mL 容量瓶中,各加入乙醇溶液定容至
10mL ,各取1mL 于6支试管中,分别加入2.5mL 3%香草醛乙醇溶液和2.5mL 30%硫酸乙醇溶液,摇匀
后于30?水浴保温20min ,然后在500nm 处测定吸光度,绘制标准曲线。
1.2.2石榴籽原花青素的提取[9]
将洗净的石榴籽
置于40?烘箱内干燥72h ,取出粉碎,过40目筛。精
确称取1.0g 石榴籽干粉于50mL 锥形瓶中,按要求加入一定量溶剂提取一段时间,离心,得到原花青素类物质提取液。
1.2.3石榴籽原花青素得率的测定[10]
采用香草
醛-硫酸法测定样品中原花青素含量。取样品溶液
1mL 按标线制作方法操作,于500nm 处测定吸光度,根据原花青素标准工作曲线计算出样品中原花青素含量,并按下式计算出原花青素得率。得率(%)=样品中原花青素含量/样品质量?1001.2.4
单因素实验根据参考文献,考察提取溶剂
的种类、提取溶剂浓度、pH 、料液比、提取时间、提取
功率对原花青素提取效果的影响。
1.2.4.1提取溶剂的选择[11-12]准确称取1.0g 石榴籽干粉,选用pH4.5的50%不同溶剂(丙酮、甲醇、乙醇、乙酸乙酯、乙腈),在料液比1?30,超声波功率150W 条件下浸提70min ,离心,测定提取液吸光度,根据原花青素标准曲线计算出样品中原花青素含量,从而换算出原花青素得率,以得率为考察指标,确定较佳的提取溶剂。重复3次,取平均值。
1.2.4.2提取溶剂浓度的确定准确称取1.0g 石榴
籽干粉,
其他条件保持不变,考察不同乙醇溶液浓度对原花青素得率的影响,重复3次,取平均值。
1.2.4.3pH 的确定准确称取1.0g 石榴籽干粉,选用50%乙醇溶液进行提取,其他条件保持不变,考察不同pH 对原花青素得率的影响,重复3次,取平均值。
1.2.4.4料液比的确定准确称取1.0g 石榴籽干粉,选用50%乙醇溶液在pH5.0条件下进行提取,其他条件保持不变,考察不同料液比对原花青素得率的影响,重复3次,取平均值。1.2.4.5
提取时间的确定准确称取1.0g 石榴籽干粉,选用50%乙醇溶液在pH5.0,料液比1?30条件下
进行提取,其他条件保持不变,考察不同提取时间对原花青素得率的影响,重复3次,取平均值。1.2.4.6
提取功率的确定准确称取1.0g 石榴籽干粉,选用50%乙醇溶液在pH5.0,料液比1?30条件下
提取70min ,
考察不同提取功率对原花青素得率的影响,重复3次,取平均值。1.2.5
响应面实验设计
[13]
响应面实验设计因素与
水平见表1。
表1响应面实验设计表
Table 1
Factors and the level of response surface analysis
因素
水平-101X 1功率(W )100125150X 2pH 4.5 5.0 5.5X 3料液比1?201?301?40X 4乙醇浓度(%)
40
50
60
2
结果与分析
2.1
原花青素标准曲线
以原花青素浓度为横坐标,吸光度为纵坐标,得
回归方程:y =3.55x +0.0011,
R2
=0.9995。结果表明,
测定在0 0.2mg /mL 范围内线性良好
。图1原花青素标准曲线
Fig.1
The standard curve of proanthocyanidins
2.2
单因素实验
2.2.1
提取溶剂的选择原花青素含有羟基,易发
生氢键缔合作用,因此要求提取溶剂不仅对其具有
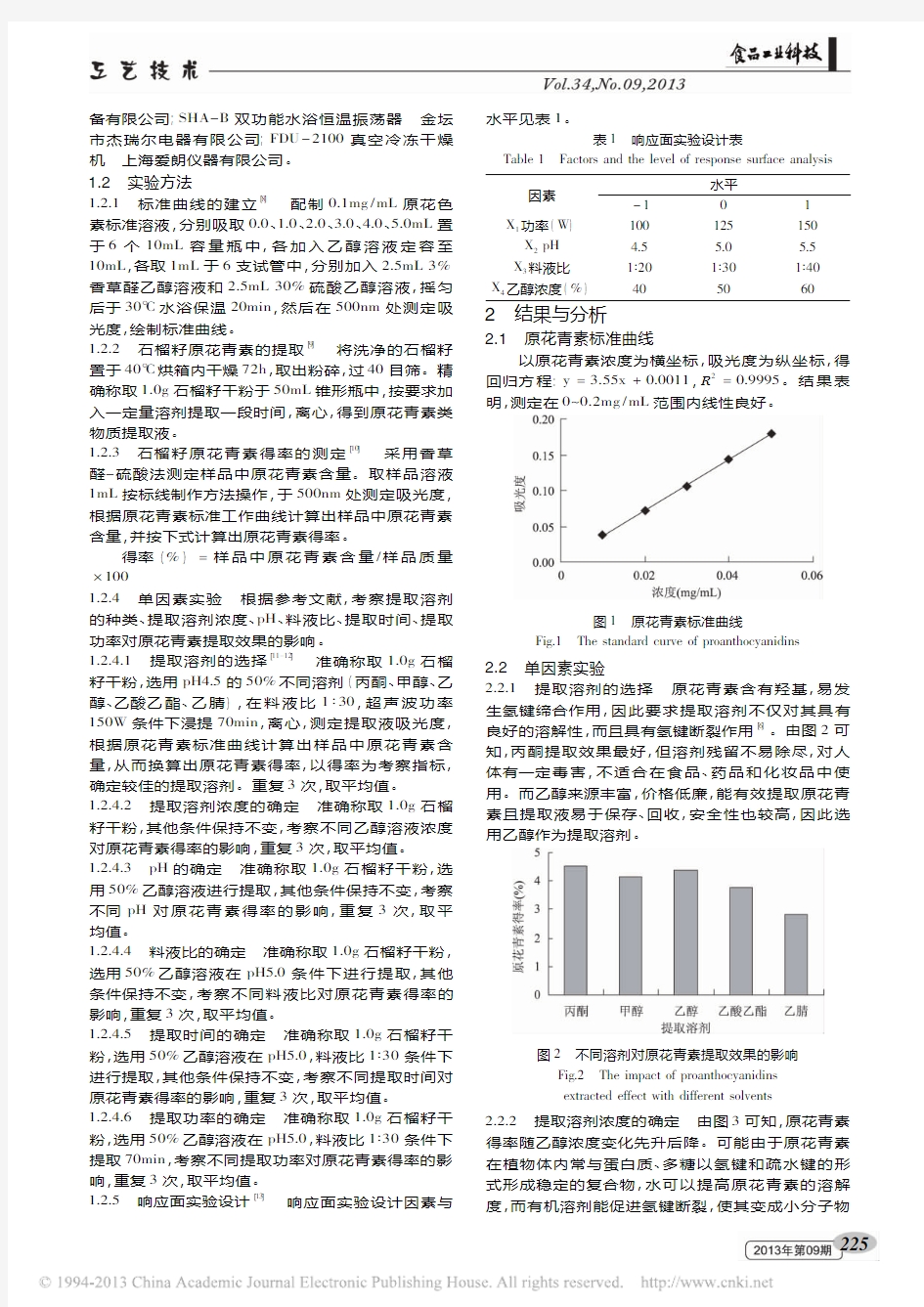
良好的溶解性,而且具有氢键断裂作用[6]。由图2可
知,
丙酮提取效果最好,但溶剂残留不易除尽,对人体有一定毒害,
不适合在食品、药品和化妆品中使用。而乙醇来源丰富,价格低廉,能有效提取原花青素且提取液易于保存、回收,安全性也较高,因此选用乙醇作为提取溶剂
。
图2不同溶剂对原花青素提取效果的影响
Fig.2The impact of proanthocyanidins
extracted effect with different solvents
2.2.2
提取溶剂浓度的确定
由图3可知,原花青素
得率随乙醇浓度变化先升后降。可能由于原花青素
在植物体内常与蛋白质、多糖以氢键和疏水键的形式形成稳定的复合物,水可以提高原花青素的溶解
度,而有机溶剂能促进氢键断裂,使其变成小分子物
质,易于游离到胞外,从而萃取到溶剂中[6]
。随着乙醇浓度的增加,水溶解带出的原花青素浓度逐渐达
到饱和。当水溶解带出的分子与乙醇断开氢键形成的分子数达到平衡时得率最高。继续增大乙醇浓度,一些醇溶性杂质和亲脂性强的成分溶出增加,与
原花青素竞争同乙醇-水分子结合,导致提取得率下降
[14]
。提取液体积分数的增大使原花青素氧化速率
加快也是得率下降的原因之一。故而选择浓度为
50%的乙醇溶液进行提取
。
图3乙醇浓度对原花青素得率的影响
Fig.3The impact of procyanidins yield with different ethanol concentration
2.2.3
pH 的确定
从图4可知,加入少量酸可以打
开以氢键和疏水键与蛋白质、
多糖以及本身相连的原花青素和以共价键与植物组织分子相连的多酚,
形成更多的游离多酚和原花青素,酸还可以抑制酚类物质与金属离子发生的沉淀反应,从而提高多酚的得率。但是pH 过小,多酚的溶解性能反而减小,降低得率,可能由于原花青素含有多个羟基,一般呈
弱酸性,
易溶于碱性溶液中,酸度过低降低其溶解性。pH 过高,可能发生酸碱中和反应破坏原花青素
的结构,导致得率下降。故选择pH 为5.0
。
图4pH 对原花青素得率的影响
Fig.4The impact of procyanidins yield with different pH 2.2.4
料液比的确定
根据图5可以看出,当料液比
小于1?30后,随溶剂用量增大,得率开始下降。因为料液比达一定程度时,有效成分基本完全析出,此时继续增大料液比,会使更多杂质溶出,而且增加了生产成本[15]
。因此选择料液比为1?30。
2.2.5
提取时间的确定
由图6可知,在一定时间范
围内,
原花青素的得率随着提取时间的延长而增加,原因是原花青素没有完全提出。70min 得率达到最大。70min 以后,大部分原花青素被浸提出来,原花青素的氧化处于主导地位,
发生自身氧化还原反应
,图5料液比对原花青素得率的影响Fig.5The impact of procyanidins yield
with different solid-liquid ratio
而且原花青素遭到超声波破坏,得率下降[16-17]
。故选
择提取时间为70min
。
图6提取时间对原花青素得率的影响
Fig.6The impact of procyanidins yield
with different extraction time
2.2.6
提取功率的确定
根据图7可知,在一定功率
下,超声波产生的强烈振动、高加速度、强烈的空化
效应和搅拌等特殊作用,可以使植物的细胞壁破坏,溶剂渗透到细胞,令原花青素溶于其中,从而提高提取效率。功率过大,
细胞中其他物质溶出率也提高,这些物质与原花青素竞争同乙醇-水分子结合,而且,高功率的超声波放出大量的热,破坏原花青素的
结构,
导致原花青素得率下降[18]
。因此选择125W 作为提取功率
。
图7提取功率对原花青素得率的影响
Fig.7The impact of procyanidins yield
with different extraction power
2.3
响应面分析法优化实验设计
2.3.1
响应面实验设计及结果
采用Design-Expert
V8.0.6软件对实验数据进行回归分析,可以求出影响
各因素一次效应、二次效应及其交互效应的关联方
程,对超声波辅助提取石榴籽原花青素的影响因素进行条件优化,并作出响应面图。多元回归拟合分析得到的得率与各因素变量间的二次方程模型为:
Y=-133.76533+0.0208X
1+35.47667X
2
+
1.62552X
3+0.98425X
4
+0.044X
1
X
2
+3.9E-0.04X
1
X
3
+5.7E-0.04X
1X
4
-0.113X
2
X
3
-0.0620X
2
X
4
-1.95E-
0.03X
3X
4
- 1.11093E-0.03X
1
2- 3.53733X
2
2-
0.016006X
32-6.73083E-0.03X
4
2,R2=0.9952表2响应面分析实验设计及结果
Table2Experimental design for response surface analysis and corresponding experimental data
实验号X1X2X3X4原花青素得率
(%)
Y预测值
(%)
10000 4.26 4.32
210-10 1.55 1.50
31001 3.27 3.32
4-10-10 1.54 1.53
5-1-100 3.57 3.66
61-100 2.64 2.72
7001-1 2.56 2.62
80110 1.35 1.34
90-101 3.73 3.66
10-1100 1.61 1.67
110000 4.37 4.32
120000 4.24 4.32
130101 2.29 2.15
140000 4.35 4.32
15-1010 2.36 2.36
16100-1 2.84 2.75
170-1-10 1.28 1.20
180-110 3.46 3.36
19010-1 2.47 2.49
2000-11 1.79 1.87
210011 2.42 2.51
22-1001 2.87 2.87
23-100-1 3.01 2.88
2401-10 1.43 1.44
250000 4.39 4.32
2600-1-1 1.15 1.20
271010 2.76 2.72
280-10-1 2.67 2.76
291100 2.88 2.93
根据表3可知,用上述回归方程描述各因素与响应值间的关系时,因变量与各自变量间的线性关系显著,模型的显著水平小于0.05,回归方程模型极显著,且方程失拟项不显著,表明该方程对实验的拟合情况好。模型的校正决定系数为0.9904,说明该模型能解释99.04%响应值的变化,仅有约0.96%不能用该模型解释。信噪比为43.573,远大于4,说明可信度很高。相关系数为0.9952,说明该模型拟合程度良好,预测值和真实值之间有较好的相关性,实验误差小,因此可用此回归方程对实验结果进行分析预测[19-20]。由F值可以得到各因素对得率影响从大到小的顺序依次为:料液比(X3)、pH(X2)、乙醇浓度(X
4
)、功率(X
1
)。
图8 图12是从实验得到的回归优化响应面图,从图中可看出各因素在提取过程中的交互作用,由于X1X3交互作用不显著,故不再列出。响应面图的曲面越陡,交互作用越显著,反之越不显著。等高线的形状也可反映交互效应的强弱,椭圆形表示交互作用显著,圆形则与之相反[21]。比较图8 图12可知,料液比(X3)曲线相对较陡,因此对原花青素得率的影响最显著;而功率(X1)曲线较为平滑,响应值变化随其数值的变化较小,因此对原花青素得率影响较小。pH(X2)和料液比(X3)的交互作用最显著,表现为等高线形状为椭圆形
。
图8功率、pH及其相互作用对原花青素得率影响的响应面Fig.8Response surface showing the effects
of power and pH on extraction yield of
PC
图9功率、浓度及其相互作用
对原花青素得率影响的响应面
Fig.9Response surface showing the effects
of power and concentration on extraction yield of
PC
图10pH、料液比及其相互作用
对原花青素得率影响的响应面
Fig.10Response surface showing the effects of pH
and solid-liquid ratio on extraction yield of PC
表3方差分析
Table 3Analysis of variance
方差来源自由度平方和均方F 值p 值显著性模型1428.89 2.06207.91<0.0001**X 110.0800.0808.060.0131*X 21 2.36 2.36237.63<0.0001**X 31 3.17 3.17319.63<0.0001**X 410.230.2323.420.0003**X 1X 21 1.21 1.21121.91<0.0001**X 1X 310.0380.038 3.830.0706X 1X 410.0810.0818.180.0126*X 2X 31 1.28 1.28128.65<0.0001**X 2X 410.380.3838.73<0.0001**X 3X 410.150.1515.320.0016**X 121 3.13 3.13315.06<0.0001**X 221 5.07 5.07511.09<0.0001**X 32116.6216.621674.25<0.0001**X 4
2
1 2.94 2.94296.07<0.0001**
总残差140.149.925?10-3
失拟误差100.120.012 2.64
0.1811
纯误差40.018 4.570?10-3
总和
28
29.03
注:**p <0.01,差异极显著;*p <0.05,差异显著。R2
=0.9952,R2Adj =0.9904,
Adeq Precision =43.573
。图11
pH 、浓度及其相互作用
对原花青素得率影响的响应面
Fig.11
Response surface showing the effects of pH
and concentration on extraction yield of
PC
图12
料液比、浓度及其相互作用
对原花青素得率影响的响应面
Fig.12Response surface showing the effects
of solid-liquid ratio and concentration on extraction yield of PC 2.3.2
验证实验
根据模型可预测提取的最优工艺
条件为:功率124.06W ,pH4.89,料液比1?33.38,浓度50.88%,在此条件下,原花青素得率理论值可达4.41%。
为检验实验结果是否与真实情况一致,进行近
似验证实验。考虑实际操作条件,
将最佳工艺条件定为:功率125W ,
pH5.0,料液比1?33,浓度51%,进行3次平行实验,
原花青素得率为4.40%,与理论值相比,相对误差约为0.23%,且重复性较好,证明结
果可靠。
3结论
采用超声辅助提取石榴籽中原花青素,通过单
因素实验和响应面实验设计对提取工艺条件进行优
化,
得到较优工艺条件为:功率125W ,pH5.0,料液比1?33,浓度51%,在此条件下,石榴籽原花青素得率为4.40%。
参考文献
[1]Yamashita Yoko ,Okab Masaaki ,Natsume Midori ,et al .Prevention mechanisms of glucose intolerance and obesity by cacao liquor procyanidin extract in high-fat diet -fed C57BL /6mice [J ].Archives of Biochemistry and Biophysics ,2012,527(2):95-104.
[2]Wang Lei ,Ho Jeffrey ,Glackin Carlotta ,et al .Specific
pomegranate juice components as potential inhibitors of prostate cancer metastasis [J ].Translational Oncology ,2012,5(5):344-355.
[3]马齐,秦涛,王丽娥,等.石榴的营养成分及应用研究现状[J ].食品工业科技,2007,28(2):237-238.
(下转第232页)
表3回归模型的方差分析
Table3Variance analysis of regressive model
方差来源平方和自由度均方F值p值显著性模型 5.2490.5888.89<0.0001极显著A0.1510.1523.530.0047
B 2.561 2.56390.59<0.0001
C0.4410.4467.080.0004
AB0.00302510.0030250.460.5268
AC0.05710.0578.660.0322
BC0.2510.2538.660.0016
A20.6110.6193.650.0002
B2 1.071 1.07163.56<0.0001
C20.3410.3451.600.0008
误差0.03350.006544
失拟项0.03130.01011.380.0818不显著误差项0.00181120.0009053
总和 5.2714
R2=0.9983,R2
adj
=0.9826,S/N=27.744
2005,43(10):1557-1566.
[4]Meiers S,Kemény M,Weyand U,et al.The anthocyanidins cyanidin and delphinidin are potent inhibitors of the epidermal growth-factor receptor[J].Journal of Agricultural and Food Chemistry,2001,49(2):958-962.
[5]Zhou S Z,LüY,Chen J,Liu D,et al.Phenolics and antioxidant properties of bayberry(Myrica rubra Sieb.et Zucc.)pomace[J].Food Chemistry,2009,112:394-399.
[6]Fang Z X,Zhang M,Wang L X.HPLC-DAD-ESIMS analysis of phenolic compounds in bayberries(Myrica rubra Sieb.et Zucc.)[J].Food Chemistry,2007,100:
檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾檾
845-852.
(上接第228页)
[4]Waheed S,Siddique N,Rahman A,et al.INAA for dietary assessment of essential and other trace elements in14fruits harvested and consumed in Pakistan[J].Journal of Radioanalytical and Nuclear Chemistry,2004,260:523-531.[5]马齐,秦涛,王丽娥,等.石榴籽油的提取及成分分析[J].粮油食品科技,2008,16(1):29-30.
[6]石碧,狄莹.植物多酚[M].北京:科技出版社,2000. 12-35.
[7]Iglesias Jacobo,Pazos Manuel,Lluis Torres Josep,et al. Antioxidant mechanism of grape procyanidins in muscle tissues:Redox interactions with endogenous ascorbic acid and alpha-tocopherol[J].Food Chemistry,2012,134(4):1767-1774.[8]孙芸.葡萄籽原花色素聚合度与功效关系的研究[D].无锡:江南大学,2004.
[9]张海晖,李金凤,段玉清,等.板栗壳原花青素提取及其稳定性研究[J].食品科学,2011,32(8):5-9.
[10]郑俊霞,肖付才,李华.香草醛-HPLC结合法测定葡萄籽超微粉中的原花青素[J].食品科技,2009,34(11):304-308.[11]王文君,向灿辉,王江,等.超声波法提取紫番薯原花青素的工艺条件研究[J].食品科技,2011,36(2):179-182.[12]李超,王卫东,郑义,等.原花青素的超声提取工艺研究[J].中国食品添加剂,2010,4:68-71.
[13]陈健,孙爱东,高雪娟,等.响应面分析法优化超声波提取槟榔原花青素工艺[J].食品科学,2011,32(04):82-83.[14]肖付才,李华,王华.葡萄籽原花青素的提取和检测方法[J].食品研究与开发,2007,28(20):165-169.
[15]杨磊,苏文强,李艳杰,等.正交实验法优选低聚原花青素的提取工艺[J].林产化学与工业,2004,24(2):57-60.[16]赵兵.循环超声提取技术在中药提取中的应用[C].西安:中药提取技术(国际)研讨会会议论文,2005:26-29.[17]李超,王卫东,郑义,等.响应曲面法优化原花青素的超声波协同微波提取工艺[J].食品与发酵工业,2009,35(10):167-171.
[18]史振民,张祝莲,杨文选,等.超声法提取芦丁操作条件的最佳选择[J].延安大学学报:自然科学版,2005,18(3):46-49.
[19]李超,王卫东,郑义,等.响应曲面法优化原花青素的超声提取工艺[J].食品工程,2009(11):124-126.
[20]李超,孙月娥,王卫东,等.响应曲面法优化原花青素的高压微波提取工艺研究[J].食品科学,2009,30(18):39-43.[21]汪志慧,孙智达,谢笔钧.响应曲面法优化双酶法提取莲房原花青素[J].食品科学,2011,32(4):64-68.
桑葚中花青素的提取
桑葚中花青素的提取与检测 桑椹所含花青素色价高、抗氧化能力强,是一种理想的营养强化剂和着色剂[1]。桑椹最大加工品为桑椹汁。为了去除生长过程和收获环节原料沾带的杂质及微生物,桑椹汁加工前需对原料进行有效清洗。花青素易极溶于水,更易溶于乙醇等亲水有机溶剂,因此,桑椹清洗水呈浓重的紫黑色,表明桑椹果实中的一部分花青素已溶于清洗水。在以往的研究中发现,盐酸、柠檬酸等溶液对花青素具有一定的保护作用[2]。由于桑椹汁加工中原料需经历灭酶、浓缩、杀菌等诸多强热处理以及冗长的加工过程,产品中的花青素损失、劣化严重。如能在热处理以前的清洗过程提取分离出部分花青素,既避免了有效成分的破坏,又可获得高品质的副产品,使桑椹资源合理、充分地利用。为此,依据桑椹汁加工流程,设想在不影响主产品产量和品质的前提下,通过选择对桑椹花青素溶出效率高的浸提介质和对原料整体性破坏较小清洗方法,在桑椹汁加工前分离出部分高品质花青素。 1 实验材料、流程及检测方法 1.1 实验材料 桑椹为北京大兴区产,品种为黑珍珠。采集完熟果实并剔除烂果及杂质,低温贮藏。 1.2 实验试剂和主要仪器 无水乙醇、盐酸、氢氧化钠、柠檬酸、柠檬酸钠购于北京化学试剂公司;AB-8 大孔树脂购于南开大学化工厂;ZFQ85A 旋转蒸发器,上海医械专机厂;SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸有限公司;JA1003N 电子天平,上海精密科学仪器有限公司;GZX-9023MBE 数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;PHS-25 型酸度计,上海精密科学仪器有限公司紫外—可见分光光度计,北京普析仪器有限公司。高效液相色谱,安捷伦科技有限公司 1.3 实验流程 依据主要产品为桑椹浓缩汁的加工流程,在清洗水中提取桑椹花青素的试验工艺流程确定为:桑椹果实——强化清洗——洗水精滤——上柱吸附——解吸——浓缩脱溶——干燥——花青素粗提物为了保持桑椹鲜果的完整性,避免因破损造成的糖和酸的溶出损失,增加花青素浸提量,提高浸提液中花青素含量,降低果胶等胶体物质进入,清洗过程将采用对原料损伤较轻的模拟移动床逆流淋浸原理,以阶段浸泡、逆流阶段浸泡、逆流淋洗为浸提单元组合浸提流程。 并尝试使用蒸馏水及对花青素具有良好溶出和保护效果,且对主产品生产无明显不利影响的柠檬酸和乙醇溶液为浸提介质。在吸附分离工序将比较、优选分离花青素常用的AB-8、D101、NKA、X-5 中的优者为吸附介质[3]。 1.4 实验方法 清洗介质:5%柠檬酸溶液、5%乙醇溶液、蒸馏水。 清洗方法:以1:1 料水比循环喷淋5min、浸泡2min、逆流淋浸(3 级以上,2min/级)。 精滤介质:0.45μm 微滤膜。 吸附介质:大孔树脂AB-8、D101、NKA、X-5。 吸附解吸参数:上样流量2BV/h,0.1%HCL 的80%乙醇洗脱[4]。 色价的测定[5]:用分光光度计测定10g/L 色素溶液在最大吸收波长处的吸光值后,依据郎伯—比尔定律计算色价。桑椹色素的色价E1cm1%(λmax)为:E1cm1%(λmax)=色
茶多酚及提取工艺
茶多酚 学名:Camellia sinensis 简称:GTP 别名:茶鞣质、茶单宁 英文名:tea Polyphenol,简称TP 定义:是茶叶中儿茶素类、丙酮类、酚酸类和花色素类化合物的总称。 成分:可分为黄烷醇类、羟基-[4]-黄烷醇类、花色苷类、黄酮类、黄酮醇类和酚酸类等。其中以儿茶素最为重要,约占多酚类总量的60%-80%;儿茶素类主要由EGC、DLC、EC、EGCG、GCG、ECG等几种单体组成。茶多酚在茶叶中的含量一般在15%--20%。在茶多酚中各组成份中以黄烷醇类为主,黄烷醇类又以儿茶素类物质为主。儿茶素类物质的含量约占茶多酚总量的70%左右。茶多酚的理化性质 物理性状: 1 外观:棕黄、淡黄或淡黄绿色粉末。 2 性状:易溶于水及乙醇,味苦涩。 稳定性:在PH4-8 稳定。遇强碱、强酸、光照、高热及过渡金属易变质。最高耐热温度在1个半小时内,可达250℃左右,在三价铁离子下易分解。 安全性评价:无毒 茶多酚具有很强的抗氧化作用,其抗氧化能力是人工合成抗氧化剂BHT、BHA 的4-6倍,是VE的6-7倍,VC的5-10倍,且用量少:0.01-0.03%即可起作用,而无合成物的潜在毒副作用;儿茶素对食品中的色素和维生素类有保护作用,使食品在较长时间内保持原有色泽与营养水平,能有效防止食品、食用油类的腐败,并能消除异味 【药理作用】 1.具有很强的消除有害自由基的作用。 2.抗衰老作用。 3.抗辐射作用。 4.对癌细胞的抑制作用。 5.抗菌、杀菌作用。 6.对艾滋病病毒的抑制作用。 【主要用途】 实际上茶叶的许多作用都是因为茶叶中的茶多酚在起作用。茶多酚可用于食品保鲜防腐,无毒副作用,食用安全。茶叶能够保存较长的时间而不变质,这是其他的树叶、菜叶、花草所达不到的。茶多酚参入其他有机物(主要是食品)中,能够延长贮存期,防止食品退色,提高纤维素稳定性,有效保护食品各种营养成份。其主要用途如下:
红枣汁提取工艺优化开题分析报告
红枣汁提取工艺优化开题报告
————————————————————————————————作者:————————————————————————————————日期: 2
指导文件5: 吉林大学 毕业设计(论文)开题报告 生物与食品工程系(院)20 10 届 题目红枣汁提取工艺优化 课题类型应用研究课题来源自拟 学生姓名xxxx 学号200806050019 专业食品科学年级班08 本科 指导教师xxxx 职称教授 填写日期:2010 年1 月16 日
一、本课题研究的主要内容、目的和意义 1.目的和意义 中国枣的栽培始于七千年前,栽培历史至少已有3000年。最早的栽培中心在黄河中、下游的陕西、山西,渐及河南、河北、山东等地,到汉代,枣的栽培已遍及我国南北各地。安阳内黄是有名的枣乡,国家质检总局于09年同意批准对内黄大枣实施国家地理标志产品保护。内黄大枣品质优良,鲜食酸甜可口,干食甜香味长,是历代帝王贡品。目前,内黄大枣已发展到1万公顷,年产干枣4万吨,产值2.4亿元,种植面积和产量居河南省第一。 国内枣类产品目前还是以鲜食和干制为主,附加值较低,新鲜枣难以保藏;其它传统枣制品如蜜枣、焦枣、阿胶枣等缺乏创新,市场占有率不高,因此,如何开发新的枣类食品,提高枣的商业价值是目前的研究热点。枣奶、枣醋、枣酒等产品已有销售,但以枣汁和枣肉加工果冻类产品还较少见。 2.主要研究内容 枣汁提取工艺的优化 考察溶剂、温度、时间、pH等提取工艺条件对枣汁提取效果的影响。采用响应面试验优化枣汁提取工艺。对实验室优化后的工艺进行放大试验,使之适应工业化生产需要。 二、文献综述(国内外相关研究现况和发展趋向)
姜黄素不同提取方法比较研究
姜黄素不同提取方法比较研究 作者:陈雁虹,秦波,张媛媛,程伟,吕圭源,叶祖光【摘要】目的对5种提取姜黄素的不同方法进行比较。方法以各法提取所得的姜黄素含量与得膏率作为评价指标,优选姜黄素的提取工艺。结果80 V 乙 醇温浸提取姜黄素所得的含量最高,为姜黄素的优选提取工艺。结论该法提取 姜黄素含量高,操作简单,稳定可行。 【关键词】姜黄;姜黄素;提取方法 姜黄(Curcuma longa L.)来源于姜科植物姜黄的干燥根茎,主要产于我国四川、云南、广西、广东、福建、台湾等地。姜黄性温,味辛、苦,具有破血行气、通经止痛的作用,常用丁?胸胁刺痛、闭经、癥瘕、风湿肩臂疼痛、跌扑肿痛等 [1]。姜黄的化学成分包括姜黄素类化合物(curcumins)、萜类化合物(Terpenoids)、留醇类化合物(sterols)、糖类化合物(Carbohydrates)及微量 元素等。其中姜黄素类化合物主要包括姜黄素(curcumin)、去甲氧基姜黄素(demethoxy-curcumin)和双去甲氧基姜黄素(bisdemethoxycurmmin) [2]。姜黄素(C21H2006)为醇溶性二苯基庚烃类化合物,不溶于冷水,微溶丁?乙醚和苯,加热时溶于乙醇、乙二醇,易溶于冰醋酸和碱溶液。姜黄素在高温、强酸、强碱或强光环境中稳定性较差[3],因此提取温度不宜过高。目前,其主要提取方法有甲醇、乙醇有机溶剂提取法、碱水热提法、酶解提取法、外场辅助提取法
等,本实验选用碱水热提、酶解提取、乙醇回流提取、乙醇温浸提取、乙醇渗漉提 取5种方法,对各法提取所得的姜黄素含量与得膏率进行了考察比较,为姜黄素 的研究提供参考和依据。 1仪器与试药 FZ102微型植物试样粉碎机(北京市永光明医疗仪器厂);DZKW-S-4电热恒 温水浴锅(北京市永光明医疗仪器厂);DZF-6050真空干燥箱(上海一恒科技有 限公司);AB135-S电子分析天平(瑞士梅特勒-托利多公司);Agilent 1100高 效液相色谱仪(安捷伦科技有限公司)。 姜黄(购于北京人卫中药饮片厂,四川产);姜黄素对照品(中国药品生物制 品检定所,批号110823-200603);半纤维素酶(hemicellulase, Sigma);其他所 用试剂均为分析纯,HPLC分析所用试剂为色谱纯。 2 方法与结果 2. 1提取方法 2.1.1 姜黄碱水回流提取[2] 姜黄粉碎过40目筛,取50 g,加水,用1%氢氧化钠溶液调pH值至9. 2,丁-沸 水中提取3次,加水量分别为原药材重量的10、8、6倍。提取时间分别为60、54、 30 min。
食用明胶是由猪
食用明胶是由猪、牛、骡、马的皮子之角料,(其它动物皮除外)经除杂、消毒、蒸煮形成汁子,再经脱水、制造形成的胶条、胶片、粉粒状物(一般常用粉粒状胶)。 成分: (1)食用明胶是由猪、牛、骡、马的皮子之角料,(其它动物皮除外)经除杂、消毒、蒸煮形成汁子,再经脱水、制造形成的胶条、胶片、粉粒状物(一般常用粉粒状胶)。 (2)药用明胶是选用动物皮、骨和筋腱,经复杂的理化处理制得的无脂肪高蛋白易被人体吸收的高级胶品。具有粘度高、冻力高、易凝冻等物理特点。 特性: ⑴、药用明胶是选用动物皮、骨和筋腱,经复杂的理化处理制得的无脂肪高蛋白易被人体吸收的高级胶品。具有粘度高、冻力高、易凝冻等物理特点。外观为淡黄色至黄色细粒,应保持干燥、洁净、均匀,无夹杂物。应通过孔径4mm标准筛网。考试大论坛 ⑵、食用明胶为淡黄色至黄色细粒,应保持干燥、洁净、均匀,无夹杂物。本品是由猪、牛、骡、马的皮子之角料,(其它动物皮除外)经除杂、消毒、蒸煮形成汁子,再经脱水、制造形成的胶条、胶片、粉粒状物(一般常用粉粒状胶)。应通过孔径4mm标准筛网即5目。本品含有18种氨基酸和90%的胶原蛋白,富保健美容效果,具有优良的胶体保护性、表面活性、粘稠性、成膜性、悬乳性、缓冲性、浸润性、稳定性和水易溶性。 明胶是什么? 明胶(Gelatin-美式拼写或 gelatine-英式拼写)。 以新鲜牛皮和猪皮为原料,采用全套不锈钢设备,严格筛选鲜骨皮,通过反复洗浸、脱脂中和、蒸煮液化、灭菌过滤、浓缩烘干等几十道工序流水线制成。生产出的明胶为一种无味、无色(略带浅黄色)、半透明、坚硬的非晶态物,其不溶于有机溶剂,它吸水性强、粘度高,明胶是肽分子聚合物质,是胶原蛋白质的水解产物,所以可作为一种添加剂,我们生产的食用明胶因其具有许多独特的理化性能和较高的营养价值,富含人体必须的18种氨基酸,它可以直接制成浓汤、肉皮冻子、肉食罐头,水晶冻、色拉、蛋黄汁、糖霜、奶油糖、香味酱、巧克力、饮料、啤酒等供人们食用。工业明胶为无色至淡黄色透明或半透明等薄片或粉粒。无味,无臭。在冷水中吸水膨胀。广泛用于纺织、印刷、印染、塑料、电子、国防、航空,砂布砂纸、火柴、墨、橡胶填料、工艺品粘贴、木器家具、皮革上光、染织上浆、冶金镀液、纸钞涂质、化妆发胶、等工业和部门中。其中有用于提取水解动物蛋白质的低粘度低灰份的工业明胶还有专用于饲料添加剂的工业明胶。它的分子量为1-7万,高级明胶分子量在10-15万以内。明胶是一种含硫氨酸很低而内氨酸、甘氨酸、脯氨酸及羟脯氨酸等含量很高.明胶不易溶于冷水,但能吸收冷水的重量却是自身的5-10倍,易溶于温水,冷却形成凝胶,胶熔点在24-28°C之间,其溶解度与凝固温度相差很小,易受水份、温度、湿度的影响而变质。来源:考试大 从动物的胶原质中,通过部分酸法水解(A型),或者部分碱法水解(B型),甚至还可以通过酶解,提纯而获得的胶原蛋白。 除了一些犹太教的明胶是用琼脂做的以外,其它大部分都不是。一些全素的明胶替代品有: 瓜尔豆胶(guar gum)和菜胶(carrageenan)。只有一些“乳化剂”(emulsifiers)是纯素的。明胶用在摄影上,虽然已有技术来代替摄影胶片,但它目前的价格使它无法被接受。希望随着素食主义的发展这种情况能很快改变。 明胶(Gelatin)是胶原的水解产物,是一种无脂肪的高蛋白,且不含胆固醇,是一种天然营养型的食品增稠剂。食用后既不会使人发胖,也不会导致体力下降。明胶还是一种强有力
姜黄中姜黄素的提取工艺研究
姜黄中姜黄素的提取工艺研究
————————————————————————————————作者:————————————————————————————————日期:
姜黄中姜黄素的提取工艺研究-工程论文 姜黄中姜黄素的提取工艺研究 姜黄中姜黄素的提取工艺研究 Study of the Extraction Process of Curcumin in Curcuma 牛睿NIU Rui;韩宁娟HAN Ning-juan;方欢乐FANG Huan-le;许乐XU Le (西安培华学院,西安710125) (Xi′an Peihua University,Xi′an 710125,China) 摘要:从中药材姜黄中提取主要成分姜黄素的提取工艺及最优实验条件的研究,选择回流提取法及超声波提取法进行比较,得出最优提取方案。采用乙醇加热回流法、超声波提取法进行四因素三水平正交实验。结果显示提取条件为浓度65%乙醇,提取两次,药材倍数为5—10倍,提取时间2小时;超声功率40W,温度控制在室温,料液比1:15,提取时间45min,采用75%的甲醇作为溶剂时,姜黄素提取率较高。因此适宜的提取条件可提高姜黄素的提取量,简化实验操作,节省物料。 Abstract: This article studies the extraction technology of curcumin in curcuma and the optimal experimental conditions. The refluxing extraction method and ultrasonic extraction method are compared to get the optimal extracting solution. It adopts ethanol heating reflux method and ultrasonic extraction method for four factors three levels orthogonal experiment. Results show that the extraction conditions are: concentration 65% ethanol, twice extraction, medicinal herbs multiples
花青素提取(借鉴材料)
桑椹酒渣中花青素提取 1材料与方法 1.1材料 桑椹果酒酒渣。 1.2试剂药品 试验所用95%乙醇、浓盐酸、30%过氧化氢、Na2SO3等试剂均为分析纯。 1.3主要仪器 电子分析天平、分光光度计、旋转蒸发仪、酸度计、高速冷冻离心机、电热恒温水浴锅等。 1.4方法(稀HCl+95%乙醇提取) 样品称量,用提取剂提取,过滤(减压过滤/板框过滤),所得的提取液按一定比例稀释(pH1.0氯化钾缓冲液和pH4.5醋酸钠缓冲液稀)释后在分光光度计上测出OD值,以OD值代表桑椹红色素的含量。 1.4.1不同溶剂的吸光光谱及提取效果比较 分别以75%乙醇、85%乙醇、95%乙醇、0.05%稀HCl+95%乙醇(1:1)、0.10%稀HCl +95%乙醇(1:1)作为提取剂,以物料与提取剂之比1:10提取桑椹色素,提取液经3倍稀释后用分光光度计测定各提取液吸收光谱。 1.4.2不同物料与提取剂之比对花青素提取的影响(此时用提取效果最好的提取剂)。 1.4.3温度对提取效果的影响 以最佳结果作为桑椹提取剂,分别于60、50、40、30、20℃下提取1h。 1.4.4提取时间对提取效果的影响 每隔20分钟取样测得OD值。 1.4.5正交实验 1.4.6得率试验 称取一定量样品,经提取后。提取液经旋转蒸发仪蒸发,真空干燥,求得率。 方法一稀HCl+95%乙醇提取 1不同溶剂的吸光光谱及提取效果比较 固定浸提温度、提取时间、液料比,分别85%乙醇、95%乙醇、0.05%稀HCl+95%乙醇(1:1)、0.10%稀HCl +95%乙醇(1:1)、0.15%稀HCl +95%乙醇(1:1)为提取剂进行浸提试验,色 素提取液分别采用pH1.0氯化钾缓冲液和pH4.5醋酸钠缓冲液稀释一定倍数(吸光值在0.2~0.8之间),将稀释液静置15min,分别测定两种样品稀释液ODλmax和700nm处的吸光值A。按公式计算桑椹花色苷含量,分析提取溶剂对花色苷提取量的影响。 注:ODλmax的确定分别以85%乙醇、95%乙醇、0.05%稀HCl+95%乙醇(1:1)、0.10%稀HCl +95%乙醇(1:1)、0.15%稀HCl +95%乙醇(1:1)作为提取剂,以物料与提取剂之比1:10提取桑椹色素,提取液经3倍稀释后用分光光度计测定各提取液吸收光谱。 2不同物料与提取剂之比对花青素提取的影响(此时用提取效果最好的提取剂)。 分别称取2.0g酒渣,按液料比5、10、15、20、25、30加入相应体积的浸提溶剂,在40℃下避光提取2h后,抽滤、离心(3000rpm,10min)。取1mL清液,用pH 1.0和pH 4.5的缓冲溶液稀释(吸光值在0.2~0.8之间),分别测定两种样品稀释液在ODλmax和700nm处的吸光值A,按公式计算花色苷含量,并对液料比作图,分析液料比对色素提取量的影响。
多酚提取方法
1.1溶剂提取法 多酚就是多羟基化合物,它的结构特点决定多酚易溶或可溶于水、醇类、醚类、酮类、酯类等,所以,溶剂提取法主要有水溶剂提取与有机溶剂提取两种。水溶剂提取植物多酚类物质早90年代就有报道,该法由于工艺简便、成本低、纯度高而被广泛使用,但此法提取率低。有机溶剂提取就是利用多酚在不同溶剂中的溶解度不同进行回流提取,常用的溶剂有甲醇、乙醇、丙酮、乙酸乙酯等,此法可提高提取率、缩短反应时间。姚永志[2]等人在比较水溶剂及乙醇溶剂提取花生红衣多酚物质的研究中报道,当以水作溶剂提取花生红衣多酚物质时,最佳工艺:水浴温度40℃、液料比75、提取时间lh、提取率为6.41%,而乙醇作溶剂时最佳工艺:乙醇浓度55%、水浴温度60℃、提取时间0.5 h、料液比1:37.5,提取率达到7.858%。但有机溶剂成本高、回收困难,有毒易燃,不利于安全生产。 1.2微波辅助提取 微波辅助提取技术就是利用微波能来提高提取率的一种技术。在微波提取过程中,微波辐射能 够导致植物细胞内的极性物质吸收微波能,产生大量热量,使细胞内温度迅速上升,液态水汽化,从而使产生的压力在细胞膜与细胞壁上形成微小孔洞,使胞外溶剂可以进入细胞内溶解并释放出胞内物质,因此可以有效的提高产率,降低反应时间,减少溶剂的使用量。由于目前微波的设备比较普遍,因此,微波提取植物多酚的方法为更多的人所接受与使用。宋薇薇等[3]人用微波辅助法提取石榴皮多酚类化合物,确定了石榴皮多酚提取的最优工艺条件:40%(体积分数)乙醇作溶剂,料液比(g:m1)l:35,微波功率为242 W,提取时间60 s,提取三次,以该优化条件提取时,多酚粗提物得率26.52%,这个结果较贾冬英[43以20%(体积分数)乙醇作溶剂,料液比(g:mL)1:20,温度50℃,提取时间1 h,以该优化条件提取所得石榴多酚得率22.86%高,与醇提法相比,微波辅助提取能强化浸取过程,体系受热均匀,提取物中多酚含量高,提取时间较短等优点。 1.3超声波辅助提取 超声波辅助提取法就是利用超声波产生的强烈振动、高加速度、强烈的空化效应、搅拌作用等,可加速有效成分进入溶剂,从而提高提取率,缩短提取时间,并可避免高温对提出成分的影响。超声波提取的操作具有简便快捷、提取温度低、时间短、提取率高、提取物结构不易被破坏的特点.该法的缺点就是获得产品纯度不高。陶令霞c5]等人对苹果渣中多酚的超声辅助提取工艺条件进行了优化研究,确定最佳工艺条件为:70%乙醇,提取时间50 min,提取功率200 W,料液比1:15,提取温度35℃,提取2次,苹果多酚得率为4.29g/kg。同时,超声波辅助提取方法在荷叶多酚大麦多酚、以及诃子多酚中也有相应的报道。 1.4生物酶解提取 生物酶解提取技术就是根据酶反应具有高度专一性的特点,选择相应的酶,水解或降解细胞壁组成成分纤维素、半纤维素与果胶,从而破坏细胞壁结构,使细胞内的成分溶解、混悬或交溶于溶剂中,达到提取目的。酶法提取最大的优势就是反应条件温与。由于酶法提取就是在非有机溶剂下进行,所得产物纯度、稳定性、活性都较高,无污染,解决了有机溶剂提取法有机溶剂回收困难、用量大等缺点。此外,酶法提取在缩短提取时闻、降低能耗、降低提取成本等方面也具有一定优势[6]。刘军海等人[7]以低档绿茶为原料,采用复合酶法在较低温度下提取茶多酚。以单因素试验考察了酶用量、提取温度、提取时间及pH对茶多酚提取率的影响。通过正交试验优化并确定最佳提取工艺条件:酶用量为0.20%、提取温度为60℃、提取时间80 min、pH为4.6,在此工艺下茶多酚提取率为13.6%,其中儿茶素占茶叶干重的含量比沸水提取法高出 2.31%。1.5离子沉淀法离子沉淀法就是利用多酚能与金属离子络合生成沉淀,使其在浸提液中与其它物质分离而出,从而得到纯度较高多酚。目前常用金属离子有A13+、Zn2+、Fe2+、M92+、Ba2+、Ca2+等,其中A13+、Zn2+较为理想。离子沉淀法优点就是不使
紫杉醇提取工艺优化研究
紫杉醇提取工艺优化研究 赵万年 S1315004 立体依据 紫杉醇(Paclitaxel,商品名Taxol)是Wani等[1]于1971年首次从短叶红豆杉(Taxus Bravifolia Nutt.)中分离得到的一种复杂的次生代谢产物,属二萜类化合物。其抗癌机理独特[2],活性广谱高效,是目前所发现的惟一一种具有促进微管双聚体装配成微管, 使微管稳定, 从而阻碍细胞分裂, 将癌细胞停止在G2晚期或M期,最终导致癌细胞死亡[3],抑制肿瘤生长的作用。由于紫杉醇的作用机理独特、疗效显著,因此已用于转移性卵巢癌、乳腺癌等的治疗,对肺癌、大肠癌、黑色素瘤、头颈部癌、淋巴瘤、脑瘤也都有一定疗效。 虽然现在开发了多种紫杉醇的制备方法,利用半合成、全合成、生物合成、真菌发酵、植物组织细胞培养等技术手段获得紫杉醇的研究工作也取得了较大的进展[4-6],但是要实现这些技术的工艺扩大和工业放大生产还存在一些问题,而从树皮中提取紫杉醇的工艺已经成熟且工业化,因此目前从植物中直接提取分离仍是紫杉醇的主要制备方法。但是,紫杉醇在植物中的含量非常低(含量最高的红豆杉树皮也只有万分之几)[7],且类似物多,具有热敏性,产物在中间过程中易于分解、变性,不同产地、不同季节的植物资源成分相差甚远,因此分离提取工作难度很大。 目前紫杉醇的提取纯化工艺有溶剂萃取法、固相萃取法、制备色谱法、膜分离法、超临界萃取法、离子交换法、键合物解离法、药理作用靶点法和化学反应法[8-10]。这些工艺各有优缺点,其中溶剂萃取法和制备色谱法是最简单、最常用的方法,也已经成功应用于工业生产,但仍需改进。本课题以乙醇为提取溶剂,探求从南方红豆杉树叶中浸取紫杉醇的最佳提取条件,旨在为南方红豆杉这一药用植物资源的开发与利用提供试验依据。 研究目标 采用乙醇浸提方法,考查粉碎度、乙醇浓度、料液比、提取温度和提取时间
花青素提取实验论文
紫甘蓝中花青素的提取研究 【摘要】蓝花青素具有很强的抗氧化作用,具有清除体内自由基、过敏、保护 胃粘膜等多种功能,引起了国内外学者广泛关注。目前抗变异、抗肿瘤、抗,对花青素的研究主要集中于花青素的提取、分离纯化、热稳定性、抗氧化性及其生理功能等方面。本文主要研究了紫甘蓝花青素的提取工艺;用大孔树脂初步纯化紫甘蓝花青素;对紫甘蓝花青素纯度鉴定。采用“溶剂提取、萃取、树脂纯化、薄层色谱”相结合的方案对紫甘蓝花青素进行了分离纯化。 【关键词】紫甘蓝花青素提取分离纯化 1.1引言 花青素作为可使用色素之一,具有多种生物学作用,将广泛用于食品加工、医药保健品、化妆品行业。虽然国内外己开展了一些研究,主要集中在花青素粗品的提取方法的研究方面,而对紫甘蓝花青素的组成及分子结构鉴定、生物学活性、药理作用的研究还很少,还需要大量数据为其进一步开发和利用提供理论依据。 2.1材料与方法 2.1.1实验材料 新鲜紫甘蓝 2.1.2实验方法 溶剂提取、萃取、树脂纯化、薄层色谱 2.2主要仪器、试剂 分析天平、外分光光度计、环水式多用真空泵、心机、旋转蒸发仪、恒温水浴锅、无水乙醇、甲醇、孔树脂、浓盐酸。 2.3实验方法 2.3.1紫甘蓝色素的提取 取新鲜80G的紫甘蓝叶片于大杯中加入一定的浸提剂,吸取一定体积的浸提液于 1 Oml比色管中,用浸提剂稀释至刻度,用浸提剂做空白,测定其对520nm光的吸光度。采用溶剂提取法。称取紫甘蓝80g,用500ml的60%乙醇和1%盐酸混合液进行捣碎浸提8层纱布过滤,4℃条件下静置3h,离心测OD 值。 2.3.2紫甘蓝色素的初步纯化 大孔树脂预处理的方法:将待处理的大孔树脂装入柱中,用95%乙醇浸泡24h一用95%乙醇2}4BV冲洗一用去离子水洗至无醇味一5%氢氧化钠溶液2}4BV冲洗树脂柱一水洗至中性一10%乙酸2}4BV冲洗通过树脂柱一水洗至中性,备用。滤液用5倍的纯水稀释,大孔吸附树脂法分离,往吸附柱中先用15%乙醇除杂,再用60%乙醇洗脱收集洗脱液;用四分之一的盐酸在90℃条件
食品添加剂明胶的提取步骤介绍
食品添加剂明胶的提取步骤介绍 2020年8月17日
明胶以新鲜牛皮和猪皮为原料,采用全套不锈钢设备,严格筛选鲜骨皮,通过反复洗浸、脱脂中和、蒸煮液化、灭菌过滤、浓缩烘干等几十道工序流水线制成。下面,就具体的为大家介绍一下食品添加剂明胶的提取步骤。 提取:将明胶提取物与清水混合,然后通过加热至65℃-75℃保持6小时,将胶原蛋白水解。 过滤:提取出明胶液后,通过棉浆垫过滤胶化液体。过滤速度为每小时约5000L溶液。温度应保持在50℃以上。 离子交换:通过阳离子和阴离子交换剂去除凝胶化的液体。温度应保持在50℃以上,解离时间为约30分钟。 超滤和消毒:在60℃的操作温度下将稀液浓缩5?8%,脱泡时间约30分钟。超滤后,在超过138℃下消毒4秒钟。 蒸发明胶液:该过程通过使用蒸发器除去液体中的大部分水分。温度保持55-70℃。 冷冻:浓缩的胶原蛋白液通过冷却在凝结器中,挤压出面条状的明胶条,处理时间约10分钟。 干燥:将明胶面条用带式干燥器通过空气干燥。干燥的未调味的明胶具有约14%的含水量。温度保持35-40℃。干燥时间为约2小时。
冲洗:破碎的面条输送到粉碎机,其产生10至60目的粉末。 以上就是小编为大家介绍的食品添加剂明胶的提取步骤,希望对大家能够有所帮助,德兰梅勒利用膜分离技术为生物制药、食品饮料、发酵行业、农产品深加工、植物提取、石油石化、环保水处理、空气除尘、化工等行业提供分离、纯化、浓缩的综合解决方案,满足不同客户的高度差异化需求。帮助客户进行生产工艺的上下游技术整合与创新,帮助企业节省投资、降低运行费用、减少单位消耗、提供产品质量、清洁生产环境,助力企业产业升级。
影响姜黄中姜黄素提取因素分析研究
影响姜黄中姜黄素因素的研究 摘要 以总姜黄素含量为考察指标,采用正交优化乙醇法提取姜黄中姜黄素,用分光光度法对姜黄素提取液总姜黄素含量进行检测。考察了料液比、浸提时间、温度、乙醇浓度等因素对提取量的影响。 关键词姜黄素姜黄提取 1.前言 姜黄为姜科姜黄属植物姜黄的根茎。姜黄素是从姜科植物姜黄中提取的一种色素,也存在其它姜科植物中。姜黄素不仅是一种优良的天然食用色素,而且还具有十分广泛的药用价值,现发现姜黄素具有利胆、降血脂、抗病毒、抗炎、抗氧化、抗肿瘤、防止衰老和延年益寿的作用。因此,研究姜黄中有效成分提取技术具有重要的现实意义。提取工艺的方法有很多,但存在着操作过程复杂、pH 值对有效成份的影响大、不易控制和不宜工业化大生产等缺点。 2.实验目的 研究以固液比、浸提时间、温度、乙醇浓度等因素对提取姜黄中总姜黄素的影响,确定正交实验考查范围,筛选出了优化工艺条件。 3.实验原理 姜黄素为橙黄色结晶粉末,味稍苦。不溶于水,溶于乙醇、丙二醇,易溶于冰醋酸和碱溶液,对光、热、铁离子敏感,耐光性、耐热性、耐铁离子性较差。通过改变固液比、浸提时间、温度、乙醇浓度等因素,探究姜黄中总姜黄素主要由什么影响。 4.实验器材 紫外可见分光光度计、1ml移液管、热恒温水浴锅、分析天平、离心机,50ml的容量瓶6个,250ml容量瓶一个,玻璃棒。 5、实验材料及试剂 5. 1实验试剂及其配制 30%的乙醇溶液:准确量取95%的无水乙醇15.8ml,加水定容至50ml. 40%的乙醇溶液:准确量取95%的无水乙醇21.1ml,加水定容至50ml. 50%的乙醇溶液:准确量取95%的无水乙醇26.3ml,加水定容至50ml.
明胶的生产工艺
明胶的具体生产方法有4种:即碱法、酸法、盐碱法和酶法等。国内外普遍使用的是碱法生产。现将工艺过程叙述如下: 原料整理:将不同种类的原料进行分类整理,如牛皮与猪皮;湿皮与干皮等应分开,拣出不合规格的皮另行处理。带毛皮可用5%石灰乳或0.5~1%的硫化溶液浸泡,将毛脱去。鲜猪皮的脂肪层应刮去。干皮要泡在清水中浸软。 石灰水预浸:将整理好的皮原料放入1%左右的石灰水中浸渍1~2d,然后切成小块。 水力除污:将皮块与水连续地加入水力除脂机内,利用水力的冲击作用和高速铁锤的机械作用,清洗除脂肪和污物。 石灰水浸渍:将去脂的皮块放入浸渍池中,用2~4%的石灰水(比重1.015~1.035)浸渍。湿皮与水的比例为1: 3~4,pH值为12.0~12.5。温度最好在15℃,时间为15—90d。气温高时石灰水浓度可低些,气温低时其浓度可增大。此工序称“发皮”;是明胶生产的关键工序之一。 洗涤中和:待皮块膨胀后,捞出用水充分洗涤,经过多次洗涤,最后pH 为9.0~9.5.洗涤后,用酸中和剩余的石灰,先加水使原料浸没,在不断搅拌下用水洗净,一般需8~12h内完成。 熬胶浓缩:先在胶锅内放入热水,然后将原料倒入,注意不要让皮块粘结成团,同时缓慢升温至55~65℃,热浸6~8h后放出胶汁;再向锅内加入热水,使水温较前次提高5~100℃继续熬胶,依此类推,进行多次,每次温度也相应地逐步升高,最后一次可以煮沸。 将所得稀胶汁在600℃左右用过了滤棉、活性炭或硅藻土等作助滤剂,以板框式压滤机过滤,得澄清胶液,胶液再用离心机分离,进一步除去油脂等杂质。 再将胶液放入减压浓缩罐中,控制温度65~700℃进行蒸发浓缩,当胶液变浓时,可改为60~650℃继续减压浓缩。根据胶液质量和干燥设备条件掌握胶液浓缩的浓度,如用冷热风空调干燥时,胶液浓度比重1.050~1.080(500℃)含胶量为23~33%即可。 凝胶干燥,经浓缩的胶液,乘热加入一定量的过氧化氢·亚硫酸或尼泊金,既漂白又防腐。将浓胶液在滴在冷辊上,即形成细细的胶条,在刮在容器内运到烘床上烘干。以冷热风干燥至凝胶水分为10~12℃时,再经粉碎即为成品。亦有将浓胶液滴于滚筒后,干燥即得半圆球形胶粒。
姜黄素地提取实用工艺研究
毕业设计(论文)题目:姜黄素的提取工艺研究 教学院:化学与材料工程学院 专业名称:化学工程与工艺(生物化工) 学号: 201040810132 学生姓名:温小龙 指导教师:刘颋老师
2014年 5 月 12 日
摘要 本次姜黄素提取的研究采用的是有机溶剂法和超声波辅助法。有机溶剂用的是乙醇,利用乙醇从姜黄中提取姜黄素具有工业成本低、提取效率高的特点,研究得出乙醇提取姜黄素影响的主要因素有时间、浓度、料液比和温度。超声波辅助法提取姜黄素具有操作简单,提取效率高等特点,研究得出影响提取率的因素有乙醇浓度、时间和功率。 在单因素实验基础上得出,乙醇浸提的浓度最佳为70%,温度为60℃,料液比为1:20;超声波辅助法的最佳功率为300W,时间为40min,乙醇浓度为80%。 关键词:姜黄素;乙醇浸提;超声波提取
Abstract The curcumin extract research uses organic solvent method and ultrasonic assisted https://www.wendangku.net/doc/1318911384.html,anic solvent is ethanol. The use of ethanol extract of curcumin from turmeric has the characteristics of the industry of low cost, high extraction efficiency, the main factors that affected ethanol extraction of curcumin included concentration, the ratio of material to solvent and temperature.Ultrasonic assisted extraction of curcumin method has simple operation, high extraction efficiency etc. the research indicated that the factors affected extraction included ethanol concentration, time and power. On the basis of single factor experiment,the best concentration and temperature of ethanol extraction are 70% and 60℃,and the ratio of material to solvent is 1:20. The best power and time of ultrasonic assisted method are 300W and 60min ,and the ethanol concentration is 80%. Keywords: curcumin; ethanol extraction; ultrasonic assisted method to extraction
(推荐)多酚提取方法
1.1溶剂提取法 多酚是多羟基化合物,它的结构特点决定多酚易溶或可溶于水、醇类、醚类、酮类、酯类等,所以,溶剂提取法主要有水溶剂提取和有机溶剂提取两种。水溶剂提取植物多酚类物质早90年代就有报道,该法由于工艺简便、成本低、纯度高而被广泛使用,但此法提取率低。有机溶剂提取是利用多酚在不同溶剂中的溶解度不同进行回流提取,常用的溶剂有甲醇、乙醇、丙酮、乙酸乙酯等,此法可提高提取率、缩短反应时间。姚永志[2]等人在比较水溶剂及乙醇溶剂提取花生红衣多酚物质的研究中报道,当以水作溶剂提取花生红衣多酚物质时,最佳工艺:水浴温度40℃、液料比75、提取时间lh、提取率为6.41%,而乙醇作溶剂时最佳工艺:乙醇浓度55%、水浴温度60℃、提取时间0.5 h、料液比1:37.5,提取率达到7.858%。但有机溶剂成本高、回收困难,有毒易燃,不利于安全生产。 1.2微波辅助提取 微波辅助提取技术是利用微波能来提高提取率的一种技术。在微波提取过程中,微波辐射能够导致植物细胞内的极性物质吸收微波能,产生大量热量,使细胞内温度迅速上升,液态水汽化,从而使产生的压力在细胞膜和细胞壁上形成微小孔洞,使胞外溶剂可以进入细胞内溶解并释放出胞内物质,因此可以有效的提高产率,降低反应时间,减少溶剂的使用量。由于目前微波的设备比较普遍,因此,微波提取植物多酚的方法为更多的人所接受和使用。宋薇薇等[3]人用微波辅助法提取石榴皮多酚类化合物,确定了石榴皮多酚提取的最优工艺条件:40%(体积分数)乙醇作溶剂,料液比(g:m1)l:35,微波功率为242 W,提取时间60 s,提取三次,以该优化条件提取时,多酚粗提物得率26.52%,这个结果较贾冬英[43以20%(体积分数)乙醇作溶剂,料液比(g:mL)1:20,温度50℃,提取时间1 h,以该优化条件提取所得石榴多酚得率22.86%高,与醇提法相比,微波辅助提取能强化浸取过程,体系受热均匀,提取物中多酚含量高,提取时间较短等优点。 1.3超声波辅助提取 超声波辅助提取法是利用超声波产生的强烈振动、高加速度、强烈的空化效应、搅拌作用等,可加速有效成分进入溶剂,从而提高提取率,缩短提取时间,并可避免高温对提出成分的影响。超声波提取的操作具有简便快捷、提取温度低、时间短、提取率高、提取物结构不易被破坏的特点.该法的缺点是获得产品纯度不高。陶令霞c5]等人对苹果渣中多酚的超声辅助提取工艺条件进行了优化研究,确定最佳工艺条件为:70%乙醇,提取时间50 min,提取功率200 W,料液比1:15,提取温度35℃,提取2次,苹果多酚得率为4.29g/kg。同时,超声波辅助提取方法在荷叶多酚大麦多酚、以及诃子多酚中也有相应的报道。 1.4生物酶解提取 生物酶解提取技术是根据酶反应具有高度专一性的特点,选择相应的酶,水解或降解细胞壁组成成分纤维素、半纤维素和果胶,从而破坏细胞壁结构,使细胞内的成分溶解、混悬或交溶于溶剂中,达到提取目的。酶法提取最大的优势是反应条件温和。由于酶法提取是在非有机溶剂下进行,所得产物纯度、稳定性、活性都较高,无污染,解决了有机溶剂提取法有机溶剂回收困难、用量大等缺点。此外,酶法提取在缩短提取时闻、降低能耗、降低提取成本等方面也具有一定优势[6]。刘军海等人[7]以低档绿茶为原料,采用复合酶法在较低温度下提取茶多酚。以单因素试验考察了酶用量、提取温度、提取时间及pH对茶多酚提取率的影响。通过正交试验优化并确定最佳提取工艺条件:酶用量为0.20%、提取温度为60℃、提取时间80 min、pH为4.6,在此工艺下茶多酚提取率为13.6%,其中儿茶素占茶叶干重的含量比沸水提取法高出2.31%。1.5离子沉淀法离子沉淀法是利用多酚能与金属离子络合生成沉淀,使其在浸提液中与其它物质分离而出,从而得到纯度较高多酚。目前常用金属离子有A13+、Zn2+、Fe2+、M92+、Ba2+、Ca2+等,其中A13+、Zn2+较为理想。离子沉淀法优点是不使用大量有机溶剂,工艺较简单,生产安全性好,在一定程度上可降低能耗,部分
明胶提纯工艺
明胶提纯工艺 北京希涛技术开发有限公司 、
明胶小试验使用说明书 一、明胶-1号、明胶-2号的配制方法 1.明胶-1号配制浓度:10‰ 2.明胶-2号配制浓度:10‰ 3.具体溶解方法:先取100ml水放在烧杯中,用搅拌器搅动使水旋转起来,将1g明胶-1号、明胶-2号干粉分别缓慢均匀加入水中,注意防止加在杯壁上,搅拌10-20分钟,使其完全溶解。 二、实际操作 1.取待处理明胶液100ml,先加入0.5g活性白土搅拌均匀。 2.再加入10‰浓度的明胶-1号溶液2-3ml,搅拌2-3分钟后,观察明胶液内形成的絮团是否均匀悬浮,如否,搅拌至使其均匀悬浮; 3.最后加入10‰浓度的明胶-2号溶液1-2ml,先以较快的搅拌速度使其混合均匀,然后缓慢搅拌,搅拌1-2分钟,慢慢就能看到清澈的上清液。 三、最终现象 被提纯的明胶液上清液呈淡黄色透明油状液体,在底部形成少量较大柔软的絮团。透明度能达200mm;其它各种杂质含量比处理前降低许多,使明胶的质量大幅度提高。 四、实验室投加量生产车间投加量换算公式 a×1% = c (g/t) b×1‰×1‰ 式中代号: a:小试投加量单位:ml b:胶水量单位:ml c:生产投加量单位:g/t
明胶提纯工艺当中流程及使用 一、配药 1.明胶-1号、明胶-2号均配成10‰浓度的水溶液。 2.小包装打开后应尽早配成水溶液,干粉易吸潮将给配制带来不便。 3.配药时应将药粉均匀分散抖在进水瀑布上,并同时搅拌溶液防止起团。 4.干粉放完后应继续搅拌20分钟以上,使其充分溶解。 5.水溶液理论上保持七天,尽量三天用完 二、操作 要求:明胶温度60°C,均匀充分搅拌起来 1.先加入活性白土,投加量为公斤/吨胶水 2.搅拌3-5分钟加入1号 3.观察所起絮团大小、稠稀、均匀等 4.当絮团均匀、很稀、悬浮、无丝时加入2号 5.颜色变浅黄色并迅速下沉,悬浮物较少,无丝即可 三、明胶提纯的现象及处理方法
花青素的提取_分离以及纯化方法研究进展
2008年第34卷第8期(总第248期) 111 花青素的提取、分离以及纯化方法研究进展3 孙建霞,张 燕,胡小松,吴继红,廖小军 (中国农业大学,教育部果蔬加工工程研究中心,北京,100083) 摘 要 花青素是一种存在于自然界的水溶性多酚类化合物,现已发现其具有多种功能。有关花青素的提取、分离和纯化研究报道很多,文中就近年来国内外相关方面的研究进展进行了分析。关键词 花青素,提取,分离,纯化 花青素(ant hocyanins )又称花色素,是一类广泛 存在于植物中的水溶性天然色素,多以糖苷的形式存在,也称花色苷。最早而最丰富的花青素是从红葡萄渣中提取的葡萄皮红,它于1879年在意大利上市。花青素的结构母核是22苯基苯并吡喃阳离子,属于类黄酮化合物。自然界已知的花青素有22大类,食品中重要的有6类,即矢车菊色素(cyanindin ,Cy )、天竺葵色素(pelargonidin ,Pg )、飞燕草色素(delp hin 2 idin ,Dp )、芍药色素(peonidin ,Pn )、牵牛色素(pet u 2nidin ,Pt )和锦葵色素(malvidin ,Mv )[1],其结构如图1所示。它们在植物可食部分的分布比例分别为50%、12%、12%、12%、7%和7%。花青素广泛存在 于开花植物(被子植物)的花、果实、茎、叶、根器官的 细胞液中,分布于27个科,72个属的植物中[2]。其中尤以葡萄皮、阿龙尼亚苦味果、黑醋栗、草莓、树莓、越橘等含量最为丰富。 图1 食品中几种重要的花青素结构 第一作者:博士研究生(廖小军教授为通讯作者)。 3国家自然科学基金项目(30771511),国家“十一五”支撑计划(2006BAD27B03),国家863计划(2007AA100405)资助 收稿日期:2008-04-24,改回日期:2008-06-13 自然条件下游离的花青素极少见,常与一个或多 个葡萄糖(gluco se )、鼠李糖(rhamnose )、半乳糖(ga 2lactose )、木糖(xylo se )、阿拉伯糖(arabinose )等通过 糖苷键连接形成花青素,花青素中的糖苷基和羟基还可以与一个或几个分子的香豆酸、阿魏酸、咖啡酸、对羟基苯甲酸等芳香酸和脂肪酸通过酯键形成酰基化的花青素[1]。 目前国内外有关花青素的研究主要集中在花青 素资源分布的评价与资源库的建立、花青素的定性与定量方法学研究、花青素的生理活性与功能研究、花青素的高效提取与绿色分离技术研究、花青素的结构稳定性与分子降解机制研究、花青素的应用与产品开发研究6个方面,这些内容的深入研究有利于进一步合理利用与开发自然界中丰富的花青素资源。本文重点就近年来国内外学者对花青素提取、分离和纯化方法的最新研究进行了分析总结。
