第3章 化学热力学基础

3.15
2mol Hg(l)在沸点温度(630K)蒸发过程中所吸收的热量为109.12kJ。则汞的标准摩尔蒸发热ΔvapHm=(54.46)kJ ;该过程中对环境做功W=(10.48kJ),ΔU=(98.64kJ),ΔS=(173.2J·K-1),ΔG=(0)
3.16
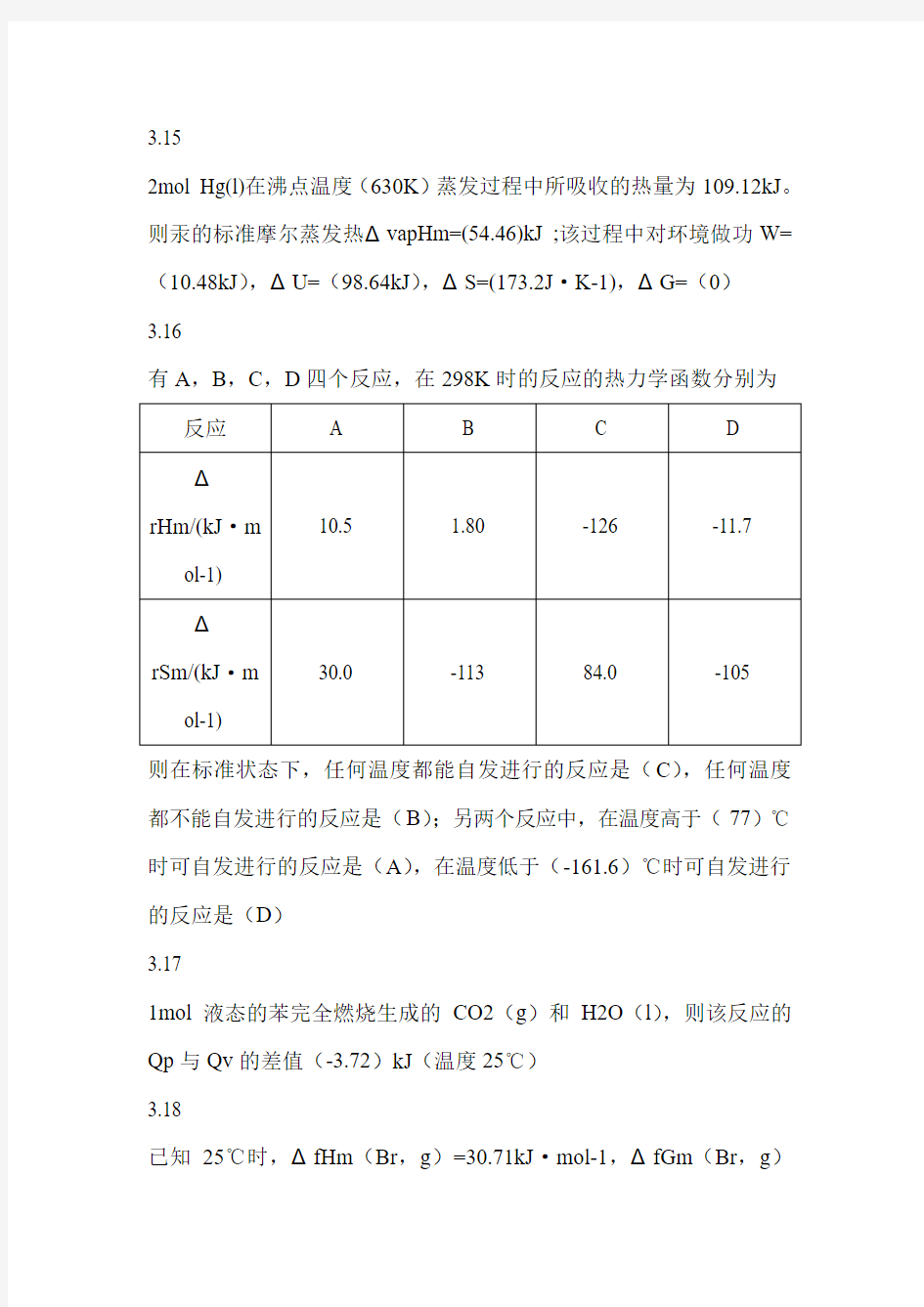
有A,B,C,D四个反应,在298K时的反应的热力学函数分别为反应 A B C D
Δ
10.5 1.80 -126 -11.7 rHm/(kJ·m
ol-1)
Δ
30.0 -113 84.0 -105 rSm/(kJ·m
ol-1)
则在标准状态下,任何温度都能自发进行的反应是(C),任何温度都不能自发进行的反应是(B);另两个反应中,在温度高于(77)℃时可自发进行的反应是(A),在温度低于(-161.6)℃时可自发进行的反应是(D)
3.17
1mol液态的苯完全燃烧生成的CO2(g)和H2O(l),则该反应的Qp与Qv的差值(-3.72)kJ(温度25℃)
3.18
已知25℃时,ΔfHm(Br,g)=30.71kJ·mol-1,ΔfGm(Br,g)
=3.14kJ·mol-1,则Br2(l)的标准摩尔蒸发熵为(92.52)J·mol-1·K-1,正常沸点为(58.93)℃
3.19
反应2HgO(s)===2Hg(l)+O2(g)ΔrHm=181.4kJ·mol-1,则ΔfHm(HgO,s)=(-90.7kJ·mol-1)。已知Ar(Hg)=201,生成1gHg(l)的焓变是(0.451)kJ
3.20
已知反应CaCO3(s)===CaO(s)+CO2(g)在298K时ΔrGm=130kJ·mol-1,1200K时ΔrGm=-15.3kJ·mol-1,则该反应的ΔrHm 为(161J·mol-1·K-1)
3.21
将下列物质按摩尔熵值由小到大排列,其顺序为
Li(s) 3.22 在25℃时,NaCl在水中的溶解度为6mol·dm-3,在此温度下,若将100gNaCl置于500g水中,则NaCl溶解过程中ΔrG(<)0,ΔrS(>)0 3.23 若3mol理想气体向真空膨胀,该过程的Q,W,ΔU,ΔH,ΔS,ΔG中不为零的是(ΔS,ΔG) 第三章 化学平衡热力学原理 复习思考题 1.化学反应的m r G ?与Θ?m r G 有什么不同?用m r G ?及Θ ?m r G 判断化学反应进行的方向有什 么不同? 2.“Θ Θ -=?K RT G ln m r ,可见Θ ?m r G 就是反应处于平衡时的吉布斯自由能变化。”这种说 法对吗?为什么? 3.平衡常数改变了,平衡是否移动?平衡发生了移动,平衡常数是否改变? 4.什么是标准平衡常数ΘK ?“标准平衡常数数值上总是等于1”的说法对吗? Θ K 值能否 根据某温度、任一压强下反应达平衡时各气体的分压按 ∏B B ν p 计算? 5.对于一个化学反应,当人为地改变反应体系中各反应物及生成物所取的标准状态时,反 应的m r G ?Δ、Θ ?m r G 及Θ K 有无变化?为什么? 6.为什么有纯凝聚相参加的反应其平衡数表示式中没有凝聚相物质的平衡分压出现? 7.下列碳的不完全燃烧反应为: 2C(s)+O2(g)==== 2CO(g) Θ?m r G =(-232 600-167.8 T)J ·mol -1 当升高温度时, Θ ?m r G 变得更负,从而使Θ K 更大,反应就更完全,对吗? 8.在H 2S 气体中加入较多的NH 3,体系中可有下列二反应进行: ① NH3(g)+H2S(g)==== NH4HS(g) ② NH3(g)+H2S(g)==== NH4HS(s) 当达到平衡时,二反应的Θ ?m r G 、m r G ?是否相等? 9.CO2(g)+C(s)==== 2CO(g)反应是气体物质的量增加的反应,反应向右进行时,压强会增大。这就不是恒温恒压条件下的反应了,是否还能用等温方程式计算m r G ?并用以判定反应的方向呢? 10.在相同温度下,下列两反应的平衡常数是否相同?([C]表示溶解在铁液中的碳) C(石墨)+CO 2(g)==== 2CO(g) [C]+CO 2(g)==== 2CO(g) 11.工业上制取水煤气的反应为:C(s)+H2O(g)==== CO(g)+H2(g) 已知Θ ?m r H =133.5 kJ ·mol -1 ,设在673 K 时达到平衡,试讨论下列因素对平衡的影响: ①提高反应温度;②增加体系的总压;③增加水蒸气的分压;④增加碳的数量;⑤加N 2气。 12.已知一理想气体化学反应:A(g)==== 2B(g),在298.15 K ,Θ p K =0.027,试问: 第三章化学热力学 (g) + O2(g) ?H2O(l)(298K)的Q p与Q V之差(kJ·mol-1)是………………………() (A)(B) (C)(D) 2.已知HCN(aq)与NaOH(aq)反应,其中和热是kJ·mol-1,H+(aq) + OH-(aq) = H2O(l),= kJ·mol-1,则1 mol HCN 在溶液中电离的热效应(kJ·mol-1)是……………() (A)(B) (C)(D) 3.已知2PbS(s) + 3O2(g) = 2PbO(s) + 2SO2(g) ,= kJ·mol-1 ,则该反应的Q V值是…………………………………………………………………………() (A)(B) (C)(D) 4.如果体系经过一系列变化,最后又变到初始状态,则体系的………………………() (A)Q = 0 W = 0 ΔU = 0 ΔH = 0 (B)Q 0 W 0 ΔU = 0 ΔH = Q (C)Q = WΔU = Q - WΔH = 0 (D)Q WΔU = Q - WΔH = 5.在一定温度下:(1) C(石墨) + O2(g) = CO2(g) ΔH1 ;(2) C(金刚石) + O2(g) = CO2(g) ΔH2;(3) C(石墨) = C(金刚石) ΔH3 = kJ·mol-1,其中ΔH1和ΔH2的关系是…………………………………………………………………() (A)ΔH1>ΔH2(B)ΔH1<ΔH2 (C)ΔH1=ΔH2(D)不能判断 6.若两个液态组分混合形成理想溶液,则混合过程的…………………………………( (A)ΔV = 0 ΔH = 0 ΔS = 0 ΔG = 0(B)ΔV > 0 ΔH < 0 ΔS < 0 ΔG > 0 (C)ΔH = 0 ΔV = 0 ΔS > 0 ΔG < 0 (D)ΔH > 0 ΔV < 0 ΔG< 0 ΔS > 0 第一章 化学热力学基础 公式总结 1.体积功 We = -Pe △V 2.热力学第一定律的数学表达式 △U = Q + W 3.n mol 理想气体的定温膨胀过程 .定温可逆时: Wmax=-Wmin= 4.焓定义式 H = U + PV 在封闭体系中,W ′= 0,体系发生一定容过程 Qv = △U 在封闭体系中,W ′= 0,体系发生一定压过程 Qp = H2 – H1 = △H 5.摩尔热容 Cm ( J·K-1·mol-1 ): 定容热容 CV (适用条件 :封闭体系、无相变、无化学变化、 W ′=0 定容过程 适用对象 : 任意的气体、液体、固体物质 ) 定压热容 Cp ?=?2 1 ,T T m p dT nC H (适用条件 :封闭体系、无相变、无化学变化、 W ′=0 的定压过程 适用对象 : 任意的气体、液体、固体物质 ) 单原子理想气体: Cv,m = 1.5R , Cp,m = 2.5R 双原子理想气体: Cv,m = 2.5R , Cp,m = 3.5R 多原子理想气体: Cv,m = 3R , Cp,m = 4R 1 221ln ln P P nRT V V nRT =n C C m = ?=?2 1 ,T T m V dT nC U Cp,m = Cv,m + R 6.理想气体热力学过程ΔU 、ΔH 、Q 、W 和ΔS 的总结 7.定义:△fHm θ(kJ·mol-1)-- 标准摩尔生成焓 △H —焓变; △rHm —反应的摩尔焓变 △rHm θ—298K 时反应的标准摩尔焓变; △fHm θ(B)—298K 时物质B 的标准摩尔生成焓; △cHm θ(B) —298K 时物质B 的标准摩尔燃烧焓。 8.热效应的计算 由物质的标准摩尔生成焓计算反应的标准摩尔焓变 △rH θm = ∑νB △fH θm ,B 由物质的标准摩尔燃烧焓计算反应的标准摩尔焓变 △rH θm = -∑νB △cH θm ,B 9.Kirchhoff (基尔霍夫) 方程 △rHm (T2) = △rHm (T1) + 如果 ΔCp 为常数,则 △rHm (T2) = △rHm (T1) + △Cp ( T2 - T1) 10.热机的效率为 对于卡诺热机 12 11Q Q Q Q W R +=- =η dT C p T T ? ?2 1 1 2 1211Q Q Q Q Q Q W +=+=-=η121T T T -= 第一章 化学热力学基础 1-1 气体体积功的计算式 dV P W e ?-= 中,为什么要用环境的压力e P ?在什么 情况下可用体系的压力体P ? 答: 在体系发生定压变化过程时,气体体积功的计算式 dV P W e ?-= 中, 可用体系的压力体P 代替e P 。 1-2 298K 时,5mol 的理想气体,在(1)定温可逆膨胀为原体积的 2 倍; ( 2 ) 定压下加热到373K ;(3)定容下加热到373K 。已知 C v,m = 28.28J·mol -1·K -1。 计算三过程的Q 、W 、△U 、△H 和△S 。 解 (1) △U = △H = 0 kJ V V nRT W Q 587.82ln 298314.85ln 1 2 =??==-= 11 2 82.282ln 314.85ln -?=?==?K J V V nR S (2) kJ nC Q H m P P 72.13)298373(,=-==? kJ nC U m V 61.10)298373(,=-=? W = △U – Q P = - 3.12 kJ 112,07.41298 373ln )314.828.28(5ln -?=+?==?K J T T nC S m P (3) kJ nC Q U m V V 61.10)298373(,=-==? kJ nC H m P 72.13)298373(,=-=? W = 0 112,74.31298 373ln 28.285ln -?=?==?K J T T nC S m V 1-3 容器内有理想气体,n=2mol , P=10P θ,T=300K 。求 (1) 在空气中膨胀了1dm 3, 做功多少? (2) 膨胀到容器内压力为 lP θ,做了多少功?(3)膨胀时外压总比气体的压力小 dP , 问容器内气体压力降到 lP θ时,气体做多少功? W f dl p A dl p dV δ=-?=-??=-?外外外 第3章 化学热力学初步 自测题 一、是非题: 1. 内能△U 的改变值,可通过测定Q 和W 算出。由于内能是状态函数。因此。热和功也是状态函数。 2 .热力学第一定律的数学表示式△U=Q+W 适用于包括电功的一切宏观变化。 3. 由于反应热的单位是KJ/mol ,所以反应式配平系数不同,该反应的反应热也不同。 4. 反应的热效应就是反应的焓变。 5. 凡是体系的温度升高,就一定吸热;而温度不变,体系既不吸热,也不放热。 6. 如果某反应的△r G θ > 0,则该反应不一定不能自发进行。 7. 任何一个反应不论在什么条件下进行,则该反应的△r G θ总是等于生成物的标准生成自由能之和减去反应物标准生成自由能之和。 8. 设计出来的某反应,如果△r G > 0,则表示这个反应无论如何是无法进行的。 9. 如果一反应△r H θ和△r S θ都是负值,表示这个反应无论如何是无法进行的。 10. 化学反应的发生常伴有热效应,通常放热反应都是自发的。 11. 自发反应一定是快反应,不能自发进行的反应就是不能发生的反应。 二、选择题: 1.如果某一体系从状态A 变到状态B 有两种途径:一种是经C 到B 状态;另一种是经D 到E ,最后到B 状态。体系内能的改变值为( ) A.△U > 0; B.△U<0; C.△U = 0 D.△U = U B - U A . 2. 在下列反应中,Q p =Q v 的反应为( ) A. CaCO 3(s) →CaO(s)+CO 2(g) B. N 2(g)+3H 2(g) →2NH 3(g) C. C(s)+O 2(g) →CO 2(g) D. 2H 2(g)+O 2(g) →2H 2O (l ) 3.下列有关热效应的正确说法是( ) A.石墨始终在298K 温度下燃烧放出的热量; B.石墨燃烧后,使CO 2的温度恢复到石墨燃烧时的起始温度,并只做体积功; C.石墨与CO 2在燃烧温度时的热效应; D.其焓变值是人为规定的。 4. 下列各反应的θ?m rH (298)值中,恰为化合物标准摩尔生成焓的是( ) A. 2H (g)+ 1/2O 2(g)→H 2O (l ) B. 2H 2(g)+O 2(g)→2H 2O (l ) C. N 2(g)+3H 2(g)→2NH 3(g) D. 1/2N 2(g) +3/2H 2(g)→NH 3(g) 5. 环境对系统作10kJ 的功,而系统失去5kJ 的热量给环境,则系统的内能变化为 ( ) A. -15kJ B. 5kJ C. -5kJ D. 15kJ 6.如果X 是原子,X 2是实际存在的分子,反应 X 2(g) ━━ 2X(g)的△r H 应该是( ) A.负值 B.正值 C.零 D.不一定 7.下列哪一种物质的标准生成自由能为零? ( ) A.Br 2(g) B. Br -(aq) C.Br 2(l) D.Br 2(aq) 8.室温下,下列哪一正向反应熵变数值最大?(不必查表)( ) A.CO 2(g)→ C(s) + O 2(g) B.2SO 3(g) → 2SO 2(g) + O 2(g) C.CaSO 4·2H 2O(s) → CaSO 4(s) + 2H 2O(l) D.2NH 3(g) → 3H 2(g) + N 2(g) 9. 下列各组符号所代表的性质均属状态函数的是 ( ) 3.15 2mol Hg(l)在沸点温度(630K)蒸发过程中所吸收的热量为109.12kJ。则汞的标准摩尔蒸发热ΔvapHm=(54.46)kJ ;该过程中对环境做功W=(10.48kJ),ΔU=(98.64kJ),ΔS=(173.2J·K-1),ΔG=(0) 3.16 有A,B,C,D四个反应,在298K时的反应的热力学函数分别为反应 A B C D Δ 10.5 1.80 -126 -11.7 rHm/(kJ·m ol-1) Δ 30.0 -113 84.0 -105 rSm/(kJ·m ol-1) 则在标准状态下,任何温度都能自发进行的反应是(C),任何温度都不能自发进行的反应是(B);另两个反应中,在温度高于(77)℃时可自发进行的反应是(A),在温度低于(-161.6)℃时可自发进行的反应是(D) 3.17 1mol液态的苯完全燃烧生成的CO2(g)和H2O(l),则该反应的Qp与Qv的差值(-3.72)kJ(温度25℃) 3.18 已知25℃时,ΔfHm(Br,g)=30.71kJ·mol-1,ΔfGm(Br,g) =3.14kJ·mol-1,则Br2(l)的标准摩尔蒸发熵为(92.52)J·mol-1·K-1,正常沸点为(58.93)℃ 3.19 反应2HgO(s)===2Hg(l)+O2(g)ΔrHm=181.4kJ·mol-1,则ΔfHm(HgO,s)=(-90.7kJ·mol-1)。已知Ar(Hg)=201,生成1gHg(l)的焓变是(0.451)kJ 3.20 已知反应CaCO3(s)===CaO(s)+CO2(g)在298K时ΔrGm=130kJ·mol-1,1200K时ΔrGm=-15.3kJ·mol-1,则该反应的ΔrHm 为(161J·mol-1·K-1) 3.21 将下列物质按摩尔熵值由小到大排列,其顺序为 Li(s) 化学热力学基础复习题 一、是非题 下列各题的叙述是否正确?正确的在题后括号内画“√”,错误的画“?” 1 在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。( ) 1答:? 2 25℃时H2(g)的标准摩尔燃烧焓在量值上等于25℃时H2O(g)的标准摩尔生成焓。() 2答: √p42 3 稳定态单质的?f H m (800K)=0 。( ) 3答: √ 4 d U=nC v,m d T公式对一定量的理想气体的任何pVT过程都适用。( ) 4答: √p32 5 系统处于热力学平衡态时,其所有的宏观性质都不随时间而变。() 5答:√ 6 若系统的所有宏观性质均不随时间而变,则该系统一定处于平衡态。() 6答: √ 7 隔离系统的热力学能是守恒的。() 7答:√ 8隔离系统的熵是守恒的。() 8答:? 9 一定量理想气体的熵只是温度的函数。() 9答:? 10 绝热过程都是定熵过程。() 10答:? 11 一个系统从始态到终态,只有进行可逆过程才有熵变。() 11答:? 12 系统从同一始态出发,经绝热不可逆过程到达的终态,若经绝热可逆过程,则一定达不到此终态。() 12答: √ 13 热力学第二定律的克劳修斯说法是:热从低温物体传到高温物体是不可能的。() 13答:?p51 14 系统经历一个不可逆循环过程,其熵变> 0。() 14答:?p51 15 系统由状态1经定温、定压过程变化到状态2,非体积功W’<0,且有W’>?G和?G <0,则此状态变化一定能发生。() 15答: √ 16 绝热不可逆膨胀过程中?S >0,则其相反的过程即绝热不可逆压缩过程中?S <0。() 16答:? 17 临界温度是气体加压液化所允许的最高温度。( ) 17答:√ 18 化学势是一广度量。() 18 答: ? 第三章金属电化学腐蚀的热力学原理 §3-1 腐蚀原电池 1.腐蚀原电池是指导致金属材料的破坏而不能对外做有用功的短路原电池。 电极反应方程式阳极:Fe →Fe2+ +2e 阴极:2H+ +2e →H2 (图3-1) 电极反应方程式阳极:Fe →Fe2+ +2e 阴极:2H+ +2e →H2 O2 + 4H+ +4e →2H2O (图3-2) 电化学腐蚀发生的根本原因是由于介质中存在着平衡电极电位高于金属的平衡电极电位的氧化性物质。 2.腐蚀原电池的组成及工作过程 1)组成:阳极、阴极、电解质溶液、外电路。 2)工作过程:①金属阳极溶解过程如Fe →Fe2+ +2e ②溶液中氧化性物质的阴极还原过程如 2H+ +2e →H2 ③电子和离子的定向流动过程 以上三个过程是彼此独立进行的,但又是串联在一起的,因而只要其中的某个过程的进行受到阻滞,则金属的腐蚀速度就会减缓。3.电化学腐蚀的次生过程 腐蚀电池工作过程中,阳极附近金属离子(如Fe2+)浓度增大,阴极附近的pH升高,则随着离子的迁移发生如下反应: Fe2+ + 2OH- →Fe(OH)2 ↓ 或者进一步被氧化为:4Fe(OH)2+ O2 +2H2O →Fe(OH)3↓ 即铁在含氧水溶液中腐蚀的次生过程。 如图所示是铁在含氧水溶液中的腐蚀及其次生过程。 (图3-3 P22) 4.腐蚀原电池的分类 按照电极的大小,被破坏金属的表观形态,腐蚀电池可分为三类: 1)超微电池腐蚀:金属表面上存在的超微 观的(原子大小的)电化学不均一性引起,可以认为阴阳极是等电位,导致金属材料 的均匀腐蚀。 2)微电池腐蚀:金属表面存在许多微小的 第三章地球化学热力学基础 热力学是研究热现象的一门科学。它从具有公理性质的几个基本定律出发,演绎物质体系的宏观性质与热、功形式的能量之间的关系。经典热力学只研究达到平衡态时物质体系的宏观性质,近代热力学的发展还可以研究非平衡态、不可逆过程和自然界的自组织现象等。热力学原理应用于研究化学反应(包括相变)形成了化学热力学分支,它要解决的主要问题是根据化学反应和相变过程中伴随的能量变化,预测化学反应和相变的方向和进程。化学热力学与地球化学相结合形成了地球化学热力学。 热力学的基本定律是大量实验事实和生产经验的总结,它是非常可靠的。热力学的方法是演绎性的。因而,从基本定律出发,通过严密的逻辑推理而得出的结论,必然具有高度的普适性和可靠性。热力学可以广泛地用于解决不同学科领域的许多问题。热力学的研究对象是宏观体系,即由大数量分子构成的集合体,它不考虑物质的微观结构,一点也不涉及物质体系宏观性质变化的微观机理和变化速率。 地球化学是研究地球和天体物质的化学组成、化学反应和 化学演化历史的一门科学。由于地球化学的研究对象具有空间上的巨大性、时间上的漫长性和演化过程的多阶段多旋迴性等特点,它们的成因和演化往往不是研究者可以直接观察的,甚至是难以在实验室里重现的。地球化学家只得采用反序的思维方法,即根据地质地球化学过程中产生的遗迹,如对岩石、矿物、岩体和矿床等地质体的研究,反演地球演化历史中发生过的各种地质地球化学作用的性质及其物理化学条件。因而热力学是地质地球化学研究中极其有用的理论工具。假定我们直接观察到的各种地质体是曾经在某种热力学平衡条件下形成的,并且自形成那时以来,一直保持着当时的平衡状态,而未被后来的作用所改造,那么依靠实验测得的矿物和岩石的热力学性质,运用热力学理论,可以合理地推测各种地质体形成的过程及其物理化学条件。事实上地质地球化学家运用热力学原理解决地学问题,有力地推动了地球化学的发展,地球化学热力学已经成为现代地球化学体系中的重要分支学科。 热力学应用于地质地球化学研究的成功例子极多,下面仅举几个实例予以说明,它们是由几位地质地球化学大师在地球化学发展初期所作的开创性研究工作。 J.H.Van′t Hoff在1896—1909年进行了一系列水—盐体系相平衡的实验研究,其目的是解释德国上古生代二叠纪蔡希斯坦(Zechstein)统海相钾盐矿床的成因,这种类型的矿床在 第2章电化学热力学 2.1 相间电位和电极电位 2.1.1 相间电位 两相接触时,荷电粒子(含偶极子)在界面层中的非均匀分布使两相界面层中存在电位差,这种电位差称为相间电位。引起相间电位的可能有以下四种情形: (a)带电粒子在两相间的转移或利用外电源向界面两侧充电使两相中出现剩余电 荷,形成“双电层”。 (b)阴、阳离子在界面层中吸附量不同,使界面与相本体中出现等值反号电荷. 在界面的溶液一侧形成吸附双电层。 (c)溶液中极性分子在界面溶液一侧定向排列,形成偶极子层。 (d)金属表面因各种短程力作用而形成的表面电位差。 在电化学体系,离子双电层是相间电位的主要来源,同一种粒子在不同相中所具有的能量状态是不同的,当两相接触时,该粒子就会自发地从高能态相向低能态相转移。对于不带电的粒子i相间稳态分布的条件是 即该粒子在两相中的化学位相等, 对于带电粒子来说,在两相间转移时,除了引起化学能的变化外,还有随电荷转移所引起的电能变化。假设孤立相M是一个由良导体组成的球体,因而球体所带的电荷全部均匀分布在球面上。 (1)将单位正电荷e从无穷远处移至离良导体球M 104~10-5cm处时所做的功, 电荷与球体之间只有长程力(库仑力)作用,称为M相(球体)的外电位,用ψ表示,有: (2)从10-4 ~ 10-5cm处越过表面层到达M相内界面短程力做电功称为M的表面电位χ: χ (3)克服物相M与试验电荷之间短程力所作的化学功: μ 化 对于单位正电荷情况:任一相的表面层中,由于界面上的短程力场(范德瓦耳斯力、共价键力等)引起原子或分子偶极化并定向排列,使表面层成为一层偶极子层。单位正电荷穿越该偶极子层所作的电功称为M相的表面电位χ。所以将一个单位正电荷从无穷远处移入M相所作的电功是外电位ψ与表面电位χ之和,即 Ф称为M相的内电位。如果进入M相的不是单位正电荷,而是1摩尔的带电粒 第3章化学热力学基础 1.状态函数的含义及其基本特征是什么?T、p、V、△U、△H、△G、S、G、Q p、Q u、Q、W、W e最大中哪些是状态函数?哪些属于广度性质?哪些属于强度性质? 答:状态函数的含义就是描述状态的宏观性质,如T、p、V、n、m、ρ等宏观物理量,因为体系的宏观性质与体系的状态之间存在对应的函数关系。状态函数的基本特点如下: (1)在条件一定时,状态一定,状态函数就有一定值,而且是唯一值。 (2)条件变化时,状态也将变化,但状态函数的变化值只取决于始态和终态,与状态变化的途径无关。 (3)状态函数的集合(和、差、积、商)也是状态函数。其中T、p、V、S、G是状态函数,V、S、G、H、U属于广度性质(具有加和性),T、p属于强度性质。 2.下列叙述是否正确?试解释之。 (1)Q p=△H,H是状态函数,所以Q p也是状态函数; (2)化学计量数与化学反应计量方程式中各反应物和产物前面的配平系数相等; (3)标准状况与标准态是同一个概念; (4)所有生成反应和燃烧反应都是氧化还原反应; (5)标准摩尔生成热是生成反应的标准摩尔反应热; (6)H2O(l)的标准摩尔生成热等于H2(g)的标准摩尔燃烧热; (7)石墨和金刚石的燃烧热相等; (8)单质的标准生成热都为零; (9)稳定单质的△f HΘm、SΘm、△f GΘm均为零; (10)当温度接近绝对零度时,所有放热反应均能自发进行。 (11)若△r H m和△r S m都为正值,则当温度升高时反应自发进行的可能性增加; (12)冬天公路上撒盐以使冰融化,此时△r G m值的符号为负,△r S m值的符号为正。 答:(1)错。虽然H是状态函数,△H并不是状态函数,所以Qp当然不是状态函数;。 (2)错。因为反应物的化学计量数为负,与反应计量方程式中反应物前面为正的系数不相等; (3)错。如气体的标准状况是指0℃和101.325KPa条件,而标准态对温度没有限定; (4)错。如由石墨生成金刚石的生成反应就不是氧化还原反应; (5)对。因某物质的标准摩尔生成热是由某物质生成反应的标准摩尔反应热而命名的; (6)对。因H2O(l)的生成反应与H2(g)的燃烧反应是同一个反应; (7)错。因石墨和金刚石的燃烧反应虽最终产物相同,但反应的始态不同; (8)错。因为只有稳定单质的标准生成热才为零; (9)错。因为只有稳定单质的△f HΘm、△f GΘm为零,而稳定单质的SΘm在一般条件下并不为零; (10)对。因为当温度接近绝对零度时,反应熵变趋近于零,反应热为影响反应自发的唯一因素; (11)对。因△r H m和△r S m都为正值,说明是吸热的、有可能自发的反应,升温有利; (12)对。因冰融化变水了,说明乃混乱度增大的自发过程,△r G m值必为负,△r S m值必为正。 3.1 mol气体从同一始态出发,分别进行恒温可逆膨胀或恒温不可逆膨胀达到同一终态,因恒温可逆膨胀对外做功W r大于恒温不可逆膨胀对外做的功W ir,则Q r>Q ir。对否?为什么? 答:对。因为从同一始态到同一终态,热力学能变相同,根据热力学第一定律,因恒温可逆膨胀对外做功W r大于恒温不可逆膨胀对外做的功W ir,则恒温可逆膨胀从环境吸收的热Q必大于恒温不可逆膨胀从环境吸收的热Q ir。(△u=O r-W r= O-W; W r>W ir则Q r>Q ir) 第一章 2.计算下行反应的标准反应焓变△r Hθm: 解:①2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s) △f Hθm(kJ?mol-1) 0 -824.2 -1675.7 0 △r Hθm=△f Hθm(Al2O3,s)+2△f Hθm(Fe,s)-2△f Hθm(Al,s) - △f Hθm(Fe2O3 ,s) = -1675.7 + 2×0 - 2×0 - (-824.2) = - 851.5 (kJ?mol-1) ②C2H2 (g) + H2(g) → C2H4(g) △f Hθm(kJ?mol-1) 226.73 0 52.26 △r Hθm = △f Hθm(C2H4 ,g) - △f Hθm(C2H2,g) - △f Hθm(H2,g) = 52.26 - 226.73 - 0 = -174.47 (kJ?mol-1) 3. 由下列化学方程式计算液体过氧化氢在298 K时的△f Hθm(H2O2,l): ① H2 (g) + 1/2O2 (g) = H2O (g) △r Hθm = - 214.82 kJ?mol-1 ② 2H(g) + O(g) = H2O (g) △r Hθm = - 926.92 kJ?mol-1 ③ 2H(g) + 2O(g) = H2O2 (g) △r Hθm = - 1070.6 kJ?mol-1 ④ 2O(g) = O2 (g) △r Hθm = - 498.34 kJ?mol-1 ⑤ H2O2 (l) = H2O2 (g) △r Hθm= 51.46 kJ?mol-1 解:方法1:根据盖斯定律有: [(方程①-方程②+方程③-方程⑤)×2-方程④]÷2可得以下方程 ⑥H2(g)+O2(g)=H2O2(l) △r Hθm △r Hθm=[(△r Hθ1-△r Hθ2+△r Hθ3-△r Hθ5) ×2-△r Hθ4] ÷2 ={[-214.82-(-926.92)+(-1070.6)-51.46] ×2-(-498.34)} ÷2 =[(-409.96)×2+498.34] ÷2 =(-321.58) ÷2 = -160.79(kJ?mol-1) △f Hθm(H2O2 ,l)= △r Hθm= -160.79 kJ?mol-1 方法2:(1)由①可知H2O的△f Hθm(H2O,g)= - 214.82 kJ?mol-1 (2)根据④计算O的△f Hθm(O,g) 2O(g) = O2 (g) △r Hθm = - 498.34 kJ?mol-1 △r Hθm = △f Hθm(O2 ,g)- 2△f Hθm(O,g) = 0 - 2△f Hθm(O,g) = - 498.34 kJ?mol-1 △f Hθm(O,g)= 249.17 kJ?mol-1 (3) 根据②求算△f Hθm(H,g) 2H(g) + O(g) = H2O (g) △r Hθm = - 926.92 kJ?mol-1 △f Hθm(kJ?mol-1) 249.17 - 214.82 △r Hθm = △f Hθm(H2O,g) - 2△f Hθm(H,g) -△f Hθm(O,g) = - 214.82 - 2△f Hθm(H,g)- 249.17 = - 926.92 第一章 化学热力学习题参考答案 1. 封闭体系中的理想气体由初态{P 1, V 1, T 1 },分别经以下四个过程:(1) 等温可逆膨胀; (2) 等温恒外压膨胀;(3) 绝热可逆膨胀;(4) 绝热恒外压膨胀;到具有相同体积V 2的终态。 请在PV 图上表示出四个过程所做的功。并比较其做功的大小。 解:由状态{P 1, V 1, T 1 }到具有相同体积V 2的终态,(1)等温可逆膨胀 (2)等温恒外压膨 胀 (3)绝热可逆膨胀 (4)绝热恒外压膨胀过程的PV 图如下所示 (1):AB 线下的面积即为过程(1)所做的功[W(1)]; (2):DB 线下的面积即为过程(2)所做的功[W(2)]; (3):AC 线下的面积即为过程(3)所做的功[W(3)]; (4):EF 线下的面积即为过程(4)所做的功[W(4)]; 由图可以看出:W(1)>W(2);W(1)>W(3);W(1)>W(4);W(2)>W(4);W(3)>W(4)。 2. 证明封闭体系等压热容(C p )与等容热容(C v )存在如下关系: [()]()P V T V H P C C V P T ??-=-+?? 证明如下: 因为(,)H H T P = 则有??????=+ ? ???????P T H H dH dT dP T P 在恒容条件下: V =+P P T V H H H P T T T ???????????? ? ? ? ????????????? H U PV =+又 U ()则 V V P T V PV H H P T T T P T ???????????????+=+ ? ? ? ? ???????????????? U ()=+移项得: P V T V V H H P PV T T P T T ???????????????-- ? ? ? ? ???????????????? =V P V T V H P C C P T ????????-=- ? ??????????? =V P V T V H P C C P T ? ???????-- ? ???????????即 3. 令 H = H(T, P) 和 S = S(T, P), 根据热力学关系式推导以下关系式: (1)22 11[()]T P P P T P V H C dT T V dP T ??=+-+??? (2)2211[()]T P P P T P C V S dT dP T T ??=+-??? 解答: (1)式证明: ()()因为 p T H H dH dT dp T p ??=+?? ( ) (1)T H CpdT dp p ?=+? dH TdS Vdp =+又 ()()T T H S T V p p ??=+??则 (2) ( )()T P S V p T ??=-??且有麦克斯韦关系式 (3) 将(2)和(3)式代入(1)式得:[( )]p P V dH C dT T V dp T ?=+-+? 积分得:2 211[()]T P P P T P V H C dT T V dP T ??=+-+??? (2)式证明: 因为()()(4)P T S S dS dT dP T P ??=+?? 将(3)式代入(4)式得:()[()](5)P p S V dS dT dP T T ??=+-?? 第一章 化学热力学 自 测 习 题 1.填空题 (1)热是( )的一种形式,系统吸热,Q ( )0;系统放热,Q ( )0;定压下气体所做的体积 功W=( );气体膨胀时,体积功W ( )0。若NaOH 溶液与HCl 溶液中和时,系统的焓变θH r ?= a KJ·mol -1,则其热力学能的变化θU r ?=( )KJ·mol -1。 (2)反应进度ε的单位是( );反应计量式中反应物B 的计量数υB ( )0。生成物的υB ( )0。 (3)由石墨制取金刚石的焓变θm r H ? ( )0,燃烧相同质量的石墨和金刚石,( )燃烧放出的热量更多。 (4)已知298K 时下列热化学方程式: ①2NH 3(g)→N 2(g)+3H 2(g) θm r H ?= 92.2 KJ·mol -1 ②H 2(g)+21 O 2(g) →H 2O(g) θm r H ?= -241.8 KJ·mol -1 ③4NH 3(g)+ 5O 2(g) →4NO(g)+6 H 2O(g) θm r H ?= -905.6 KJ·mol -1 试确定θm f H ?(NH 3,g ,298K )=( )KJ·mol -1;θm f H ?(H 2O ,g ,298K )= ( )KJ·mol -1;θm f H ?(NO ,g ,298K )=( )KJ·mol -1。由NH 3 (g) 生产1.00Kg NO(g)则放出热量为( )KJ 。 (5)已知反应HCN (aq )+OH -(aq )→CN -(aq )+ H 2O(l)的θ m r H ?= -12.34KJ·mol -1;反应H +(aq )+OH -(aq )→H 2O(l)的θm r H ?= -55.84KJ·mol -1. θm f H ?(OH -,aq )= -229.994KJ·mol -1, θm f H ?(H 2O,l )= -285.83KJ·mol -1,则θm f H ?(H +,aq )= ( )KJ·mol -1;HCN (aq )在水中的解离反应方程式为 ( ),该反应的 θm r H ?= ( )KJ·mol -1。 2.选择题 (1)下列物理量中,属于状态函数的是( ) (A )H (B )Q (C )△H (D )△U 第三章 化学反应热力学总结 本章主要是运用热力学的基本概念、原理和方法研究化学反应的能量变化,引入反应焓与温度的关系式——Kirchhoff 公式,建立热力学第三定律以求算化学反应的熵变,引入化学热力学重要关系式——Gibbs-Helmholtz 方程。 一、 基本概念 1、化学反应进度 ()/B B d dn ξξν= B B n /?ξ=?ν 或 B B n /ξ=?ν 2、盖斯定律 3、标准生成热 4、标准燃烧热 5、热力学第三定律 6、规定熵与标准熵 二、化学反应焓变的计算公式 1、恒压反应焓与恒容反应焓的关系 p,m V,m B B Q Q (g)RT =+ν ∑ 或 p ,m V ,m B B H U (g )R T ?=?+ν∑ 简写为: m m B B H U (g)RT ?=?+ν∑ 2、用f B H ?$计算r m H ?$: r m H ?$ (298K)= B f B B H (298K)ν ?∑$ 3、由标准燃烧焓c m H ?!的数据计算任一化学反应的标准反应焓r m H ?! ()r m H 298K ?=$()B C m,B B H 298K -ν?∑$ 4、计算任意温度下的r m H ?!——基尔霍夫公式 (1)微分式 r m B p,m p,m B p H (T)C (B)C T ????=ν=??????∑$ (2)已知()r m H 298K ?$ 求任意温度下的r m H ?! 当(),p m C B 表示式为形式: ()2 ,p m C B a bT cT =++ 时 ()()T 2r m r m 298K H TK H 298K (a bT cT )dT ?=?+?+?+??$ $,积分得: ()()()()22 33r m r m b c H TK H 298K a T 298T 298(T 298)23 ???=?+?-+ -+-$$ 若令:230r m b c H H (298k)a 29829829823???=?-??-?-?$ 则: 23r m 0b C H (TK)H aT T T 23 ???=?+?++$ 第3章电化学热力学 3.1可逆电池和可逆电极 电化学与热力学的联系 组成可逆电池的必要条件 可逆电极的类型 电化学与热力学的联系桥梁公式: r ,,f,max r m ,,()()T P R T P R G W nEF nEF G zEF ξ Δ==?Δ=?=?可逆电池:电池在平衡态或无限接近于平衡态的 情况下工作。 3.1.1 组成可逆电池的必要条件 化学反应可逆能量变化可逆 原电池电解池 电池充放电后,反应体系复原 1. 电极及电池的化学反应本身必须是可逆的例 2. Zn, Cu 棒插入H 2SO 4中构成的电池 原电池(放电)反应: (-)Zn → Zn ++ + 2e 阳极,氧化(+)2H + + 2e → H 2↑ 阴极,还原 总反应:Zn + 2H + → Zn ++ + H 2↑ 电解池(充电)反应: (-)2H + + 2e → H 2↑ 阴极,还原(+)Cu → Cu ++ + 2e 阳极,氧化 总反应:2H + + Cu → Cu ++ + H 2↑ 1. 电极及电池的化学反应本身必须是可逆的 反应体系复原的同时,环境也必须复原 要求能量复原,即要求外加电流I →0 因为电池总是有内阻,内阻消耗电能 功—→热,导致不可逆 2. 能量变化可逆 即:电池的工作条件是可逆的(处于或接近于平衡态,即没有电流通过或通过的电流为无限小)。 Question 1 Question 2 研究可逆电池的重要意义 9(1)揭示一个原电池把化学能转变为电能的最高限度; 9(2)可利用可逆电池来研究电化学系统的热力学,即电化学反应的平衡规律。原电池的电动势就是指可逆电池的电动势。 Question 可逆电池中的反应都是在等温等压下进行的,因此ΔG=0? ZFE G m r ?=Δ 3.1.2 可逆电极的类型ù金属与其阳离子组成的电极ù氢电极ù氧电极ù卤素电极ù汞齐电极 ù金属-难溶盐及其阴离子组成的电极ù金属-氧化物电极 ù氧化-还原电极 ⑴第一类电极 ⑵第二类电极 ⑶第三类电极 第一章 化学热力学基础 公式总结 1.体积功 We = -Pe △V 2.热力学第一定律的数学表达式 △U = Q + W 3.n mol 理想气体的定温膨胀过程 .定温可逆时: Wmax=-Wmin= 4.焓定义式 H = U + PV 在封闭体系中,W ′= 0,体系发生一定容过程 Qv = △U 在封闭体系中,W ′= 0,体系发生一定压过程 Qp = H2 – H1 = △H 5.摩尔热容 Cm ( J·K-1·mol-1 ): 定容热容 CV (适用条件 :封闭体系、无相变、无化学变化、 W ′=0 定容过程 适用对象 : 任意的气体、液体、固体物质 ) 定压热容 Cp ?=?2 1 ,T T m p dT nC H (适用条件 :封闭体系、无相变、无化学变化、 W ′=0 的定压过程 适用对象 : 任意的气体、液体、固体物质 ) 单原子理想气体: Cv,m = 1.5R , Cp,m = 2.5R 双原子理想气体: Cv,m = 2.5R , Cp,m = 3.5R 1 221ln ln P P nRT V V nRT =n C C m = ?=?2 1 ,T T m V dT nC U 多原子理想气体: Cv,m = 3R , Cp,m = 4R Cp,m = Cv,m + R 6.理想气体热力学过程ΔU 、ΔH 、Q 、W 和ΔS 的总结 7.定义:△fHm θ(kJ·mol-1)-- 标准摩尔生成焓 △H —焓变; △rHm —反应的摩尔焓变 △rHm θ—298K 时反应的标准摩尔焓变; △fHm θ(B)—298K 时物质B 的标准摩尔生成焓; △cHm θ(B) —298K 时物质B 的标准摩尔燃烧焓。 8.热效应的计算 由物质的标准摩尔生成焓计算反应的标准摩尔焓变 △rH θm = ∑νB △fH θm ,B 由物质的标准摩尔燃烧焓计算反应的标准摩尔焓变 △rH θm = -∑νB △cH θm ,B 9.Kirchhoff (基尔霍夫) 方程 △rHm (T2) = △rHm (T1) + 如果 ΔCp 为常数,则 △rHm (T2) = △rHm (T1) + △Cp ( T2 - T1) 10.热机的效率为 对于卡诺热机 dT C p T T ? ?2 1 1 2 1211Q Q Q Q Q Q W +=+=-=η 第三章化学热力学基础与化学平衡 3.1 什么是化学热力学? 3.2 化学热力学常用术语 3.3 热化学方程式和热化学定律 3.4 生成焓和键焓 3.5 熵 3.6 Gibbs自由能 3.7 化学反应的限度与化学平衡 (二) 熵的概念 为了表述体系的混乱度,人们引入了熵的概念(S, 最早由Clausius提出)。可以把熵看作是体系混乱度(或有序度)的量度,也是一种热力学状态函数。 显然,混乱度与体系中可能存在的微观状态数目(?) 有关,即有: S= f(?) 体系中可能存在的微观状态数越多,体 系的外在表现就越混乱,熵也就越大。 Boltzmann(1877)用统计热力学方 法证明S和?呈以下对数关系,即 S= k ln? 式中k是Boltzmann常数,且k= R/N A 。 Ludwig Boltzmann (1844-1906) ,奥地利物理学家 状态I 状态II 由状态I变成状态II,混乱度增加 A tiny sample of solid carbon monoxide consisting of four molecules. When there is only one way of arranging the molecules so that all the molecules point in one direction, the entropy of the solid is 0 (S = 0).CO CO CO CO All 16 ways of arranging four CO molecules, assuming that each orientation is equally likely. The entropy of such a solid is greater than 0. (?= 2 ×2 ×2 ×2 = 16)物理化学第03章化学平衡热力学原理
第三章化学热力学
第一章 化学热力学基础 公式总结
第一章 化学热力学基础 习题解答
第3章 化学热力学基础自测题
第3章 化学热力学基础
第1章化学热力学基础复习题
第三章 金属电化学腐蚀的热力学原理
第三章 地球化学热力学基础
第2章 电化学热力学
第3章 化学热力学基础 习题及全解答
第一章化学热力学基础参考答案
第一章化学热力学习题参考答案
最新第一章 化学热力学的练习题
(物理化学)第三章 化学反应热力学总结
第3章 电化学热力学
第一章 化学热力学基础 公式总结
第三章化学热力学基础与化学平衡(3)
- 1、第一章 化学热力学基础
- 第一章--化学热力学基础-习题解答
- 第一章化学热力学基础1
- 无机化学化学热力学基础
- 第一章化学热力学基础公式总结
- 第一章--化学热力学基础-习题解答
- 普通化学第一章化学热力学基础(下)PPT资料53页
- 第一章 化学热力学基础 公式总结
- 第1章化学热力学基础复习题讲解
- 第一章 化学热力学基础 公式总结
- 第1章化学热力学基础复习题
- 第一章 化学热力学基础 1
- 第一章 化学热力学基础 公式总结
- 第1章化学热力学基础复习题
- 无机化学_第1章化学热力学基础
- 第1章化学热力学基础习题测验解答(二)
- 第一章化学热力学基础参考答案
- 最新第一章 化学热力学基础 习题解答培训资料
- 1第一章 化学热力学基础
- 第一章 化学热力学基础
