用光速测量仪探究Nacl溶液折射率与浓度的关系

用光速测量仪探究氯化钠溶液折射率与浓度的关系
摘要:本实验应用现有的CG—V型光速测量仪,对其测量光速的光路进行改进,测量不同氯化钠浓度溶液的折射率。通过在用光速测定仪的光路上放入装有不同浓度的氯化钠溶液的水管改变远光程的大小,示波器将显示出不重合的两条波,通过移动棱镜小车使示波器上的两条波再次重合,通过测量放入水管前后两条导轨的长度,即可计算出相应浓度的氯化钠溶液的折射率,最终得出氯化钠溶液的折射率随其浓度的增大而增大,而且二者成线性关系。通过测量氯化钠溶液的折射率就可以知道其浓度大小,就可以辨别像氯化钠溶液这样无色的溶液的浓度大小了。
关键词:光速测量仪折射率浓度定量关系误差分析
引言:折射率是光学介质的一个重要的物理参数,反映了物质的光学基本性质。折射率与介质本身的性质息息相关,在外界条件一定的情况下,掌握折射率的变化情况可以了解物质的光学性能、纯度、质量浓度以及色散等性质,故快速、准确的测量透明介质的折射率有助于有效的发挥这些介质的作用。目前测量透明介质折射率的方法和仪器很多,这次实验是利用目前在国内具有先进水平的光速测量仪, 通过改进仪器的光路, 以达到测量透明介质折射率的目的。其次,利用Excel软件对实验测量中的数据进行处理,提高了效率和减少了误差。
实验仪器:CG-V型光速测量仪频率计卷尺细绳计算机不同浓度氯化钠溶液
方形透明管GOS-6021型双踪示波器
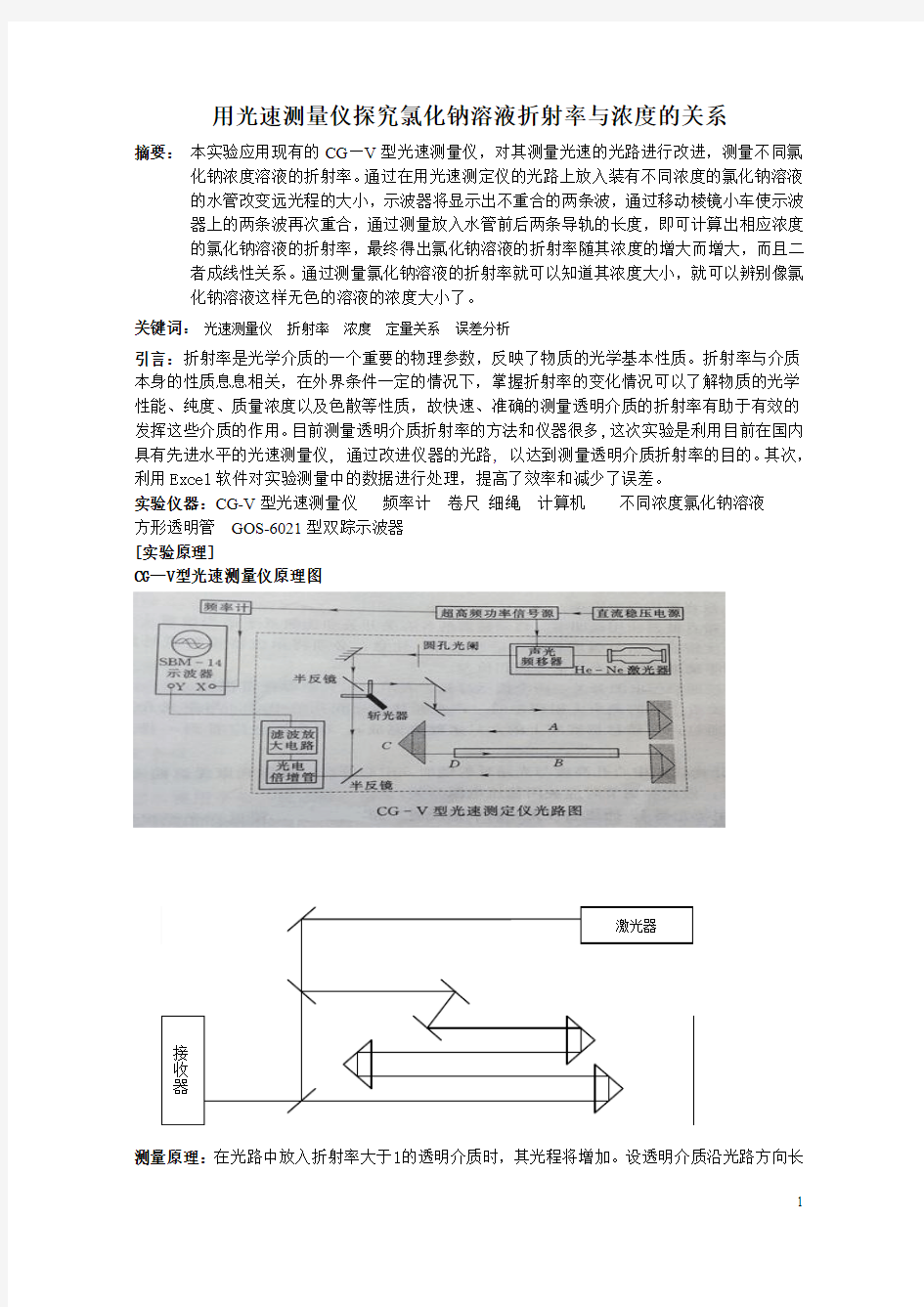
[实验原理]
CG—V型光速测量仪原理图
测量原理:在光路中放入折射率大于1的透明介质时,其光程将增加。设透明介质沿光路方向长
度为d,光在这段距离d内的光程为cd ( c为光速)。若将透明介质置于光路中,则光在介质中的光程为:
vd = cnd
因此,透明介质加入前后的光程差为:
cd (n-1) (n为折射率)
在实验时,示波器上的图像如图一所示,其中①是与远程光相对应的波形,②是与近程光相对应的波形.折射率的测量主要根据是示波器上二光
拍信号波形的相位差与远程光和近程光的光程差
(示波器实验原理图)
[实验方案]
配制不同浓度的氯化钠溶液
1.用粉末状NaCl固体和自来水使用精确度为0.001 g 的电子天平, 配制质量百分比浓度分
别为: 3.0% , 5.0% , 7.0% , 10.0% ,12.0%五种不同浓度的氯化钠溶液。配制不同浓度的NaCl 溶液,后取适量入圆形形透明管中。
2.仪器调节
2.1 GOS-6021型双踪示波器的调节
按示波器说明书使GOS-6021正常工作,Y轴衰减和扫描速度按输入信号适当选择。注意必须使GOS-6021处于触发状态(无外触信号扫描),否则不能准确比较光拍信号的相位差。
2.2 CG-V型光速测量仪的调节
接通电源开关,以最大激光光强输出为准,15分钟后激光器输出趋于稳定;接通电源开关,以最大激光光强输出为准,15分钟后激光器输出趋于稳定;直流稳压电源,接通稳压电源开关,指示灯亮,正负15 V电源正常供电;光速水平通过通光孔的声光介质中的驻声场充分相作用(通过调节频仪器底座上的螺丝来完成)。光栏高度与光路反射镜中心等高,用斩光器挡住远程光,调节全反镜和半光反镜使近程沿光电二极管前透镜的光轴入射到光电二极管的光敏上,打开光电接受器盒上的窗口可观察激光是否进入光敏而,这时,示波器上应有与近程光束相应的经分频的光拍波形出现,用斩光器挡住近程光,调节半反镜全反镜和正交反射镜钮,经反光镜与近程光同路入射到光电二极管的光敏而上,这时,示波器屏上应有与远光程光束相应的经分频的光拍波形出现,经反复调节,直达到要求。光电二极管方位可通过调节装置使示波器屏上显示最大振幅来确定。
测量不同浓度的氯化钠溶液的折射率
仪器都已调好,把B导轨上的棱镜小车推到左端,移动A导轨上的棱镜小车,是在示波器上的两条波重合,用卷尺测量此时A导轨的长度a+b,在B导轨中放入长度为d装有溶液的导
管,因加入n大于1的透明介质,使远光程增加,通过向左移动A导轨上的棱镜小车,使示波器上的两条波再次重合,量取此时A 导轨的长度
代入公式n=1+ 即可求出折射率大小。
数据与处理
不同浓度氯化钠溶液的折射率
数据处理:由以上数据计算得浓度为3.0%、5.0%、7.0%、10.0%、12.0%的折射率分别为1.3322 1.3388 1.3424 1.3496 1.3524
不同百分比溶液的折射率与浓度关系
由散点图可以明显地发现这不同百比溶液的折射率与浓度近似成线性关系, 由Excel生成
该趋势线的直线方程为:y =0.0022c+1.3267
即氯化钠溶液折射率与浓度的等量关系为:y=0.0022c+1.3267
结果与分析
实验结果
实验结果看出不同百分比溶液的折射率与浓度近似成线性关系,说明实验存在误差,产生误差的原因可能为:配制溶液所用的氯化钠有杂质,导致所配制的溶液不是标准浓度;因温度较低,时间有限,氯化钠未完全溶于水中,造成误差;频率误差,因为实验室条件的不稳定, 频率在实验过程中有一定的变化, 即使不断调节亦不能使其保持恒定,造成微小误差;千分尺的准确度和读数误差,本实验采用千分尺进行长度测量,千分尺本身的准确度会有一定的误差。此外, 由于无法准确地读取千分尺导轨上的读数, 需要估读一位, 这也会引起误差;照准误差,下列因素会引起照准误差:光电接收管每一点上的光电转换时延不同;棱镜小车处在不同的位置时,光斑大小和位置也会有所变化;用肉眼难以准确判断示波器上的波形是否完全重合;
改进方法
由于时间及条件所限, 本实验还存在一定的误差。为了进一步提高氯化钠溶液折射率的测量精度, 可以适当增加测量的次数以及浓度的跨度。此外, 还可以从以下几个方面对实验进行改进;在溶质溶溶解时用热毛巾捂着,加快其溶解速度,使溶质能够完全溶解。等溶解结束后,再进行降温冷却;
实验总结
由散点图可知:氯化钠溶液的折射率与浓度大致成一次线性关系,其等量关系式为y=0.0022c+1.3267,氯化钠溶液折射率随着溶液浓度的增大而逐渐增大,浓度越大,折射率越大,反之,浓度越小,折射率越小。
综上,此实验采用光拍法测量透明介质的折射率,该方法具有操作简便、数据精确等优点。参考文献
[1]竺江峰鲁晓东夏雪琴大学物理实验教程[M]中国水利出版社 2011.9
[2] 白泽生, 刘竹琴,徐红. 几种液体的折射率与其浓度关系的经验公式. 延安大学学报(自然
科学版). 2004.3
生理盐水中氯化钠含量的测定
生理盐水中氯化钠含量的测定 2010/10/15 一、目的要求: 1、学习银量法测定氯的原理和方法; 2、掌握莫尔法的实际应用 二、实验原理: 银量法需借助指示剂来确定终点,根据所用指示剂的不同,银量法又分为莫尔法佛尔哈德法和法扬司法。 本实验在中性溶液中以K2CrO4为指示剂,用AgNO3标准溶液来测定Cl-的含量: Ag+ + Cl-= AgCl↓(白色) Ag+ + CrO42-= Ag2CrO4 ↓(砖红色) 由于AgCl的溶解度小于Ag2CrO4的溶解度,所以在滴定过程中AgCl先沉淀出来,当AgCl定量沉淀后,微过量的AgNO3溶液便与CrO42-生成砖红色Ag2CrO4沉淀,指示出滴定的终点。 本法也可用于测定有机物中氯的含量。 三、仪器与试剂: 1)仪器: ①酸式滴定管、移液管、容量瓶。 ②锥形瓶(6个)、洗瓶。 ③电子天平。 2)试剂: 分析中,除非另有说明,限用分析纯试剂、蒸馏水或相同纯度的水。 ①AgNO3(s.A.R.) ②NaCl(s.A.R.) ③K2CrO4(w为0.05)溶液 ④生理盐水样品 四、实验步骤 1)0.1mol/L AgNO3标准溶液的配制: AgNO3标准溶液可直接用分析纯的AgNO3结晶配制,但由于AgNO3不稳定,见 光易分解,故若要精确测定,则要基准物(NaCl)来标定。 称取1.702g AgNO3,加适量水溶解,转移到100ml容量瓶中,用水稀释至刻度线。2)标定: 准确称取0.0585g NaCl,分别置于三个锥形瓶中,各加25ml水使其溶解。加1ml K2CrO4溶液。在充分摇动下,用AgNO3溶液滴定至溶液刚出现稳定的砖红色。记录 AgNO3溶液的用量。重复滴定二次。计算AgNO3溶液的浓度。 表一:各物质加入质量和滴定到终点的体积 瓶号 1 2 3 NaCl(g)0.0585 0.0583 0.0583 K2CrO4(ml) 1 1 1 蒸馏水(ml)25 25 25 n(NaCl)(mol)0.001 0.000997 0.000997 AgNO3(滴定前 ml) 4 13.2 22.3 AgNO3(滴定后 ml)12.9 22.3 31.3 消耗AgNO3体积(ml)8.9 9.1 9.0 3)测定生理盐水中NaCl的含量: 用移液管精确移取已稀释的生理食盐水25ml置于三个锥形瓶中,各加入1ml K2CrO4指示剂,用标准 AgNO3溶液滴定至溶液刚出现稳定的砖红色(边摇边滴)。重复滴定二次,计算NaCl的含量。
测液体折射率实验报告
实验题目:表面等离激元共振法测液体折射率实验 预习报告与原始数据见纸质报告。 实验步骤: 1.调整分光计,实验部件安装和线路连接已经完成; 2.传感器中心调整 粗调:将微调座放到载物台上,固定好调节架后,在调节架中心放上准星,调节载物台锁紧螺钉使激光光斑至粗调对准处,不断调节平行光管光轴水平调节螺钉与微调座的两颗微调螺钉,使当游标盘转动一圈时,激光光斑一直照在该处; 细调:调节平行光管光轴高低调节螺钉,使激光光斑射在细调对准处,不断调节平行光管与微调座使当转动游标盘一圈时,激光光斑一直射在该处; 中心调节:继续调节平行光管光轴高低调节螺钉,使激光光斑射在准星顶尖处,再次调节使转动游标盘一圈时,激光光斑一直射在顶尖处。 3.测量前准备调节 中心调节完毕后,移去准星,放入敏感元件,将游标盘和刻度盘调节到合适位置;调整敏感元件使光垂直入射至半圆柱棱镜中的镀金属膜上,拧紧游标盘止动螺钉;转动刻度盘使刻度盘0o对准游标盘0o;拧紧转座与刻度盘止动螺钉,松开游标盘止动螺钉,从此刻开始刻度盘始终保持不动,将游标盘转回至刻度盘所示65o位置处锁定,测量前准备调节完毕。
4.测量读数 保持刻度盘和游标盘不动,转动望远镜支臂,观察功率计读数,记录其中的最大读数;保持刻度盘不动,移动游标盘从66o到88o,入射角没增加1o,记录功率计最大读数。 5.数据表格与数据处理 (1)数据表格自拟; (2)画出相对光强与入射角的关系曲线图; (3)比较不同溶液的共振角有何差异。 实验样本: 本实验采用样本为:纯净水;无水乙醇;水:乙醇=1:1的乙醇溶液。 实验数据: 1.纯净水 角度(°)666768697071 角度(°)72737475767778相对光强243273376480554581641653角度(°)7980818283848586相对光强700705713733741741758765角度(°)8788
酱油氯化钠含量的测定
项目二酱油中氯化钠含量的测定 一、实验原理 用硝酸银标准溶液滴定样品中的氯化钠,生成氯化银沉淀,待全部氯化银沉淀后,多滴加的硝酸银与络酸钾指示剂生成络酸银使溶液呈橘红色即为终点。由硝酸银标准滴定溶液消耗量计算氯化钠的含量。 二、仪器和试剂 铁架台、25ml 棕色滴定管、烧杯、锥形瓶、无水氯化钠、硝酸银、络酸钾溶液(50g/L )。 三、实验步骤 (1)样品的处理:量取酱油3ml 加入装有50ml 水的烧杯中,加入10g 活性炭在80℃水浴30min 进行脱色处理并进行过滤,重复几次到酱油为澄清透明或带有淡黄色的液体为止。将滤液转移至100ml 容量瓶中,备用。 (2)硝酸银的配制:准确称取1.75g 左右硝酸银固体加水溶解后转移至100ml 棕色容量瓶,备用。 (3)硝酸银的标定:准确称取0.585g 烘干后的无水氯化钠加适量蒸馏水溶解,然后加入4-5滴铬酸钾指示剂,用配制的硝酸银溶液进行滴定,记录滴定所消耗的硝酸银溶液的体积。做三次平行,同时做空白实验。 (4)样品溶液的滴定:吸取5.0mL 的脱色后稀释液于250mL 锥形瓶中,加30mL 水及1mL 铬酸钾溶液,混匀。在白色瓷砖的背景下用0.1mol/L 硝酸银标准滴定溶液滴定至初显桔红色。平行滴定三次,同时做空白试验。 四、结果计算 (1)硝酸银溶液的标定按下式计算: M v v m c ?-?=)10000(
式中: c ——标定的氯化钠溶液的浓度,mol/L ; m ——无水氯化钠的质量准确数值,g ; v ——滴定消耗硝酸银标准滴定溶液的体积,mL ; 0v ——空白试验消耗硝酸银标准滴定溶液的体积,mL ; M ——氯化钠的摩尔质量,g/mol 。 (2)样品中氯化钠含量按下式计算: 式中:X ——样品中氯化钠的含量,g/100mL ; 1V ——滴定样品稀释液消耗硝酸银标准滴定溶液的体积,mL ; V 2——空白试验消耗硝酸银标准滴定溶液的体积,mL ; C ——硝酸银标准滴定溶液的浓度,mol/L ; 0.0585——1.00mL 硝酸银标准滴定溶液相当于氯化钠的质量,g 。 五、数据记录及结果 (1)硝酸银的标定实验结果: (2)样品中氯化钠含量实验结果: 100100 350585.0)(21????-=c V V X
NaCl溶液液体表面张力系数与浓度的关系
大学物理创新性设计型实验 食品质量与安全1班1138113 沈梦佳 氯化钠溶液液体表面张力系数与浓度的关系 小组成员:张理、沈梦佳、谢雨岑、陈其才 摘要:钢针、硬币等物能飘在洁净的水表面,清晨小草叶上的露水通常收缩成小球形状。这些现象表明,液体表面好比一层紧绷的薄膜,有自然收缩趋势,从而导致表面张力现象。表面张力描述了液体表层附近分子力的宏观作用,液体的许多现象与表面张力有关。因此,研究液体表面张力系数与浓度的关系可为各行业有关液体分子的分布和表面的结构提供有用的线索。 引言:当液体和固体接触时,若固体和液体分子间的吸引力大于液体分子间的吸引力,液体就会沿固体表面扩展,形成薄膜附着在固体上,这种现象叫做浸润。若固体分子和液体分子间的吸引力小于液体分子间的吸引力,液体就不会在固体表面扩展,不附着在固体表面,这种现象称为不浸润。浸润与不浸润取决于液体、固体的性质。浸润性质与液体中杂质的含量、温度以及固体表面清洁程度密切相关。表面张力是描述物体浸润性质的重要物理量。 表面张力是指作用于液体表面上任意直线的两侧、垂直于该直线且平行于液面、并使液体具有收缩倾向的一种力。从微观上看,表面张力是由于液体表面层内分子作用的结果。可以用液体表面张力系数来定量的描述液体表面张力的大小。设想在液面上作长为L的线段,在L的两侧,表面张力以拉力的形式相互作用着,拉力的方向垂直于该线段,拉力的大小正比于L,即f=αL,式中α表示作用于线段单位长度上的表面张力,称为表面张力系数,其单位为N/m. 液体表面张力的大小与液体成分有关。温度对液体表面张力影响极大,表面张力随温度升高而减小,两者通常相当准确地成直线关系。所以在研究液体表面张力系数与浓度的关系时,必须要控制环境温度不变。 将表面洁净的铝合金吊环挂在测力计上并垂直浸入液体中,使液面下降,当吊环底面与液面平行或略高时,由于液体表面张力的作用,吊环的内、外壁会带起液膜。 在吊环临界脱离液体时,吊环重力mg、向上拉力F与液体表面张力f(忽略带起的液膜的重量)满足 f=F-mg
用掠入射法测定三棱镜和液体的折射率(1)
大学物理实验设计性实验 实 验 报 告 实验题目: 液体折射率的测定 浙江农林大林 物理实验室 实验日期:2012 年5 月29日 班 级: 姓 名: 学 号: 指导教师:
液体(水)的折射率测定 实验目的: 1.温习分光仪的结构,并掌握分光仪调节和使用方法 2. 学习用掠入射法测定三棱镜和待测液体的折射率 实验仪器 分光仪,钠光灯,毛玻璃,待测液体(水),三棱镜 实验原理: 1.分光仪的调节 (1)目测粗调 目测调节望远镜光轴﹑平行光管光轴﹑载物台平面,三者大致垂直于分光中心旋转轴。目测是重要的一部,是进一步细调的基础,可以缩短调整时间。 (2)望远镜的调焦,使之能接受平行光,调节步骤如下: 1.目测调焦 2.物镜调焦 (3)调节望远镜光轴及载物台面垂直于仪器中心转轴。 2.调节载物台下G2或G3两螺钉之一,使此h 缩短为h /2,在调节望远镜倾度调节螺钉,使十字反射像与十字叉丝重合。 3.旋转载物台,用“各半”调节法使另一反射面的十字反射像与“上十字叉丝”重合,这需要2,3两步反复调整数次,要细心,耐心。 4.将载物台转动90°后放在载物台,调节载物台下螺钉G1,使十字反射像与上十字叉丝重合。 2.用掠入射法测三棱镜的折射率 掠入射法测三棱镜折射率的原理如图23-1所示。按照图23-1摆好实验仪器,用扩展光钠光灯源(用钠光灯照亮的毛玻璃)照明该棱镜的折射面AB ,用望远镜对棱镜的另一个折射面AC 进行观测。在AB 界面上图中光线a 、b 、c 的入射角依次增大,而c 光线为掠入线(入射角为?90),对应的折射角为临界角,用望远镜看到的视场是半明半暗的,中间有明显的明暗分界线整体移动分光计或刻度盘使钠光灯大体位于AB 光学面的延长线上,用眼睛在出射光的方向找到一个明暗相间的分界线,再将望远镜转至该方位—望远镜看到的视场是半明半暗的,中间有明显的明暗分界线,使竖直“+”字叉丝对准明暗相间的分界线,将刻度盘固定记下左右游标读数1i 和2i 。记下转动望远镜AC 面的法线位置,记下两游标读数3i 和4i ,从而可求光线经过三棱镜的最小出射角i 。在棱镜中再也不可能有折射角大于c i 的光线。在AC 界面上,出射光a 、b 、c 的出射角依次减小,以c 光的入射角为?90,出射角'i 为最小,
化学实验报告配置氯化钠溶液
化学实验报告配置氯化 钠溶液 文件排版存档编号:[UYTR-OUPT28-KBNTL98-UYNN208]
化学实验报告【实验目的】 1、练习配制一定溶质质量分数或量浓度一定的溶液。 2、加深对溶质的质量分数以及量浓度概念的理解。 【实验器材】 托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。 氯化钠、浓盐酸溶液、蒸馏水、容量瓶、漏斗。 【实验步骤】 1、配置质量分数为6%的氯化钠溶液 (1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为: NaCl:50g*6%=3g ;水:47g。 (2)称量:用托盘天平称取所需的氯化钠,放入烧杯中。 (3)量取:用量筒量取所需的水(水的密度可近似看作1g/cm3),倒入盛有氯化钠的烧杯中。 (4)溶解:用玻璃棒搅拌,使氯化钠溶解。 2、用已配制好的质量分数为6%的氯化钠溶液(密度约为cm3),配制50g 质量分数为3%的氯化钠溶液。 (1)计算:所得溶液中,氯化钠的质量为50g*3%=,所以需要质量分数为6%的氯化钠溶液25g(体积为26ml),蒸馏水25g(体积约为25ml)(2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。 (3)混匀:用玻璃棒搅拌,使溶液混合均匀。
将上述配制好的溶液分别转入试剂瓶内,并贴上标签,区分开来。 3、配制250ml,2mol/L的稀盐酸 (1)计算所需浓盐酸的体积 设所需浓盐酸的体积为V 1 ,则 C 1*V 1 =*2mol/L 12mol/L*V 1 =*2mol/L 解得该体积为 (2)用量筒量取的浓盐酸 (3)在烧杯中加入少量(大大少于250ml)的水和量取好的浓盐酸,用玻璃棒搅拌稀释。 (4)使用漏斗将烧杯内的溶液转移到容量瓶中。 (5)用水洗涤盛过盐酸的量筒和烧杯,并把洗涤液转移至容量瓶。 (6)定容:用胶头滴管继续加水,直至溶液凹液面达到250ml刻度。 (7)压紧容量瓶瓶盖将溶液摇匀。
大学物理实验设计性实验液体折射率测定
评分:大学物理实验设计性实验实验报告 实验题目:液体折射率测定 班级: 姓名:学号: 指导教师:
《液体的折射率测定》实验提要 实验课题及任务 《液体的折射率测定》实验课题任务方案一:光从一种介质进入另一种介质时会发生折射现象,当入射击角为某一极值(掠射)时,会产生一特殊的光学现象,能同时看到有折射光和无折射光的现象,就可以实现液体折射率的测量。 学生根据自己所学的知识,并在图书馆或互联网上查找资料,设计出《液体的折射率测定》的整体方案,内容包括:(写出实验原理和理论计算公式,研究测量方法,写出实验内容和步骤),然后根据自己设计的方案,进行实验操作,记录数据,做好数据处理,得出实验结果,按书写科学论文的要求写出完整的实验报告。 设计要求 ⑴通过查找资料,并到实验室了解所用仪器的实物以及阅读仪器使用说明书,了解 仪器的使用方法,找出所要测量的物理量,并推导出计算公式,在此基础上写出该实验的实验原理。 ⑵选择实验的测量仪器,设计出实验方法和实验步骤,要具有可操作性。 ⑶测量5组数据,。 ⑷应该用什么方法处理数据,说明原因。 ⑸实验结果用标准形式表达,即用不确定度来表征测量结果的可信赖程度。 实验仪器 分光仪、钠光灯、毛玻璃与待测液体 实验提示 掠入射法测介质折射率的原理如图示3-1所示。将待测介质加工成三棱镜,用扩展光源(用钠光灯照光的大毛玻璃)照明该棱镜的折射面AB,用望远镜对棱镜的另一个折射面AC进行观测。在AB界面上图中光线a、b、c的入射角依次增大,而c光线 i。在棱镜中再也不可能有折射角为掠入线(入射角为 90),对应的折射角为临界角 c i的光线。在AC界面上,出射光a、b、c的出射角依次减小,以c光线的出射角大于 c 'i为最小。因此,用望远镜看到的视场是半明半暗的,中间有明显的明暗分界线。证
油脂中折射率的测定
项目二 油脂中折射率的测定 1实验目的及要求 (1)理解阿贝折光仪测定油脂折射率的原理。 (2)掌握阿贝折光仪的使用和测定方法。 2 测定意义: 油脂的折射率与油脂的组成和结构密切相关,可用来鉴别油脂 的种类和纯度。 油脂中脂肪酸的分子质量越大,不饱和程度越高,其折射率就越大。 油脂中若含有共轭双键和羟基的脂肪酸,其折射率也会偏高。 3 测定原理 (1) 折射现象和折光率 当一束光从一种各向同性的介质m 进入另一种各向同性的介质M 时,不仅光速会发生改变,如果传播方向不垂直于界面,还会发生折射现象,如图1所示。 图1 光在不同介质中的折射 光速在真空中的速度(v 真空)与某一介质中的速度(v 介质)之比定义为该介质的折光率,它等于入射角α与折射角β的正弦之比,即: βαλsin sin v ==介质真空v n t 在测定折光率时,一般光线都是从空气中射入介质中,除精密工作以外,通常都是以空气作为真空标准状态,故常以空气中测得的折光率作为某介质的折光率,即:
β αλsin sin v ==介质空气v n t 物质的折光率随入射光的波长λ、测定时的温度t 及物质的结构等因素而变化,所以,在测定折射率时必须注明所用的光线和温度。 当λ、t 一定时,物质的折光率是一个常数。例如 3611.120=D n 表示入射光波长为钠光D 线(λ=589.3nm ),温度为20℃时,介质的折光率为1.3611。 由于光在任何介质中的速度均小于它在真空中的速度,因此,所有介质的折光率都大于1,即入射角大于折射角。 阿贝尔折光仪测定液体介质折光率的原理 阿贝尔折光仪是根据临界折射现象设计的,如图2所示。 图2 阿贝折光仪的临界折射 入射角 ?=?90i 时,折射角i β最大,称临界折射角。如果从0?到90?(i ?)都有单色光入射,那么从到临界角i β也有折射光。换言之,在临界角i β以内的区域均有光线通过,该区是亮的,而在临界角以外的区域,由于折射光线消失而设有光线通过,故该区是暗的,两区将有一条明暗分界线,有分界线的位置可测出临界角i β。 当i i ββα==?,90时,i i n t ββλsin 1sin 90sin ==? (3) 仪器结构 图(3)是一种典型的阿贝折光仪的结构示意图,图 (4)是它的外形图(辅助棱镜呈开启状态)。
氯化钠样品含量的测定
氯化钠样品含量的测定 一、教学目标 1.理解吸附指示剂法的实验原理。 2.掌握用吸附指示剂法测定氯化钠样含量的方法。 二、教学重点 1.吸附指示剂法反应条件的控制。 2.用荧光黄指示剂确定滴定终点。 三、教学重点 1.吸附指示剂法的实验原理。 2.吸附指示剂法反应条件的控制。 四、教学方法 理论讲授与实践操作相结合。 五、教学过程 (一)引入新课(5分钟) 食盐是人们生活中必需的一种调味品。食盐的原料,可作为各种食品的防腐剂。食盐的主要成分是氯化钠。因此,氯化钠样品含量测定的方法具有很强的实践性和可操作性。 (二)复习(5分钟) 沉淀法是以沉淀反应为基础的一种滴定分析法。沉淀反应很多,但用于沉淀滴定的反应并不多。因为很多沉淀的组成不恒定,或溶解度较大,或易形成过饱和溶液,或达到平衡的速度慢,或共沉淀现象 严重等。所以,用于沉淀滴定反应必须符合下列条件:
(1)生成的沉淀溶解度必须很小,组成恒定。 (2)沉淀反应迅速,定量地完成。 (3)有确定终点的简单方法。 基于上述条件: 目前应用较多的是银量法。 银量法: 利用生成难溶性银盐反应进行滴定分析的方法。 根据所用指示剂的不同,银量法分为铬酸钾指示剂法、铁铵矾指示剂法和吸附指示剂法。本节讨论吸附指示剂法。 (三)授新课(70分钟,其中,理论30分钟,实践40分钟,实践包括小结与讨论) 1、实验原理 吸附指示剂法是利用吸附作用在终点时生成带正电荷的卤化银胶粒而吸附指示剂阴离子,使指示剂的结构发生改变,生成有色的吸附化合物指示终点。其原理可表示为: 滴定前: HFI H+ +FI- (呈xx) 终点前: (AgCl)?Cl- +FI-
用掠入射法测液体的折射率
用掠入射法测液体的折射率 班级:学号:姓名:联系方式: 实验时间: 摘要:分光计是一种精确测量入射光和出射光之间偏转角度的典型光学仪器,用测量精度较高的掠入射法测液体的折射率,先测出三棱镜的顶角及其折射率,从而进一步求出液体的折射率。 关键词:分光计、掠入射法、折射率 一、引言: 折射率为一光学常数,是反映透明介质材料光学性质的一个重要参数。在生产和科学研究中往往需要测定一些固体和液体的折射率。测定透明材料折射率的方法很多,最小偏向角法和掠入射法是比较常用的两种方法。最小偏向角法具有测量精度高、所测折射率的大小不受限制等优点。但是,被测材料要制成棱镜,而且对棱镜的技术条件要求高、不便快速测量。掠入射法虽然测量精度较底、被测折射率的大小受到限制,对于固体材料也需要制成试件,但是,掠入射法具有操作方便迅速、环境条件要求底等优点。 二、实验任务: 1.调节分光仪使其满足测量条件。 2.用掠入射法测量出透明液体的折射率。 三、实验仪器 JJY型分光仪计一台(本实验不提供平面镜),三棱镜一个,钠灯一个,黑玻璃一块,水槽一个,水。 四、实验原理 1.分光仪的调节 (1)目测粗调目测调节望远镜光轴﹑平行光管光轴﹑载物台平面,三者大致垂直于分光中心旋转轴。 (2)望远镜的调焦,使之能接受平行光,调节步骤如下: ①目测调焦。先通电照明,再旋转目镜调节手轮,调整目镜与分划线相对位置,使叉丝与小十字变清晰为止。 ②物镜调焦。将载物台紧贴台基,置平面镜于台上,使平面镜放置时,与平面与载物台下螺钉G2,G3连线垂直,再使望远镜光轴大致垂直平面镜,再调望远镜倾度调节螺钉,左右转动载物台,使之能看到十字反射像,然后松开调焦锁紧螺母,前后调节目镜镜筒并调节分划板与物镜相对位置,是小十字及其反射镜皆十分清晰为止,最后消除视差—微调目镜系统,眼睛左右移动时,小十字反射像与叉丝无相对位移。
氯化钠标准滴定溶液
氯化钠标准滴定溶液 c(NaCl)=0. 1 mol/L 4. 19.1 方法一 4.19.1.1 配制 称取5. 9 g氯化钠,溶于1 000 ml水中,摇匀。 4. 19. 1.2 标定 按GB/T 9725-1988的规定测定。其中:量取35.00 ml-40.00 ml配制好的抓化钠溶液,加40 ml水、10 ml淀粉溶液(10 g/L),以216型银电极作指示电极,217型双盐桥饱和甘汞电极作参比电极,用硝酸银标准滴定溶液[c(AgNO3)=0.1 mol/L]滴定,并按GB/T 9725-1988中6.2.2条的规定计算V0。 氯化钠标准滴定溶液的浓度〔c(NaCI) ] ,数值以摩尔每升(mol/1.)表示,按式(23)计算: c(NaCI)=V0C1/V (23) 式中: Vo:硝酸银标准滴定溶液的体积的数值,单位为毫升(ml) ; C1:硝酸银标准滴定溶液的浓度的准确数值,单位为摩尔每升(mol/L) V:氯化钠溶液的体积的准确数值,单位为毫升(ml), 4. 19.2 方法二 称取5. 84 g士0.30 g已在550℃士50℃的高温炉中灼烧至恒重的工作基准试剂氯化钠,溶于水,移人1 000 ml容量瓶中,稀释至刻度。 氯化钠标准滴定溶液的浓度[c(NaCI)],数值以摩尔每升(mol/L)表示,按式(24)计算: c(NaCI)= 1 000m / MV (24) 式中: M:氯化钠的质量的准确数值,单位为克((g) ; V:氯化钠溶液的体积的准确数值,单位为毫升(ml) ; M:氯化钠的摩尔质量的数值,单位为克每摩尔(g/mol) [M(NaCI) = 58. 442] ,
氯化钠
氯化钠 百科名片 氯化钠 氯化钠,无色立方结晶或白色结晶。溶于水、甘油,微溶于乙醇、液氨。不溶于盐酸。在空气中微有潮解性。用于制造纯碱和烧碱及其他化工产品,矿石冶炼。食品工业和渔业用于盐腌,还可用作调味料的原料和精制食盐。 目录[隐藏] 成份/组成信息 化学性质 检验方法 危险性概述 急救措施 消防措施 泄漏应急处理 操作处置与储存 成份/组成信息 化学性质 检验方法 危险性概述 急救措施 消防措施 泄漏应急处理 操作处置与储存 ?接触控制/个体防护 ?理化特性 ?稳定性和反应活性 ?毒理学资料 ?生态学资料 ?废弃处理 ?运输信息 ?法规信息 ?治疗病症 ?食盐的妙用
氯化钠 化学品标识 化学品中文名称:氯化钠 中文拼音:lǜ huà nà 英文名:Sodium Chloride,Salt 化学品化学式:NaCl 化学品俗名或商品名:食盐 所属类别:盐 相对分子质量:58.44(化学计算时取58.5) 氯化钠 物理性质:密度2.165g/cm3(25℃)。熔点800.7℃。沸点1465℃。由海水(平均含2.4%氯化钠)引入盐田,经日晒干燥,浓缩结晶,制得粗品,粗盐中因含有杂质,在空气中较易潮解。亦可将海水,经蒸汽加温,砂滤器过滤,用离子交换膜电渗析法进行浓缩,得到盐水(含氯化钠160~180g/L)经蒸发析出盐卤石膏,离心分离,制得的氯化钠95%以上(水分2%)再经干燥可制得食盐(table salt)。还可用岩盐、盐湖盐水为原料,经日晒干燥,制得原盐。用地下盐水和井盐为原料时,通过三效或四效蒸发浓缩,析出结晶,离心分离制得。 CAS号:7647-14-5 EINECS登录号:231-598-3 成份/组成信息
阿贝折光仪测液体折射率
实验一 阿贝折光仪测液体物质折射率 折射率是物质的重要光学常数之一,能借以了解物质的光学性能、纯度、及浓度大小等.在分光计的使用实验中将给出固体(玻璃)折射率的测定方法,本实验采用阿贝折光仪测定液体折射率. 实 验 目 的 (1) 学习用掠入射法测量液体折射率的原理; (2) 了解阿贝折光仪的结构和工作原理,学会使用该仪器测量液体的折射率. 实 验 仪 器 阿贝折光仪,滴管,蒸馏水,无水酒精,少许脱脂棉,待测液体(水). 实 验 原 理 光线从光密介质进入 光疏介质,入射角小于折射 角.逐渐加大入射角,可使 折射角达到90?.折射角等 于90?时的入射角称为临界 角.反过来,若光线自光疏 介质进入光密介质,入射角 大于折射角.当光线以90? 角入射(掠射)时仍有光线 进入光密介质,此时的折射 角亦为临界角.本实验测量折射率的原理及阿贝折射 计的工作原理,就是基于测 定临界角的原理. 1 1 掠入射法测量液体的折射率 如图1.3所示,在一折射棱镜的AB 面上充满了折射率为n 1的液体,棱镜的折射率n 2> n 1.若以单色的扩展光源照射分界面AB 时, 从图1.3可看出:入射角为90?的光线1将掠射到AB 界面而折射进入三棱镜内.显然,光线1经折射面AB 后的折射角i '正如发生全反射时 的临界角,因而满足 21 sin n n i ='
(1.1) 当掠入射光线1经折射到A C面,再经折射而进入空气时,设在AC 面上的入射角为ψ,折射角为φ,则有 ψ?sin sin 2n = (1.2) 除掠入射光线1外,其它光线如光线2在AB 面上的入射角均小于90?,因此经三棱镜折射,最后从AC 面折射进入空气时,都在光线i '的左侧.由于入射角i 不可能比90?大,因而在三棱镜内不可能出现比临界角i '大的光线,即AC 面上出射的光线中,没有比φ角小的折射光线,故称φ为极限角.当用望远镜对准AC 面观察时,视场中将看到明暗两部分,其分界线就是i =90?的掠入射引起的极限角方向. 由图1.3中的光路图可知:三棱镜的棱镜角A 与角i '及角ψ有如下关系: ψ+'=i A , 即 ψ-='A i . (1.3) 应用式(1.3),并从式(1.1)和式(1.2)中消去i '和ψ后可得 ??sin cos sin sin ?--=A n A n 2221 . (1.4) 如果棱镜角A =90°,则 ?2221sin -=n n . (1.5) 因此,当直角三棱镜的折射率n 2为已知时,测出φ角后即可计算出待 测液体的折射率n 1.上述测定折射率的方 法即为掠入射法. 2 阿贝折光仪的测量原理及仪器结构 阿贝折光仪是测量透明、半透明液体 或固体折射率的常用仪器.国产的阿贝计 的测量范围为 1.3000~1.7000(精度为 ±0.0002).若该仪器接上恒温器,则可测 定温度为0℃~70℃内的折射率n . 阿贝折光仪也是根据全反射原理设计 的.它有两种工作方式,即透射式和反射 式.本实验只要求采用透射式方法测量透 明液体的折射率.透射式测量光路如图所 示. 将折射率为n 的待测液体放置在折射
硫酸浓度与比重对照表
硫酸浓度与比重对照表
硝酸的百分比浓度、当量浓度及比重对照表 1.0036 1.1609 1.0152 1.1733 1.0543 1.2213 1.0661 1.2335 盐酸浓度与比重对照表 HCL含量( 克 ) 比重20/4℃HCL含量( 克 ) 比重 20/4℃ 100g中含 量 1升中含量100g中含量1升中含量
1 10.03 1.003 2 2 243.8 1.108 2 20.16 1.008 24 268.5 1.119 4 40.72 1.018 26 293. 5 1.129 6 61.6 7 1. 02 8 28 319.0 1.139 8 83.01 1.038 30 344.8 1.149 10 104.7 1.047 32 371.0 1.159 12 126.9 1.057 34 397.5 1.169 14 149.5 1.068 36 424.4 1.179 16 172.4 1.078 38 451.6 1.189 18 195.8 1.088 40 479.2 1.198 20 219.6 1.098 磷酸浓度与比重对照表 H3PO含量( 克 ) 比重 20/4 ℃H3PO含量( 克 ) 比重 20/4 ℃ 100g中含量1升中含量100g中含量1升中含量 1 10.04 1.004 55 758.5 1.379 3 30.49 1.01 4 60 855.6 1.426 5 51.37 1.025 65 958.8 1.475 8 83.36 1.042 70 1068 1.526 10 105.3 1.053 75 1184 1.579 15 162.4 1.082 80 1306 1.633 20 222.7 1.113 85 1436 1.689 25 286.6 1.146 90 1571 1.746 30 354.2 1.180 96 1746 1.819 35 425.6 1.216 98 1807 1.844
氯化钠溶液浓度的测定~(doc文档)
课题2氯化钠溶液浓度的测定实验原理: 氯化钠是无色的电解质溶液,在稀溶液范围内,氯化钠溶液的电导率与其浓度成正比,即氯化钠溶液的浓度越大,电导率越大。 准备五个已知浓度的氯化钠溶液,测其电导率,可作出电导率-浓度图,通过直线回归可得工作曲线。然后测未知氯化钠溶液的电导率,根据工作曲线即可找出对应的浓度值。 实验仪器: CBL系统、TI-83 Plus图形计算器、电导率探头、试管(×5)、吸水纸、电子天平、100毫升容量瓶、10毫升吸量管(×2)、洗耳球、100毫升烧杯(×2)、玻璃棒。实验试剂: 氯化钠晶体、蒸馏水、5毫升未知浓度的氯化钠溶液。 实验步骤: 1. 称取0.585gNaCl晶体,配制成100mL溶液(浓度为0.10mol/L)。 2. 按下表分别在五根试管中配制五个已知浓度的氯化钠溶液: 编号0.10mol/LNaCl溶液(mL)H2O(mL)浓度(mol/L) 1 2 8 0.02 2 4 6 0.04 3 6 4 0.06 4 8 2 0.08 5 10 0 0.10 4. 打开CBL和图形计算器的电源,按计算器上蓝色的APPS 键,选择3:ChemBio,运行ChemBio程序至主菜单“MAIN MENU”。(图1、2、3) 图1 图2
图3 图4 5. 在图形计算器中设置电导率探头。 ?在“MAIN MENU”中选择1:SET UP PROBES。(图4) ?按 1 ENTER 输入电极的数目。(图5) 图5 图6 ?在“SELECT PROBE”菜单中选择6:CONDUCTIVITY。(图6) ?按ENTER 。(图7) ?按 1 ENTER 作为通道的编号。(图8) 图7 图8 ?选择1:USE STORED,用已储存的校准值。(图9) 图9 ?选择5:H 0-20000 MICS为量程,并把电导率探头上的量程开关也调到相应位置。
固体与液体折射率的测定
实验5-16 固体与液体折射率的测定 实验讲义 单位:物理实验中心 教师姓名:王殿生
实验5—16 固体与液体折射率的测定 (一)教学基本要求 1.掌握利用显微镜测量透明固体和液体折射率的基本原理。 2.了解测量显微镜的结构和使用方法,主要包括读数方法和调焦方法。 3.学会利用合适标志正确调焦在液体上下表面的方法。 4.介绍物质折射率与光波波长、温度等因素有关的概念。 (二)讲课提纲 1.实验简介 折射率是透明物质的一个重要的物理参数,它反映了物质的基本光学性质。物质的折射率不但与它的分子结构和光线的波长有关,而且与物质的密度、温度、压力等因素有关。实际工作中有时也需要通过测量折射率来反求物质的密度、浓度等。 实验所用仪器主要是测量显微镜,使用显微镜准确确定待测位置,通过显微镜上的读数机构进行定量测量。测量折射率的基本方法是利用光的折射原理。实验主要目的是学会一种测量物质折射率的方法。 2.测量与数据处理要求 (1)具体测量方法和步骤自己想办法,不统一讲解。(自学成才、相互讨论、问老师等均可) (2)固体和液体的折射率均要求测量5次,5次的A点位置基本固定。 (测量技巧,A-B-C点依次测量,先将微调调到最下端,调节镜筒看清第一片上的A点读数,此后不能再调节镜筒焦距,放上第二片向上调节微调看清B点读数,继续向上调节微调看清C点读数,完成一次测量;然后C-B-A倒序测量。如此反复,测量5次。) (3)列表记录数据,表格规范,不能使用铅笔记录数据。 (4)测量数据签字时检查具体的测量操作过程,不能在签字之前整理实验仪器,保持测量原貌,特别是液体不能倒掉。 (5)充分熟悉测量显微镜的功能,注意实验过程中调节技巧和读数放大镜的使用。 (6)先想后做,边做边想,边想边做,动脑和动手相互结合,相互促进。 (7)数据处理时,计算折射率不确定度,表示实验结果。 3.问题思考与讨论 (1)测量固体玻璃折射率时,测量厚玻璃片好还是薄玻璃片好? (2)测量液体水折射率时,烧杯中水多一点好还是少一点好?
实验五 生理盐水中氯化钠的含量测定
实验五生理盐水中氯化钠的含量测定 一、实验目的 了解:沉淀滴定法测定氯化钠含量的基本过程和特点。 理解:沉淀滴定的基本原理。 掌握:沉淀滴定法的基本操作技术。 二、实验原理 1. 莫尔法 中性或弱碱性溶液中,以K2CrO4为指示剂,用AgNO3标准溶液滴定氯化物。 AgCl的溶解度<Ag2CrO4的溶解度,因此溶液中首先析出AgCl沉淀,当达到终点后,过量的AgNO3与CrO42-生成砖红色沉淀。 Ag++Cl-AgCl(白色) 2Ag++ CrO42-Ag2CrO4(砖红色) 2. 佛尔哈德法 在含Cl-的酸性溶液中,加入一定量过量的Ag+标准溶液,定量生成AgCl沉淀后过量的Ag+以铁铵矾为指示剂,用NH4SCN标准溶液进行返滴定,由Fe(SCN)2+络离子的红色,指示滴定终点,主要反应如下: Ag++Cl?=AgCl (白色),K ap=1.8×10-10 Ag++SCN?=AgSCN (白色),K ap=1.0×10-12 Fe3++ SCN?=Fe(SCN) 2+(红色),K l=138 指示剂用量大小对滴定有影响,一般控制Fe3+浓度为0.015mol·L-1为宜。 滴定时,控制氢离子浓度为0.1~1 mol·L-1,激烈摇动溶液,并加入硝基苯(有毒!)保护AgCl沉淀,使其与溶液隔开,防止AgCl沉淀与SCN-发生交换反应而消耗滴定剂。 3. 法扬司法 用AgNO3滴定Cl-,以荧光黄作指示剂,荧光黄先在溶液中解离(pH为7~10): HFIn H++FIn? FIn?在溶液中呈黄绿色。在化学计量点前AgCl沉淀吸附Cl?,这时FIn?不被吸附,溶液呈黄绿色。当滴定达到化学计量点时,稍过量的Ag+被AgCl沉淀吸附形成AgCl ·Ag+,而AgCl ·Ag+强烈吸附FIn?,使其结构发生变化而呈粉红色,以此指示滴定终点。 AgCl ·Ag+ + FIn?-AgCl ·Ag+· FIn?- 黄绿色粉红色 三、实验操作步骤 1. 莫尔法 准确量取生理盐水7.00mL于250mL锥形瓶中,平行3份,分别加蒸馏水20mL和2.5%K2CrO4指示剂溶液1mL,在充分振荡下,用AgNO3标准溶液滴定至溶液生成砖红色沉淀。计算生理盐水中氯化物的含量。 2. 佛尔哈德法 (1)NH4SCN标准溶液的标定 准确吸取25.00mL AgNO3标准溶液于250mL锥形瓶中,平行3份,分别加入50%HNO3溶液5mL,铁铵矾指示剂1mL,用NH4SCN标准溶液滴定(滴定时需剧烈摇动溶液)至溶
液体折射率的测定
液体折射率的测定 班级 学号 姓名 实验时间 摘要:根据光的折射定律,提出了用掠入射法简捷,精确地测量液体折射率的方法.利用分 光计和简单的器件,通过一次测量精确地求得液体折射率.该方法简捷,准确度高,可用于生 产在线检测,在实际生产中有应用价值. 关键字:掠入射法;液体折射率 引言: 在食品、化工,医药等生产等生产部门,生产过程中经常要检测液体的浓度,大多数液 体的折射率和浓度有一定的关系.液体折射率常用阿贝折射计、读数显微镜等仪器进行测量. 虽然阿贝折射计精度高,但要接触式测量,是非在线检测,给生产检控带来不便.读数显微 镜虽可用在非接触式测量,但其精度不是很好,有一定的局限性,特别在医药行业浓度的精 确度要求较高时往往达不到较理想的要求.改用掠入法只需常用仪器分光计及附件三棱镜, 可用来在线检测,仪器普通、测量简捷、精确度高,在工业生产中有实用意义. 原理简述: 1.用掠入射法测三棱镜的折射率 掠入射法测三棱镜折射率 的原理如图①所示. 按照图①摆好实验仪器, 用扩展光钠光灯源(用钠光灯 照亮的毛玻璃)照明该棱镜的 折射面AB ,用望远镜对棱镜 图① 掠入射法测三棱镜折射率的原理 的另一个折射面AC 进行观测. 在AB 界面上图中光线a 、b 、c 的入射角依次增大,而c 光线为掠入线(入射角为 90), 对应的折射角为临界角,用望远镜看到的视场是半明半暗的,中间有明显的明暗分界线整体 移动分光计或刻度盘使钠光灯大体位于AB 光学面的延长线上,用眼睛在出射光的方向找到 一个明暗相间的分界线,再将望远镜转至该方位—望远镜看到的视场是半明半暗的,中间有 明显的明暗分界线,使竖直“+”字叉丝对准明暗相间的分界线,将刻度盘固定记下左右游 标读数1i 和2i .记下转动望远镜AC 面的法线位置,记下两游标读数3i 和4i ,从而可求光线经 过三棱镜的最小出射角i 。在棱镜中再也不可能有折射角大于c i 的光线.在AC 界面上,出射
折光率的测定
化学与化工学院实验课程教案模板(试行) 实验名称液体有机物折光率的测定 一、实验目的要求: 1、熟悉xx折光仪的构造 2、掌握液体有机化合物折光率的测定方法。 二、实验重点与难点: 1、重点: xx折光仪的构造 2、难点: 折光率的测定方法 三、实验教学方法与手段: xxxx,演示xx 四、实验用品(主要仪器与试剂): 1、试剂: 丙酮(或乙醚、乙醇等有机溶剂)1-溴代萘 2、仪器: xx折光仪 五、实验原理: 1、折光率: 空气
光线从一种xx质进入另一种xx, 质时光的传播方向会发生改变,这 种现象称为光的折射。如右图所示。 引起光的折射的原因是光在不同xx 质中的传播速度不同。 光在空气中的传播速度与它在 液体中的传播速度之比叫做该液体 液体 的折光率。根据光的折射定律,液 体的折射率等于入射角与折射角的 正弦之比。 ntλ=v空/v液=sinα/sinβ 折光率是有机化合物的特征常数,通过测定折光率可以确定有机化合物的纯度及溶液的 组成,也可用于未知物的鉴定。 折光率随入射光的波长λ、测定时的温度t、物质的结构等因素而变化。所以表示物质的折光率时必须标明所用光线的波长和测定温度,当λ和t一定时,折光率是一个常数。常用nDt表示,D表示钠光。 2、xx折射仪: 阿贝折射仪主要有反射镜、直角棱镜、阿米西消色棱镜、读数镜、望远目镜组成。结合实物具体讲述仪器的各 六、实验步骤:
1、仪器校正 (1)准备: 从箱中取出仪器,放在工作台上,在温度计套中插入温度计,通入恒温水,当温度恒定后,松开直角棱镜锁扭,分开直角棱镜,在光滑镜面上滴加2滴丙酮(或乙醚、乙醇等有机溶剂),合上棱镜,使上下棱镜润湿,洗去镜面污物,再打开棱镜,用擦镜纸擦干镜面或晾干。 (2)校正: 将直角棱镜打开,用少许1-溴代萘将标准玻璃块(没有刻度的一面)粘附于光滑棱镜面上,标准玻璃块另一个抛光面应向上,以接受光线,转动棱镜手论,使读数境内标尺读数等于标准玻璃块上的刻示值(读数时打开小反光镜)。然后观察望远目镜中明暗分界线是否在十字交叉点上,如有偏差,用方孔调节扳手转动示值调节螺钉,使明暗分界线在十字交叉点处。校正工作结束。 2、测定: 做好准备工作后,打开棱镜,用滴管滴加2~3滴待测液体于磨砂镜面上,使其分布均匀,合上棱镜,锁紧锁扭, 调节底部反射镜,使目境内视场明亮,调节望远镜使视场清晰。转动手轮,直到在目镜中看到明暗分界的视场,如有彩色光带,转动阿米西棱镜手轮,使彩色消去,视场内明暗分界十分清晰。继续转动棱镜手轮,使明暗分界线在十字交叉处,如图所示。在读数镜筒中读取折光率数值(记住打开小反光镜)。再让分界线上下移动重新调到十字交叉点处,读取读数,重复操作3~5次,取读数平均值作为样品的折光率。 测量完毕,打开棱镜,用丙酮洗净棱镜面,擦干或晾干后,合上棱镜,锁紧锁扭,将仪器放好。 非临界视场非临界视场 七、注意事项:
化学实验报告配置氯化钠溶液
化学实验报告 【实验目的】 1、练习配制一定溶质质量分数或量浓度一定的溶液。 2、加深对溶质的质量分数以及量浓度概念的理解。 【实验器材】 托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。 氯化钠、浓盐酸溶液、蒸馏水、容量瓶、漏斗。 【实验步骤】 1、配置质量分数为6%的氯化钠溶液 (1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:NaCl:50g*6%=3g ;水:47g。 (2)称量:用托盘天平称取所需的氯化钠,放入烧杯中。 (3)量取:用量筒量取所需的水(水的密度可近似看作1g/cm3),倒入盛有氯化钠的烧杯中。 (4)溶解:用玻璃棒搅拌,使氯化钠溶解。 2、用已配制好的质量分数为6%的氯化钠溶液(密度约为cm3),配制50g质量分数为3%的氯化钠溶液。 (1)计算:所得溶液中,氯化钠的质量为50g*3%=,所以需要质量分数为6%的氯化钠溶液25g(体积为26ml),蒸馏水25g(体积约为25ml) (2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。 (3)混匀:用玻璃棒搅拌,使溶液混合均匀。 将上述配制好的溶液分别转入试剂瓶内,并贴上标签,区分开来。 3、配制250ml,2mol/L的稀盐酸 (1)计算所需浓盐酸的体积 设所需浓盐酸的体积为V1,则 C1*V1=*2mol/L 12mol/L*V1=*2mol/L 解得该体积为 (2)用量筒量取的浓盐酸 (3)在烧杯中加入少量(大大少于250ml)的水和量取好的浓盐酸,用玻璃棒搅拌稀释。 (4)使用漏斗将烧杯内的溶液转移到容量瓶中。 (5)用水洗涤盛过盐酸的量筒和烧杯,并把洗涤液转移至容量瓶。 (6)定容:用胶头滴管继续加水,直至溶液凹液面达到250ml刻度。 (7)压紧容量瓶瓶盖将溶液摇匀。
- 氯化钠样品含量的测定
- 氯化钠含量测定
- 氯化钠含量的测定(法扬司法实验方案)
- 氯化钠溶液浓度的测定
- 实验五 生理盐水中含氯化钠含量的测定归纳.ppt
- 氯化钠样品含量的测定
- 氯化钠含量测定
- 关于低浓度的NaCl水溶液的浓度测定
- 一定溶质质量分数的氯化钠溶液的配制实验报告单
- 生理盐水中氯化钠含量的测定精编版
- 生理盐水中氯化钠含量的测定(银量法) 实验报告
- 工业盐中NaCl含量的测定-资料
- 化学实验操作试卷—配制100g5%的NaCl溶液
- 氯化钠检测方法
- 沪教初三化学溶液的浓度过关测试含答案
- 氯化钠标准滴定溶液
- 氯化钠溶液不同浓度都折射率的影响doc资料
- 实验五 生理盐水中含氯化钠含量的测定
- 生理盐水中氯化钠含量的测 定
- NaCl溶液液体表面张力系数与浓度的关系
