实验五 液体饱和蒸气压的测定

实验四 液体饱和蒸气压的测定
一、实验目的
1. 明确纯液体饱和蒸气压的定义和气液两相平衡的概念。深入了解纯液体饱和蒸气压与温度的关系。
2. 用数字真空计测不同温度下异丙醇的饱和蒸气压,初步掌握低真空实验技术。
3. 学会用图解法求被测液体在实验温度范围内的平均摩尔汽化热与正常沸点。 二、实验原理
在一定温度下,与纯液体处于平衡状态时的蒸气压力,称为该温度下的饱和蒸气压。 纯液体的蒸气压是随温度变化而改变的,它们之间的关系可用克劳修斯—克拉贝龙方程式来表示:
(1) 式中p *为纯液体温度T 时的饱和蒸气压;T 为热力学温度;△vap H m 为该液体摩尔汽化热;R 为摩尔气体常数。如果温度的变化范围不大,△vap H m 视为常数,当作平均摩尔汽化热。将式(1)积分得:
(2) 式中C 为常数,此数与压力p 的单位有关。
由式(2)可知,在一定温度范围内,测定不同温度下的饱和蒸气压,以ln p 对1/T 作图,可得一直线。由该直线的斜率可求得实验温度范围内液体的平均摩尔汽化热。当外压为101325时,液体的蒸气压与外压相等时的T 称为该液体的正常沸点。从图中或计算也可求得其正常沸点。
三、仪器 试剂
蒸气压测定装置1套;真空泵1台;数字式气压计1台;电加热器1只;温度计2支;数字式真空计1台;磁力搅拌器1台;异丙醇(分析纯)。
四、实验步骤
1. 按仪器装置图接好测量线路,所有接口须严密封闭,将液体装入平衡管。
2. 系统检漏
缓慢旋转三通活塞,使系统通大气,开启冷却水,接通电源使真空泵正常运转后,调节活塞使系统减压至1104后关闭活塞,此时系统处于真空状态。若漏气则分段检查
2
ln RT H dT p d m
vap ?=C
RT
H p m
vap +?-=ln
直至不漏气才可进行实验。 3. 测不同温度下液体的饱和蒸气压
转动三通活塞使系统与大气相通,开动搅拌机并水浴加热。随温度逐渐上升平衡釜中有气泡逸出,后继续加热至 五、实验注意事项
1. 整个实验过程中,应保持等位计A 球液面上空的空气排净。
2. 抽气的速度要合适。必须防止等位计内液体沸腾过剧,致使B 管内液体被抽尽。
3. 蒸气压与温度有关,故测定过程中恒温槽的温度波动需控制在±0.1K 。
4. 实验过程中需防止B 管液体倒灌入A 球内,带入空气,使实验数据偏大。 六、数据记录及处理
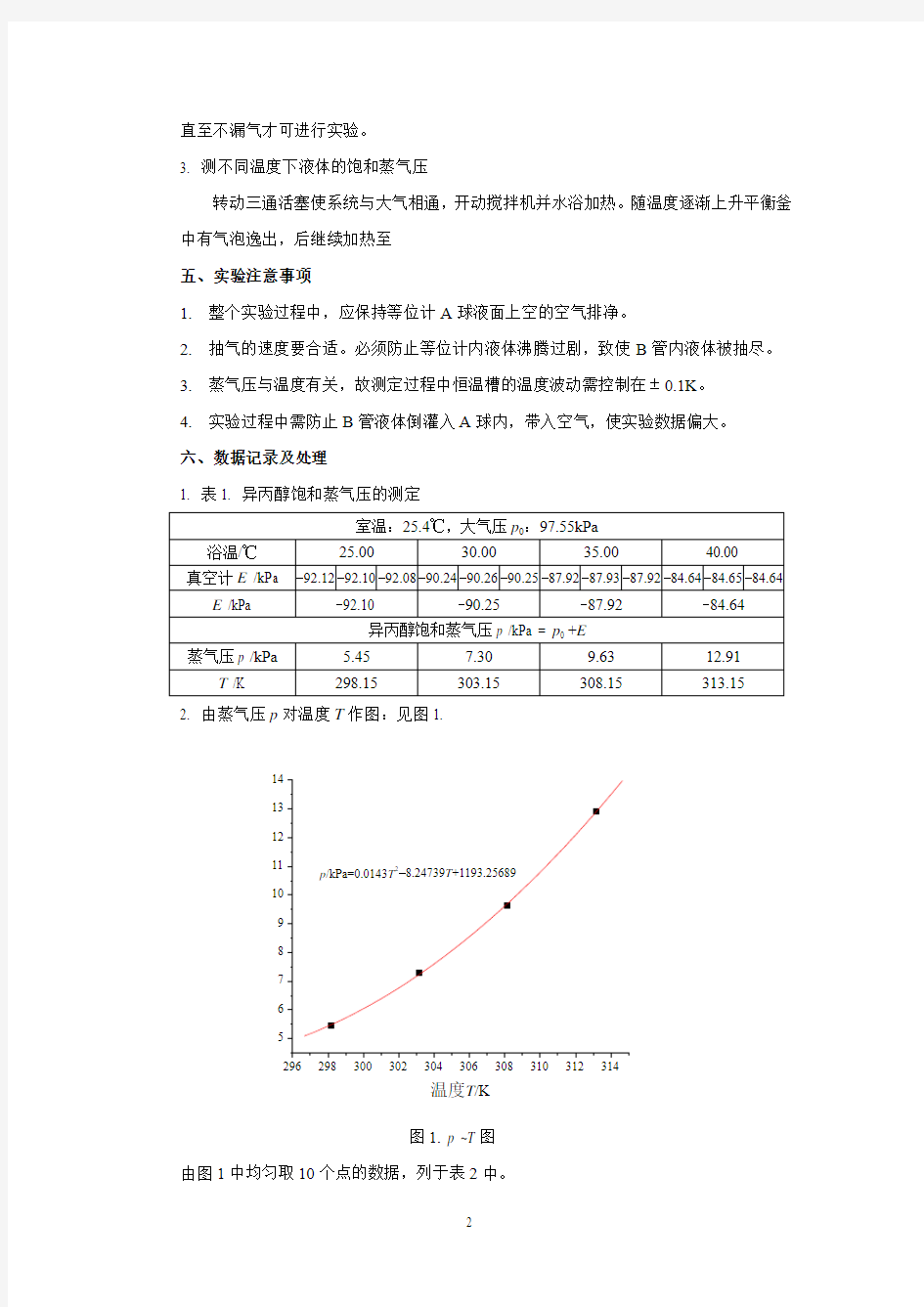
1. 表1. 异丙醇饱和蒸气压的测定
室温:25.4℃,大气压p 0:97.55kPa
浴温/℃ 25.00 30.00 35.00 40.00 真空计E /kPa -92.12
-92.10 -92.08 -90.24 -90.26 -90.25 -87.92 -87.93 -87.92 -84.64 -84.65 -84.64 E /kPa -92.10 -90.25 -87.92 -84.64 异丙醇饱和蒸气压p /kPa = p 0 +E
蒸气压p /kPa
5.45 7.30 9.63 12.91 T /K
298.15
303.15
308.15
313.15
2. 由蒸气压p 对温度T 作图:见图1.
296
298
300
302
304
306
308
310
312
314
567891011
121314蒸气压p /k P a
温度T /K
p /kPa=0.0143T 2
-8.24739T +1193.25689
图1. p ~T 图
由图1中均匀取10个点的数据,列于表2中。
表2. 异丙醇在温度T 时的饱和蒸气压p
3. 绘制ln p ~1/T 图:见图2.
3.20
3.22
3.24
3.26
3.28
3.30
3.32 3.34 3.36
1.6
1.8
2.0
2.2
2.4
2.6
l n p
1/T 10-3
K
-1
ln p =19.73968-5.38254×103
/T
图2. ln p ~1/T 图
4. 求平均摩尔汽化热
根据公式 和图2可知,斜率 = -5.38254×103
平均摩尔汽化热Δvap H m =5.38254×103×8.314=44.75kJ ·mol -1 5. 求正常沸点
在表2中取一个数据点:ln p =2.128,1/T =3.271×10-3 已知标准大气压p *=101.325kPa ,ln p *=4.618
上述数据代入公式ln p *-ln p = -5.38254×103 (1/T *-1/T )
4.618-2.128= -
5.38254×103 (1/T *-3.271×10-3),1/T *=2.808×10-3K -1,T *=35
6.1K 正常沸点t*=82.9℃(文献值:82.3℃)
或者根据方程:ln p =19.73968-5.38254×103/T 来求算:
T *=5.38254×103 /(19.73968-ln101.325)=355.96K ,正常沸点t*=82.8℃(文献值:82.3℃) 七、思考题
T /K 298.2 300..7 303.2 304.4 305.7 306.9 308.2 309.4 310.7 311.9 p /k Pa
5.487
6.280
7.251 7.780
8.400
9.016 9.729 10.43 11.24 12.02
1/T /10-3K -1 3.353 3.326 3.298 3.285 3.271 3.258 3.245 3.232 3.219 3.206
ln p
1.702 1.837 1.981
2.052 2.128 2.199 2.275 2.345 2.419 2.487
C RT
H p m
vap +?-=ln R H m vap ?-=
1、本实验方法能否用于测定溶液的蒸气压,为什么?
答:一般不能。溶液的蒸气中易挥发组分的浓度大于本体浓度,蒸气被抽走后,溶液本体浓度会改变,导致蒸气压一直在变而无法测定;若是恒沸溶液则可以测定。
2、温度愈高测出的蒸气压误差愈大,为什么?
答:首先,因为本实验是假定?vap H m(平均摩尔汽化热)在一定范围内不变,但是当温度升得较高时,?vap H m的真值与假设值之间存在较大偏差,所以会使得实验结果产生误差。
温度越高,温度波动越大,蒸气压也随之波动,无法稳定。
