双萤光素酶报告基因的应用,常见载体及案例简介

双萤光素酶报告基因的应用,常见载体及案例简介双萤光素酶报告基因检测(Dual-Luciferase Reporter Assay)通常以萤火虫萤光素酶(Firefly luciferase)为报告基因,以海肾萤光素酶(Renilla luciferase)为内参基因。所构成的报告系统具有灵敏度高、动态范围广、应用灵活等优势,广泛用于基因调控、非编码RNA靶向互作等研究领域。
Firefly luciferase(简称F-Luc)以萤光素(luciferin)为底物,在Mg2+、ATP和氧分子存在条件下,催化luciferin氧化成oxyluciferin,在此过程中发出最强波长在560nm 左右的生物萤光(bioluminescence)。F-Luc表达框的上游启动子区域插不同功能序列,可以通过转录起始条件造成其报告萤光的变化。在F-Luc的3’UTR区域插入待验证的靶序列,通过其翻译抑制或mRNA稳定性降低,可以反映是否存在靶向互作。
Renilla luciferase(简称R-Luc)以腔肠素(coelenterazine)为底物,在氧分子存在的条件下催化coelenterazine氧化生成coelenteramide,此过程中发出最强波长在465nm 左右的生物萤光。R-Luc通常由固定组成型启动子驱动,在报告系统中作为校正input误差的内参信号。
生物萤光产生反应式
一、应用方向
1. 验证microRNA同mRNA靶向互作。将待测mRNA的3’UTR序列插入报告基因载体,再共转入该microRNA,如果萤光素酶活性下降,则提示为其靶序列。
2. 验证microRNA同lncRNA靶向互作。将候选的lncRNA序列插入报告基因载体中F-Luc 的3’UTR区域,检测萤光素活性。
3. 启动子结构分析。将启动子区域序列(通常2k左右)进行分段截短,或对特定位点进行突变,再分别构建入luciferase报告载体,检测其启动子活性。
4. 启动子SNP分析。一些基因的启动子区域存在单核苷酸多态性,可运用萤光素酶报告系统分析其相对活性。
5. 验证特定转录因子同其调控序列的作用。将该序列(通常为启动子区域)插入报告基因载体,同时在实验细胞中共转过表达该转录因子,可分析转录因子过表达是否提高萤光素酶活性。
6. 可以分析信号通路是否激活。将该信号通路的下游响应原件序列构建入报告基因载体,在不同上游信号条件下,萤光素酶活性代表了通路的下游响应。例如,在GPCR研究中,将cAMP response element(CRE)载入报告基因载体,构建稳定表达细胞株后,可以用于分析GPCR的激活与抑制剂筛选。又如,将HIF1α的响应原件hypoxia-responsive element (HRE)插入luciferase报告载体构建稳转细胞株,可以用于低氧相关通路的研究。
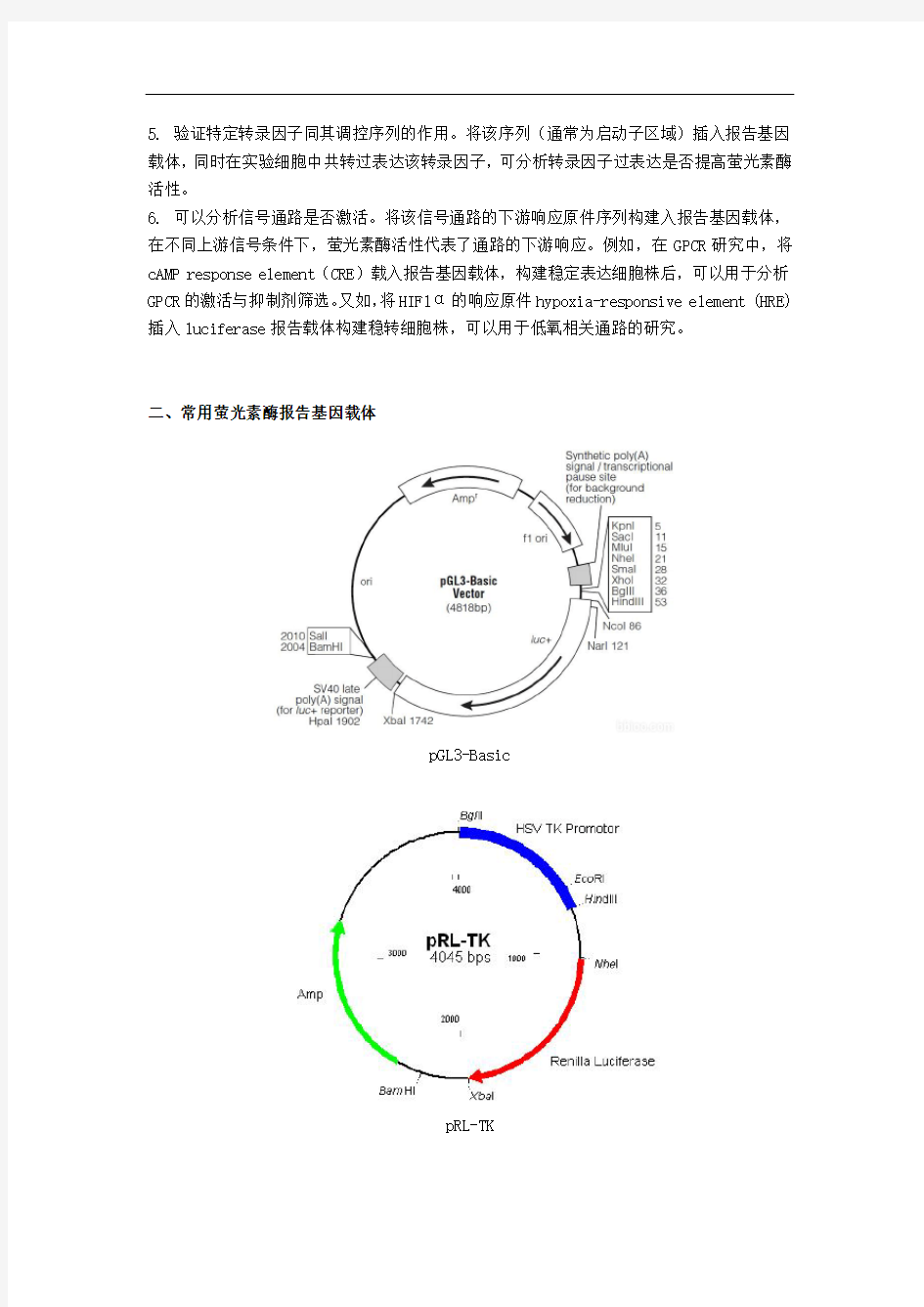
二、常用萤光素酶报告基因载体
pGL3-Basic
pRL-TK
pmirGLO
三、经典案例
案例一
题目:Long non-coding RNA linc00673 regulatednon-small cell lung cancer proliferation,migration, invasion and epithelialmesenchymal transition by spongingmiR-150-5p
期刊:Molecular Cancer
小结:验证linc00673具有miR-150-5p的靶向结合位点。将linc00673包括预测结合位点的序列克隆到pmirGLO- linc00673-WT,同时构建靶位点突变的pmirGLO- linc00673-MUT,分别共转miR-150-5p mimics及NC mimics,结果显示miR-150-5p转染组的相对荧光值降低,提示存在靶向结合。
图:RNA与质粒共转染293T,24h后双萤光素酶检测
案例二
题目:SOX9 indirectly regulates CEACAM1 expression and immuneresistance in melanoma cells
期刊:Oncotarget
小结:验证SOX9对于CEACAM1的转录调控作用。分别使用了两种黑色素瘤细胞526mel和624mel,对CEACAM1的启动子区域分别选择了600bp-200bp的截短片段,共转染过表达SOX9,显示SOX9能够抑制CEACAM1启动子的转录。
图:截短的pCEACAM1进行双萤光素酶检测
荧光素酶常见问题与解答
1) 什么是双荧光素酶报告基因测试系统(DLR) DLR 测试系统灵敏,方便,在一个系统中用于测量两个单独的荧光素酶报告基因,萤火虫荧光素酶及海洋海肾荧光素酶 (Renilla reniformis) ,DLR测试系统可用于细胞裂解物及无细胞的翻译系统。 2) 有哪些海肾荧光素酶载体 海肾荧光素酶载体pRL用于在转染的哺乳细胞中组成性地表达海肾荧光素酶。这类载体还有T7启动子,可用 T7RNA 聚合物在体外合成海肾荧光素酶,有4个不同的载体: pRL-SV40 载体 pRL-SV40 载体含 SV40 增强子及早期启动子区域,可在多种细胞中组成性地高表达海肾荧光素酶。 pRL-SV40 载体还含有 SV40 的复制起始区,可在表达 SV40 大 T 抗原的细胞中,如 COS-1 , COS-7 细胞中,瞬时及附加体似地复制。 pRL-CMV 载体 pRL-CMV 载体含有 CMV 极早增强子及启动子,可在多种细胞中组成性地高表达海肾荧光素酶。 pRL-TK 载体 pRL-TK 载体含 HSV 胞嘧啶激酶启动子区域,在多种细胞中组成性地弱表达海肾荧光素酶。pRL-null 载体 pRL-null 载体缺真核启动子及增强子,在海肾荧光素酶基因的上游含有多克隆位点。 3) 用双报告基因有何优点 一般地说,实验报告基因用于测试实验条件下基因的表达,而另一个报告基因作为内对照,以提供实验报告基因测试的归一化。将实验报告基因的活力与内对照报告基因的活力作归一化可消除实验中不同测试间所固有的变化,这些变化减弱实验准确度,其中包括培养细胞的数目及活力的差异,细胞转染及裂解的效率。海肾荧光素酶可用作对照报告基因及实验报告基因。在双荧光素酶报告基因测试中,将萤火虫荧光素酶作为实验报告基因,海肾荧光素酶作为对照报告基因。
荧光素酶报告基因实验自我总结
荧光素酶报告基因实验自我总结 实验原理: 目前由两个主要的应用方向: 第一是检测转录因子与目的基因启动子区DNA相互作用,转录因子是一种具有特殊结构、行使调控基因表达功能的蛋白质分子,也称为反式作用因子。某些转录因子仅与其靶启动子中的特异顺序结合,这些特异性的序列被称为顺式因子,转录因子的DNA结合域和顺式因子实现共价结合,从而对基因的表达起抑制或增强的作用。荧光素酶报告基因实验(luciferase Assay)是检测这类转录因子和其靶启动子中的特异顺序结合的重要手段。 第二是研究微小RNA(microRNA)对于靶基因的调控,通过生物信息学方法预测microRNA潜在的靶基因以及干预位点序列,并设计合适的microRNA质粒或干预片段,同时构建靶基因的报告基因质粒,二者同时转染细胞,这是确定microRNA是否能影响(上调或下调)靶基因的首选研究方法。 实验流程: 1)构建一个将靶启动子的特定片段插入到荧光素酶表达序列前方的报告基因质粒,如pGL3-basic(转录因子与靶基因)或pMIR-REPORT Luciferase质粒(微小RNA与靶基因)2)将要检测的转录因子表达质粒(或microRNA质粒)与报告基因质粒共转染293细胞或目的细胞。如果此转录因子(或microRNA)能够激活靶启动子,则荧光素酶基因就会表达,荧光素酶的表达量与转录因子的作用强度成正比。 3)加入特定的荧光素酶底物,荧光素酶与底物反应,产生荧光素,通过检测荧光的强度可以测定荧光素酶的活性,从而判断转录因子是否能与此靶启动子片段有作用。 实验目的:研究转录因子和MicRNA对于靶基因调控的首先方法 实验步骤: (1)用生物信息学方法分析并预测启动子区可能的转录因子结合位点。 (2)设计引物用PCR法从基因组DNA中克隆所需的靶启动子片段,将此片段插入到荧光素酶报告基因质粒中。 (3)筛选阳性克隆,测序,扩增克隆并提纯质粒备用。 (4)扩增转录因子质粒(或microRNA质粒),提纯备用,同时准备相应的空载质粒对照。(5)培养293细胞(或其它目的细胞),并接种于12孔板中,生长24小时(80%汇合度)。(6)将报告基因质粒与转录因子表达质粒共转染细胞。 (7)用适当的方法提取蛋白并用于荧光素酶检测。 (8)加入酶作用底物,于荧光计数仪上测定荧光素酶的活性。 (9)计算相对荧光强度,并与空载对照比较,判断影响因子是否有效的作用于靶基因。
双荧光素酶测试系统及海肾类对照报告基因载体
双荧光素酶测试系统及海肾类对照报告基因载体 1.什么是双荧光素酶报告基因测试系统(DLR)? DLR测试系统灵敏,方便,在一个系统中用于测量两个单独的荧光素酶报告基因,萤火虫荧光素酶及海洋海肾荧光素酶(Renilla reniformis),DLR测试系统可用于细胞裂解物及无细胞的翻译系统。 2.有哪些海肾荧光素酶载体? 海肾荧光素酶载体pRL用于在转染的哺乳细胞中组成性地表达海肾荧光素酶。这类载体还有T7启动子,可用T7RNA聚合物在体外合成海肾荧光素酶,有4个不同的载体: A pRL-SV40载体??? pRL-SV40载体含SV40增强子及早期启动子区域,可在多种细胞中组成性地高表达海肾荧光素酶。pRL-SV40载体还含有SV40的复制起始区,可在表达SV40大T抗原的细胞中,如COS-1,COS-7细胞中,瞬时及附加体似地复制。 B pRL-CMV载体pRL-CMV载体含有CMV极早增强子及启动子,可在多种细胞中组成性地高表达海肾荧光素酶。 a pRL-TK载体 pRL-TK载体含HSV胞嘧啶激酶启动子区域,在多种细胞中组成性地弱表达海肾荧光素酶。 b pRL-null载体 pRL-null载体缺真核启动子及增强子,在海肾荧光素酶基因的上游含有多克隆位点。 3.用双报告基因有何优点? 一般地说,实验报告基因用于测试实验条件下基因的表达,而另一个报告基因作为内对照,以提供实验报告基因测试的归一化。将实验报告基因的活力与内对照报告基因的活力作归一化可消除实验中不同测试间所固有的变化,这些变化减弱实验准确度,其中包括培养细胞的数目及活力的差异,细胞转染及裂解的效率。海肾荧光素酶可用作对照报告基因及实验报告基因。在双荧光素酶报告基因测试中,将萤火虫荧光素酶作为实验报告基因,海肾荧光素酶作为对照报告基因。 4.相比用CAT或β-半乳糖苷酶对表达数据作归一化,双荧光素酶报告基因测试系统有何优点?
荧光素酶报告基因检测
荧光素酶报告基因检测 ●原则 荧光素酶检测系统,可用裂解液来温和而快速地提取真核细胞中的荧光素酶,用其底物来检测荧光素酶活性。检测步骤如下: 1)加裂解缓冲液裂解转染的细胞。 2)将上述裂解物转移入微孔板或者试管中(根据检测的需要选择所用器材类型)。 3)加入含有所有酶反应成分(必须包括底物荧光素),使化学发光反应开始。 4)用荧光仪或者液闪计数仪检测所发射的荧光。 ●特点 ◆敏感度和检测范围:5 fg荧光素酶 ◆发射光的线性范围:10 fg—10 ng ◆确切的检测限依检测仪器而定。 ◆特异性:本文介绍的荧光素酶报告基因系统的操作步骤,通常用来检测转染了萤火虫荧光素酶 基因的真核细胞中荧光素酶表达的活性。不适用于对细菌荧光素酶进行检测。 ●器材和试剂 ◆器材 在微孔板或试管中,用自动或手动荧光仪、液闪计数仪或者摄影胶片都可以检测到荧光素酶活性,而且高度敏感。当用微孔板时可以是白色,也可为黑色。 ◆试剂 1)荧光素酶检测试剂:荧光素酶检测试剂包括荧光素、ATP、CoA、以及一些添加剂,这些 试剂可以启动酶反应。这种荧光酶检测试剂的混合物可稳定保存在在-60℃以下12个月,- 15℃~- 25℃一个月,2℃~8℃只能保存一周。避免反复冻融。应避光保存,因为荧光素在 光照下会发生氧化。 2)裂解缓冲液:下面将加以介绍。 ●基本操作步骤 下面的操作步骤适用于培养的真核细胞。提取物必须立刻检测,否则必须在-15~-25℃储存大约一个月。不要反复冻融以避免酶活性的降低。 1)将荧光素酶报告基因与β-gal对细胞进行共转染,按实验计划进行处理。 2)彻底吸去培养皿(60mm)中的细胞培养液,用冰预冷的磷酸盐缓冲液(PBS,无钙和镁离子) 小心冲洗细胞3次,彻底去除剩余的PBS。10×PBS缓冲液:NaCl 100g,KCl 2.5g,Na2HPO4 14.4g,KH2PO42.5g,用三蒸水定容至1000 ml。 3)加入最小体积的Triton/甘氨酰甘氨酸裂解缓冲液盖过细胞,例如60 mm的培养皿用360 μl裂 解液,35毫米的培养板用150 μl裂解液。用橡皮刮将细胞刮离培养皿。将裂解物转移到微量离 心管中。Triton/甘氨酰甘氨酸裂解缓冲液:1%(v/v)Triton X-100,25mmol/L甘氨酰甘氨酸(p H7.8),15mmol/L MgSO4,4mmol/L EGTA,1mmol/L DTT(临用前加入) 4)在漩涡混合器上轻轻振荡细胞裂解液,以最大速度4℃离心以去除细胞碎片。将上清转移到另 一个微量离心管中,置于冰上以备分析。 5)在开始化学发光反应之前,将100 μl的细胞提取物转移到荧光仪或者液闪计数仪所用的检测 器皿中(我们建议用96孔板)。加入360 μl荧光素酶分析缓冲液。荧光素酶分析缓冲液:25m
荧光素酶报告实验
荧光素酶报告实验 1 扩增目的片段 扩增包含靶基因与miRNA互补位点的3’UTR序列以及mutant序列,上下游引物5’端各含有不同的酶切位点和保护碱基(如Pme I,Spe I);电泳检测目的条带,看大小是否正确,然后用试剂盒纯化PCR产物备用。主要采用了2 种方法进行序列突变及扩增,如下图所示:第一种方法: 第二种方法: 1.2 取1-2 μg纯化的目的片段或pMIR-REPORT载体,按酶切反应体系配制混合液进行酶切(加0.01% BSA),酶切3h后,80℃灭活5 min,冰上降温。酶切产物进行胶回收。
酶切体系连接体系Component V olume (μl) Component V olume (μl) H2O 16-x H2O 8-m-n Vector or DNA x Vector m NEB Buffer I或IV 2 DNA n Spe I 1 10×T4 Ligase Buffer 1 Pme I 1 T4 DNA Ligase 1 Total voloume 20 Total voloume 10 1.3 配制连接反应混合液(DNA和Plasmid的molar ratio为3:1到6:1),16℃连接过夜或室温连接10 min。连接完毕后,将连接产物转化入感受态大肠杆菌(热激法)。Amp(100 μg/ml)抗性培养板筛选阳性克隆,菌落PCR鉴定目的片段,送3个样本测序,提取质粒酶切鉴定等。并扩繁阳性克隆。重组Luc-3’UTR 质粒主要元件和组成如下图所示(重组Luc-3’UTR-Mut 原理相同): pLuc-MET 3'UTR 荧光素酶报告基因载体的构建 4.接种对数生长期的HEK293细胞(10% FBS+90% DMEM培养)于96孔板,3×103个/孔,每个实验组设置6个复孔,37℃,5% CO2培养箱中培养24h; 5.根据Lipofectamine 2000转染试剂说明书,配制转染液,转染HEK293细胞; A 液B液 pLuc-3’UTR 0.1 μg Lipofectamine 2000 0.5 μl pRL-SV40 0.05 μg OPTI-MEM 25 μl Mimic/NC 100 nM终浓度 OPTI-MEM 25 μl 6 转染48 h后,吸除96孔板中的培养液,用ddH2O稀释Passive Lysis Buffer至1×浓度,在96孔板中加入1×Passive Lysis Buffer,20 μl/孔,用移液枪反复吸打裂解细胞; 7 在白色不透明的96孔板中加入100 μl/孔的Luciferase Assay Substrate; 8 从每孔裂解好的细胞悬液中吸出11.5 μl加入Luciferase Assay Substrate中混匀; 9 在酶标仪500 ms条件下检测,并记录数据; 10 用Stop & Glo? Buffer稀释Stop & Glo? Substrate至1×使用浓度; 11 在第7步完成后,加入Stop & Glo? Substrate 100 μl/孔,混匀; 12 在酶标仪500 ms条件下检测,并记录数据,两次测得数据的比值代表各孔样本的相对荧光强度。
荧光素酶及其报告基因的应用和检测
荧光素酶及其报告基因的应用和检测 一生物发光 生物发光(bioluminescence)是指生物体发光或生物体提取物在实验室中发光的现象。它不依赖于有机体对光的吸收,而是一种特殊类型的化学发光,化学能转变为光能的效率几乎为100%。也是氧化发光的一种。生物发光的一般机制是:由细胞合成的化学物质,在一种特殊酶的作用下,使化学能转化为光能。 与荧光的区别在于 荧光:荧光检测需要激发光源,发射光的能量来源于激发光,荧光反应为瞬时反应。 发光:生物发光、化学发光,发光反应无需激发光源,发射光的能量来源于化学反应,发光有一定的持续时间。 二荧光素酶 荧光素酶(Luciferase)是生物体内催化荧光素(luciferin)或脂肪醛(firefly aldehyde)氧化发光的一类酶的总称,来自于自然界能够发光的生物。 自然界存在的荧光素酶来自萤火虫、发光细菌、发光海星、发光节虫、发光鱼、发光甲虫等。细菌荧光素酶对热敏感,因此在哺乳细胞的应用中受到限制。目前,以北美萤火虫虫(Photinus pyralis)来源的荧光素酶基因应用的最为广泛,该基因可编码550个氨基酸的荧光素酶蛋白,是一个61kDa的单体酶,无需表达后修饰,直接具有完全酶活。 发光机制 生物荧光实质是一种化学荧光。萤火虫荧光素酶在Mg2+、ATP、O2的参与下,催化D2荧光素(D2luciferin) 氧化脱羧,产生激活态的氧化荧光素,并放出光子,产生550~ 580 nm 的荧光,其化学反应式如下。 这种无需激发光就可发出偏红色的生物荧光,其组织穿透能力明显强于绿色荧光蛋白( GFP) 。荧光素酶是靠酶和底物的相互反应发光,特异性很强,灵敏度高,由于没有激发光的非特异性干扰, 信噪比也比较高。 三荧光素酶报告基因 报告基因(report gene)是一种易于检测蛋白质或酶等表达产物的基因,可通过报告基因产物的表达来“报告”目的基因的表达调控。通常把报告基因的编码序列和基因表达调节序列融合形成嵌合基因,或与其他目的基因融合,在调控序列控制下进行表达,
双荧光素酶报告基因分析promega
双荧光素酶报告基因分析 1. 介绍 荧光素酶报告基因表达的转录调控常被用来研究培养细胞的生物学特性。荧光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性荧光素酶,一旦转录完成立刻就生成功能性的荧光素酶。 Dual-Luciferase?双荧光素酶报告基因检测系统中含有在同一细胞中同时表达的两种荧光素酶。通常,报告基因实验中往往会受到各种实验条件的影响,共转染的“对照”报告基因会作为内对照,为试验提供一基准线。实验报告基因经过内参照的处理可以减小细胞活性和转染效率对实验的影响,因此双报告系统减少了外部干扰,使得实验数据更可信。实验中报告基因和对照基因的酶没有种源同源性,萤火虫荧光素酶和海肾荧光素酶对应不同的反应底物,反应中没有任何的交叉干扰。
萤火虫荧光素酶底物和海肾荧光素酶底物分别与检测试剂反应可以使灵敏度最大化。由于超强的光信号和超高的信噪比,本系统被广泛用于制药和生物技术产业中。双荧光素酶报告基因检测系统适配于各种培养哺乳细胞的培养基,如1640,MEM,DMEM,F12等。这些试剂与被动裂解液所附带的试剂盒,可以从Promega试剂盒中分开,单独使用。 具有超高灵敏度和超宽线性范围的Veritas?微孔板发光检测仪特别适合DLR 报告基因检测系统,Veritas?软件中预装了DLR 的检测程序使得安装更为方便,内置自动加样器使得应用更为简单。 Veritas?微孔板发光检测仪使用荧光素酶检测试剂II (LAR II)最低可以检测到1X10-19 mol 荧光素酶分子,使用Stop & Glo?试剂可以检测到1X10-18 mol 海肾荧光素酶分子,检测线性范围分别为8 和6 个数量级。所有的检测均采用纯化的重组萤火虫荧光素酶 (E1701)和纯化的重组海肾荧光素酶。
双荧光素酶测试系统及海肾类对照报告基因载体
双荧光素酶测试系统及海肾类对照报告基因载 体 Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998
双荧光素酶测试系统及海肾类对照报告基因载体 1.什么是双荧光素酶报告基因测试系统(DLR)? DLR测试系统灵敏,方便,在一个系统中用于测量两个单独的荧光素酶报告基因,萤火虫荧光素酶及海洋海肾荧光素酶(Renilla reniformis),DLR测试系统可用于细胞裂解物及无细胞的翻译系统。 2.有哪些海肾荧光素酶载体? 海肾荧光素酶载体pRL用于在转染的哺乳细胞中组成性地表达海肾荧光素酶。这类载体还有T7启动子,可用T7RNA聚合物在体外合成海肾荧光素酶,有4个不同的载体: A pRL-SV40载体pRL-SV40载体含SV40增强子及早期启动子区域,可在多种细胞中组成性地高表达海肾荧光素酶。pRL-SV40载体还含有SV40的复制起始区,可在表达SV40大T抗原的细胞中,如COS-1,COS-7细胞中,瞬时及附加体似地复制。 B pRL-CMV载体pRL-CMV载体含有CMV极早增强子及启动子,可在多种细胞中组成性地高表达海肾荧光素酶。 a pRL-TK载体 pRL-TK载体含HSV胞嘧啶激酶启动子区域,在多种细胞中组成性地弱表达海肾荧光素酶。 b pRL-null载体 pRL-null载体缺真核启动子及增强子,在海肾荧光素酶基因的上游含有多克隆位点。 3.用双报告基因有何优点? 一般地说,实验报告基因用于测试实验条件下基因的表达,而另一个报告基因作为内对照,以提供实验报告基因测试的归一化。将实验报告基因的活力与内对照报告基因的活力作归一化可消除实验中不同测试间所固有的变化,这些变化减弱实验准确度,其中包括培养细胞的数目及活力的差异,细胞转染及裂解的效率。海肾荧光素酶可用作对照报告基因及实验报告基因。在双荧光素酶报告基因测试中,将萤火虫荧光素酶作为实验报告基因,海肾荧光素酶作为对照报告基因。 4.相比用CAT或β-半乳糖苷酶对表达数据作归一化,双荧光素酶报告基因测试系统有何优点
双荧光素酶报告基因检测试剂盒使用说明
双荧光素酶报告基因检测试剂盒使用说明 产品说明: 报告基因检测,是真核基因表达调控研究的常用方法。由于检测光量子的方法非常敏感,采用生物发光(bioluminescent)法,是报告基因检测最常用的有效手段。荧光素酶(luciferase)催化底物荧光素的转化,发射出光子。萤火虫荧光素酶(Firefly luciferase)和海肾荧光素酶(Ranilla luciferase)催化的发光反应,具有相似的光学特征和很好的浓度线性范围(7~8个数量级的线性范围),酶的检测灵敏度达10-18mol到10-20mol,但两者催化的化学反应底物和最适反应条件完全不同。这两种荧光素酶配合形成了十分有效的双荧光素酶报告基因系统,其中Ranilla luciferase通常作为内参照。 本试剂盒提供了一体化形式的双荧光素酶检测系统。采用通用裂解缓冲液,适合于两种荧光素酶活性的保持,且与其他类型的报告基因检测和蛋白含量检测兼容;优化的两种酶反应体系,使每种发光反应持续数十分钟,以便于手工操作多个样品;并保证Firefly luciferase发光及时淬灭,不影响后续Ranilla luciferase的测定;优化的反应体系还使两种荧光素酶活性比值趋于合理的敏感范围,更有利于后续数据的比较。 产品内容: 名称数量保存条件5x Universal Lysis Buffer(通用裂解液)25ml-20℃ Fassay Buffer I(虫酶缓冲液)10ml-20℃ Fassay Substrate I(虫酶底物)0.5ml-20℃ Rassay Buffer II(海酶缓冲液)10ml-20℃ Rassay Substrate II(海酶底物)0.2ml-20℃可作100次双荧光素酶检测。低温运输,-20℃或-80℃避光保存。有效期6个月。
双萤光素酶报告基因的应用-常见载体及案例简介
双萤光素酶报告基因的应用,常见载体及案例简介双萤光素酶报告基因检测(Dual-Luciferase Reporter Assay)通常以萤火虫萤光素酶(Firefly luciferase)为报告基因,以海肾萤光素酶(Renilla luciferase)为内参基因。所构成的报告系统具有灵敏度高、动态范围广、应用灵活等优势,广泛用于基因调控、非编码RNA靶向互作等研究领域。 Firefly luciferase(简称F-Luc)以萤光素(luciferin)为底物,在Mg2+、ATP和氧分子存在条件下,催化luciferin氧化成oxyluciferin,在此过程中发出最强波长在560nm 左右的生物萤光(bioluminescence)。F-Luc表达框的上游启动子区域插不同功能序列,可以通过转录起始条件造成其报告萤光的变化。在F-Luc的3’UTR区域插入待验证的靶序列,通过其翻译抑制或mRNA稳定性降低,可以反映是否存在靶向互作。 Renilla luciferase(简称R-Luc)以腔肠素(coelenterazine)为底物,在氧分子存在的条件下催化coelenterazine氧化生成coelenteramide,此过程中发出最强波长在465nm 左右的生物萤光。R-Luc通常由固定组成型启动子驱动,在报告系统中作为校正input误差的内参信号。 生物萤光产生反应式 一、应用方向 1. 验证microRNA同mRNA靶向互作。将待测mRNA的3’UTR序列插入报告基因载体,再共转入该microRNA,如果萤光素酶活性下降,则提示为其靶序列。 2. 验证microRNA同lncRNA靶向互作。将候选的lncRNA序列插入报告基因载体中F-Luc的3’UTR区域,检测萤光素活性。 3. 启动子结构分析。将启动子区域序列(通常2k左右)进行分段截短,或对特定位点进行突变,再分别构建入luciferase报告载体,检测其启动子活性。 4. 启动子SNP分析。一些基因的启动子区域存在单核苷酸多态性,可运用萤光素酶报告系统分析其相对活性。
双荧光素酶报告基因检测系统-promega
Dual-Luciferase? Reporter Assay 试剂准备 Luciferase Assay Buffer II 10ml Luciferase Assay Substrate 1vial Stop & Glo? Buffer 10ml Stop & Glo? Substrate, 50X 200ul Passive Lysis Buffer (PLB), 5X 30ml 1.1X PLB: 加1体积的5X Passive Lysis Buffer (PLB)到4体积的dH20中,40C 保存(一个月)。 https://www.wendangku.net/doc/3f17425914.html,R II:将Luciferase Assay Substrate重悬于10ml Luciferase Assay Buffer II 中(-200C保存1个月,-700C保存1年)。 3.1X Stop & Glo 试剂:1体积50X Stop & Glo? Substrate加入49体积的 Stop & Glo? Buffer中(-200C保存15天)。(每次试验需要100ul) 细胞处理 1. 吸除细胞培养液 2. 1X PBS轻柔的冲洗细胞 3. 加入1X PLB(推荐用量) 4.细胞溶解 室温条件下,轻摇细胞15min,
瞬时转染和报告基因实验 采用脂质体介导技术转染。重组质粒分别为p-629/+100,p-401/+100,p-238/+100,p-80/+100,p-25/+100。pGL3- basic为阴性对照;同时以转染phRL-tk(海肾荧光素酶)作内对照。具体转染方法参照转染(Polifectamine Reaent)说明书进行。 1. 将质粒DNA(3.2μg)与phRL-tk (0.8μg)按1:4混合后为A液,混匀30s, PolyFect(QIAGEN)与无血清无抗生素的DMEM按1:50混匀后为B液,混匀30s; 2. A+B混匀(B加入A)15s,室温下孵育5-10 min; 3. 吸出六孔板中的培养液,用无血清无抗生素的DMEM洗3遍,然后加入AB 混合液,每孔0.8mL; 4. 6h后,加入2mL完全DMEM; 5. 24h后,倒出旧培养液,换为完全DMEM; 6. 100μg H2O2或B(a)P处理lh或24h;(200 μM MMS,24h-溶解于Me2SO, Sigma); (H2O2不引起OGG1升高)
荧光素酶报告系统
亦称发光酶。是催化生物发光的酶系的总称。它是光物质的冷水抽提物在氧中发光时,底物虫荧光素被消耗以后残余的对热不稳定的高分子成分。现在对萤虫相海萤以及发光细菌的虫荧光素酶结晶物的研究得最多。它们属于加氧酶(oxygenase),不含金属和辅酶。对于发光,有的酶必须以ATP等作为辅助 因子,有的则不需要。其发光机制等已了解到可因种的不同而有很大的差异,虫萤光素酶具有高度的特异性,一般仅作用于来自近缘种的虫荧光素。当然,萤虫、海萤的酶是不能互相代替引起发光的。海萤的虫荧光素酶在干燥状态下相当稳定,可以保存 双荧光素酶报告基因测试∶结合萤火虫和海洋腔肠荧光素酶先进的共报告基因测试技术 在用萤火虫荧光素酶定量基因表达时,通常采用第二个报告基因来减少实验的 变化因素。但传统的共报告基因(比如CAT,β-Gal,GUS)不够便利,因为各自的测 试化学,处理要求,检测特点存在差异。Promega提供一种先进的双报告基因技术,结合了萤火虫荧光素酶测试和海洋腔肠荧光素酶测试。双荧光素酶报告基因测试系统,结合pRL载体系统,表达第二个报告基因海洋腔肠荧光素酶,在单管中进行 双荧光素酶报告基因测试,快速,灵敏,简便。系统还提供PLB裂解液,用来裂解在多孔板中培养的哺乳细胞,不需操作单个样品。对于正在使用萤火虫荧光素酶报 告基因载体的研究人员。双荧光素酶报告基因测试系统将使他们立即体会到该系统的便利。 介绍 双报告基因用于实验系统中作相关的或成比例的检测, 通常一个报告基因 作为内对照, 使另一个报告基因的检测均一化。检测基因表达时双报告基因通常用来瞬时转染培养细胞,带有实验报告基因的载体共转染带有不同的报告基因作为对照的第二个载体。通常实验报告基因偶联到调控的启动子, 研究调控基因的结构和生理基础。报告基因表达活力的相对改变与偶联调控启动子转录活力的改变相关,偶联到组成型启动子的第二个报告基因,提供转录活力的内对照, 使测试不被实验条件变化所干扰。 通过这种方法, 可减少内在的变化因素所削弱的实验准确性, 比如, 培养细 胞的数目和活力的差别, 细胞转染和裂解的效率。 使用萤火虫荧光素酶,结合氯霉素乙酰转移酶(CAT), β-半乳糖苷酶(β-Gal), 或葡萄醛酸糖苷酶(GUS)的双报告基因,近几年已普遍使用。但这些双报告基因 组合削弱了荧光素酶操作的优势, 比如荧光素酶测试和定量可在几秒钟内进行, 但CAT, β-Gal和GUS测试法, 则在定量前需要长时间的保温。另外,这些报告 基因受限于它们的灵敏度和线性应答范围, 必须注意不要超过这些范围, 内源性
荧光素酶报告基因的检测
一、荧光素酶报告基因的检测原理 荧光素酶(Luciferase)是生物体内催化荧光素(luciferin)或脂肪醛(firefly aldehyde)氧化发光的一类酶的总称,来自于自然界能够发光的生物。 自然界存在的荧光素酶来自萤火虫、发光细菌、发光海星、发光节虫、发光鱼、发光甲虫等。细菌荧光素酶对热敏感,因此在哺乳细胞的应用中受到限制。目前,以北美萤火虫虫(Photinus pyralis)来源的荧光素酶基因应用的最为广泛,该基因可编码550个氨基酸的荧光素酶蛋白,是一个61kDa的单体酶,无需表达后修饰,直接具有完全酶活。 发光机制 生物荧光实质是一种化学荧光。萤火虫荧光素酶在Mg2+、ATP、O2的参与下,催化D2荧光素(D2luciferin) 氧化脱羧,产生激活态的氧化荧光素,并放出光子,产生550~580 nm 的荧光,其化学反应式如下。
这种无需激发光就可发出偏红色的生物荧光,其组织穿透能力明显强于绿色荧光蛋白(GFP)。荧光素酶是靠酶和底物的相互反应发光,特异性很强,灵敏度高,由于没有激发光的非特异性干扰,信噪比也比较高。 二、荧光素酶报告基因的检测流程 1、重组质粒制备: 制备含有待检测基因-Luc/Rluc的重组质粒; 2、细胞系选择: 根据实验需要选择细胞株,通常选择转染效率较高的293T细胞或原代细胞等; 3、共转染: 将带有Luc/Rluc标记的报告基因和目的基因进行共转染,设置不同的检测时间点,一般为24h/48h; 4、外界干预: 转染后,可进行物理/化学/病毒等的相应刺激; 5、细胞处理: 采用进口/国产双荧光素酶检测试剂盒依照protocol操作; 6、荧光检测: 使用GENios Pro 酶标仪或具有类似检测功能的设备进行荧光强度检测。 三、荧光素酶报告基因的优点 1、优越的灵敏度,比Westernbloting灵敏度高1000倍以上; 2、内源性低,哺乳动物无内源性表达; 3、荧光素酶检测不受细胞内其他物质影响; 4、发光检测,检测方便;
双荧光素酶报告基因
启动子活性分析(双荧光素酶报告基因实验) 一、实验目的:分析启动子活性 二、实验原理:荧光素酶报告基因的活性用Dual-Luciferase?Reporter Assay System(Promega)试剂盒来检测。利用单通道多标记荧光检测仪测定荧 光素酶活性。在双荧光素酶系统中,除了用于检测启动子活性的萤火虫 荧光素酶外,另外一种组成型表达的Renilla荧光素酶质粒PRL-TK也被 同时转染入细胞内作为内参。 三、实验材料:Dual-Luciferase?Reporter Assay System(Promega)试剂盒, PBS,细胞裂解液,96孔, 四、实验设备:单通道多标记荧光检测仪 五、实验方法及步骤: 1)启动子萤光素酶报告载体与共转染质粒按照质量等比例、总量0.8μg的原则转染细胞,36h后收获细胞; 2)96孔板吸弃细胞培养基,PBS冲洗细胞一次,加入1×PLB细胞裂解液20μl,置于室温震荡裂解20min; 3)轻轻吹打细胞,取10μl细胞裂解液加入50μl Luciferase Assay Reagent,轻轻震荡混匀,立刻置于单通道多标记荧光检测仪中测定Firefly Luciferase活性; 4)读数后立即加入50μl Stop & Glo?Reagent轻轻震荡混匀,读取Renilla Luciferase活性; 5)所得的结果为各个实验样品的Firefly Luciferase活性与Renilla荧光素酶活性的比值。每个实验组重复3-4孔,整个实验独立重复3次。实验结 果均为3次独立的实验结果的平均值。所有的结果均以平均值±标准差 (mean±S.D.)表示。 六、注意事项 1.做好对照。 2.多做几个复孔,求平均值。 七、补充知识点 双荧光素酶报告基因实验
双荧光素酶报告系统
双荧光素酶报告系统 双荧光素酶报告基因测试∶ 结合萤火虫和海洋腔肠荧光素酶先进的共报告基因测试技术 在用萤火虫荧光素酶定量基因表达时 ,通常采用第二个报告基因来减少实验的变化因素。但传统的共报告基因(比如CAT,β-Gal,GUS)不够便利,因为各自的测试化学,处理要求,检测特点存在差异。Promega提供一种先进的双报告基因技术,结合了萤火虫荧光素酶测试和海洋腔肠荧光素酶测试。双荧光素酶报告基因测试系统,结合pRL载体系统,表达第二个报告基因海洋腔肠荧光素酶,在单管中进行双荧光素酶报告基因测试,快速,灵敏,简便。系统还提供PLB 裂解液,用来裂解在多孔板中培养的哺乳细胞,不需操作单个样品。对于正在使用萤火虫荧光素酶报告基因载体的研究人员。双荧光素酶报告基因测试系统将使他们立即体会到该系统的便利。 介绍 双报告基因用于实验系统中作相关的或成比例的检测, 通常一个报告基因作为内对照, 使另一个报告基因的检测均一化。检测基因表达时双报告基因通常用来瞬时转染培养细胞,带有实验报告基因的载体共转染带有不同的报告基因作为对照的第二个载体。通常实验报告基因偶联到调控的启动子, 研究调控基因的结构和生理基础。报告基因表达活力的相对改变与偶联调控启动子转录活力的改变相关,偶联到组成型启动子的第二个报告基因,提供转录活力的内对照, 使测试不被实验条件变化所干扰。 通过这种方法, 可减少内在的变化因素所削弱的实验准确性, 比如, 培养细胞的数目和活力的差别, 细胞转染和裂解的效率。 使用萤火虫荧光素酶,结合氯霉素乙酰转移酶(CAT), β-半乳糖苷酶(β-Gal), 或葡萄 醛酸糖苷酶(GUS)的双报告基因,近几年已普遍使用。但这些双报告基因组合削弱了荧光素酶操作的优势 , 比如荧光素酶测试和定量可在几秒钟内进行, 但CAT, β-Gal和GUS测试法, 则在定量前需要长时间的保温。另外,这些报告基因受限于它们的灵敏度和线性应答范围, 必须注意不要超过这些范围, 内源性细胞活力也会干扰这类报告基因的使用。许多类型的细胞有内源β-Gal或GUS表达, 不利于准确定量报告基因表达, 胞内去乙酰酶活力干扰CAT活力测试。尽管在高温下预处理细胞裂解液(1,2), 会降低内源性β-Gal和CAT测试的干扰,但这些处理也会快速失活荧光素酶。因此,在此类双报告基因检测中, 必须以不同的步骤分别处理共转染的细胞裂解液。 理想的双报告基因方法应该使用户能够以萤火虫荧光素酶所具有的速度,灵敏和线性范 围对同一样品中的两个报告基因同时测定。这在传统的报告基因, 如CAT, β-Gal和GUS是不可能的, 由于它们测试化学,处理要求所固有的局限。相反 , 结合萤火虫 ( Photinus pyralis ) 和海洋腔肠 ( Renilla reniformis ) 双荧光素酶, Promega 的双荧光素酶报告基因测试 (DLR) 系统可满足这些要求,在单管中完成这些测试。 双荧光素酶报告基因测试化学 荧火虫和海洋腔肠荧光素酶都具有生物发光报告基因的卓越的测试特点 , 但它们在进化 上的起源不同 , 因此 , 具有不同的酶学结构和底物要求。这些差别用来发展了 DLR 测试化学 , 选择性地区别这两种发光报告基因的活力。萤火虫荧光素酶是一个 61kDa 单亚基蛋白质 , 酶活力不需翻译后修饰 (3,4), 在翻译后即可作为遗传报告基因。在 ATP,Mg 2+ 和 O 2 存在下,通过甲虫荧光素的氧化反应发光 ( 图 1) 。在常规反应条件下 , 荧光素的氧化发生时 , 以荧光素 -AMP 作为中间体 , 转换非常缓慢。结果 , 在底物和酶混合后 , 测试化学产生"闪烁"的光 , 并迅速衰减。专利化的测试试剂 , 定量萤火虫荧光素酶活力 , 掺入了
双荧光素酶报告基因分析
双荧光素酶报告基因分析 转载请注明来自丁香园 发布日期:2010-04-08 10:59 文章来源:北京原平皓生物技术有限公司 关键词:双荧光素酶基因表达报告基因检测 1. 介绍 荧光素酶报告基因表达的转录调控常被用来研究培养细胞的生物学特性。荧光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性荧光素酶,一旦转录完成立刻就生成功能性的荧光素酶。 Dual-Luciferase?双荧光素酶报告基因检测系统中含有在同一细胞中同时表达的两种荧光素酶。通常,报告基因实验中往往会受到各种实验条件的影响,共转染的“对照”报告基因会作为内对照,为试验提供一基准线。实验报告基因经过内参照的处理可以减小细胞活性和转染效率对实验的影响,因此双报告系统减少了外部干扰,使得实验数据更可信。实验中报告基因和对照基因的酶没有种源同源性,萤火虫荧光素酶和海肾荧光素酶对应不同的反应底物,反应中没有任何的交叉干扰。 萤火虫荧光素酶底物和海肾荧光素酶底物分别与检测试剂反应可以使灵敏度最大化。由于超强的光信号和超高的信噪比,本系统被广泛用于制药和生物技术产业中。双荧光素酶报告基因检测系统适配于各种培养哺乳细胞的培养基,如1640,MEM,DM EM,F12等。这些试剂与被动裂解液所附带的试剂盒,可以从Promega试剂盒中分开,单独使用。 具有超高灵敏度和超宽线性范围的Veritas?微孔板发光检测仪特别适合DLR 报告基因检测系统,Veritas?软件中预装了DLR 的检测程序使得安装更为方便,内置自动加样器使得应用更为简单。
Veritas?微孔板发光检测仪使用荧光素酶检测试剂II (LAR II)最低可以检测到1 X10-19 mol 荧光素酶分子,使用Stop & Glo?试剂可以检测到1X10-18 mol 海肾荧光素酶分子,检测线性范围分别为8 和6 个数量级。所有的检测均采用纯化的重组萤火虫荧光素酶(E1701)和纯化的重组海肾荧光素酶。 图1-3 使用Promega 公司Dual-Luciferase?双荧光素酶报告基因检测系统,萤火
各种荧光素酶报告基因检测试剂盒解析
各种光素酶报告基因检测试剂盒解析 荧光素酶(Luciferase)是自然界中能够催化荧光素产生生物发光的酶的统称,其中最有代表性的是来自萤火虫体内(Fire?y)和海肾(Renilla)体内的两类萤光素酶,分别命名为F-Luciferase和R-Luciferase,同时近年来研究得较多的来源于高斯氏菌的高斯荧光素酶(Gauss luciferase)。 荧光素酶可以催化luciferin氧化成oxyluciferin,在luciferin氧化的过程中,会发出生物荧光(bioluminescence),可通过荧光测定仪设备测定luciferin氧化过程中释放的生物荧光,常应用于启动子转录活性调控及miRNA靶基因验证等方向研究。 萤火虫萤光素酶 最通用和最常见的报告基因是北美萤火虫photinus pyralis的荧光素酶,该蛋白质不需要翻译后修饰即可获得酶活性。高浓度(体内)甚至没有毒性,可用于原核和真核细胞。 Amplite?萤光素酶报告基因检测试剂盒 图1.在带有NOVOstar读板器(BMG Labtech)的白色96孔板中,使用Amplite?萤光素酶报告基因基因检测试剂盒(12518)检测萤光素酶剂量反应。该试剂盒可在20min-5h的孵育时间内检测到低至0.1pg /孔的萤光素酶,而不会丢失信号强度。半衰期超过4小时。 Amplite?萤光素酶报告基因检测试剂盒(12518)使用无DTT专利配方来定量活细胞和细胞提取物中的萤光素酶活性。该测定基于萤火虫荧光素酶,萤火虫荧光素酶是一种单体的61 kD 酶,可催化荧光素的两步氧化,在560 nm处产生光。
Amplite?萤光素酶报告基因检测试剂盒特点: 具有优化的“混合读取”测定规程,可与HTS液体处理仪器兼容 具有高灵敏度,可用于需要低检测限的测定 具有用于研究基因调控和功能的快速,简单且均一的生物发光测定法 与标准细胞生长培养基的使用兼容 高斯荧光素酶 近年来,其他荧光素酶(例如高斯荧光素酶)的使用有所增加,因为这些报告基因较小,并且不需要ATP的存在。高斯荧光素酶是一种20 kD的蛋白质,可通过氧气催化腔肠素氧化,产生光。来自于海洋足类高斯氏菌的生物发光酶在表达后可有效地从哺乳动物细胞中分泌出来。 Amplite?高斯荧光素酶报告基因检测试剂盒使用专有的发光配方来定量细胞培养基中的荧光素酶活性。当该试剂与高斯荧光素酶相互作用时,产生发光产物,该发光产物提供强发光。 Amplite高斯荧光素酶报告基因测定试剂盒特点: 提供了与HTS液体处理仪器兼容的所有基本组件 它们具有高灵敏度,可以以方便的96孔和384孔微量滴定板形式进行 半衰期为一小时的“辉光型”信号在大量检测板之间提供一致的信号 与标准细胞生长培养基兼容 海肾荧光素酶 海肾萤光素酶是一种从海桑(Renilla reniformis)分离的36 kDa蛋白。与萤火虫荧光素酶相比,海肾荧光素酶的底物和辅因子要求不同。海肾荧光素酶在氧气存在下使用腔肠素,产生480 nm的蓝光。与萤火虫萤光素酶类似,海肾萤光素酶因其底物要求和光输出方面的差异而可用于双重报告检测。 Amplite?海肾荧光素酶报告基因测定 Amplite?Renilla萤光素酶报告基因检测试剂盒提供了一种快速,灵敏的方法,可以使用专有的发光配方在基于细胞的检测中检海肾萤光素酶的活性,与海肾萤光素酶相互作用后,该试剂产生具有强光的产物。 Amplite?海肾荧光素酶报告基因检测试剂盒特点: 该测定法与标准细胞生长培养基兼容 该试剂盒可以测量野生型和合成hRluc基因的原始表达或基因表达 每个试剂盒均包含可以方便96孔和384孔板检测所必不可少的组分 各类萤光素酶底物,辅因子和物理特性:
荧光素酶报告
荧光素酶报告检测结果:
双萤光素酶报告基因检测(miRNA靶基因验证)实验 摘要:本实验使用双萤光素酶报告基因检测系统验证hsa-mir-21对目的基因Tropomyosin 1(TPM1)的抑制作用;通过检测带有TPM1的3?UTR的luciferase在hsa-mir-21过表达时的表达情况,同时结合带有突变预测结合位点的3?UTR的luciferase的表达,进一步确定了hsa-mir-21与TPM1靶基因3?UTR的作用位点。 关键词:hsa-mir-21,3?UTR,Tropomyosin 1(TPM1),Dual-Reporter Assay 一、实验原理: 萤光素酶是理想的报告基因,因为哺乳动物细胞中不含内源性萤光素酶,一旦转录完成立刻就生成功能性的萤光素酶。单报告基因实验往往会受到各种实验条件的影响,而双报告基因则通过共转染的“对照”作为内参为试验提供一基准线,从而可以在最大程度上减小细胞活性和转染效率等外在因素对实验的影响,使得数据结果更为可信。Dual-Luciferase双萤光素酶报告基因检测系统在细胞中同时表达萤火虫萤光素酶和海肾萤光素酶,两者没有种源同源性并对应不同的反应底物,故而没有交叉干扰。得益于超强的光信号和超高的信噪比,本系统被广泛用于miRNA靶基因验证。 由于miRNA主要通过作用于靶基因的3?UTR起作用,可以将目的基因3?UTR区域构建至载体中报告基因luciferase的后面,通过比较过表达或者干扰miRNA后,报告基因表达的改变(监测萤光素酶的活性变化)可以定量反映miRNA对目的基因的抑制作用;结合定点突变等方法进一步确定miRNA与靶基因3?UTR 的作用位点。 二、实验目的 验证hsa-mir-21与靶基因Tropomyosin 1 3?UTR是否发生作用并进一步确定hsa-mir-21与靶基因Tropomyosin 1 3?UTR的作用位点。 三、实验步骤 1. 质粒转染细胞: 1) 细胞铺板:将细胞按70%的汇合度接种到96孔板。 2) 转染:16h后转染萤光素酶报告基因质粒,每个样品设置6个复孔。 a) 配制DNA和转染试剂: 96孔板转染质粒时每孔比例为Firefly:Renilla:转染试剂=0.1μg:0.01μg:0.25μL b) 配制RNA和转染试剂稀释液,RNA的终浓度为100nM,转染试剂每孔0.25μL c) 稀释好的DNA和RNA及转染试剂,常温孵育5min d) 将稀释好的DNA和RNA分别和转染试剂混匀,常温孵育20min e) 每孔弃去50μL培养基,将25μL DNA转染混合液和25μL RNA转染混合液分别添加到每孔细胞样品中, f) 转染6h后,换新鲜完全培养基 2. 双报告基因检测 3) 质粒共转染48h后,弃去培养基,用100μL 1XPBS洗1遍 4) 倾斜96孔板,吸干剩余的PBS 5) 去离子水将5XPLB稀释成1XPLB,使用前放到常温 6) 每孔加50μL稀释好的1X PLB,摇床常温条件下摇15min,进行裂解 7) 白色不透光的96孔酶标板中每孔加步骤4的上清液10μL,加入100μL预先混好的LAR II,2s后测数据 8) 每孔添加100μL预先混好的Stop&Glo Reagent,静止2s后,测数据 注意:进行Luciferase活性检测时,需在避光条件下进行。 四、实验结果 表1. 空白校准后的数据
