试题君之K三关2016-2017学年高二化学选修4第04章 含解析 精品

一、电化学及其分类 1.电化学的概念:研究________________________相互转换的装置、过程和效率的科学。 2.电化学的分类
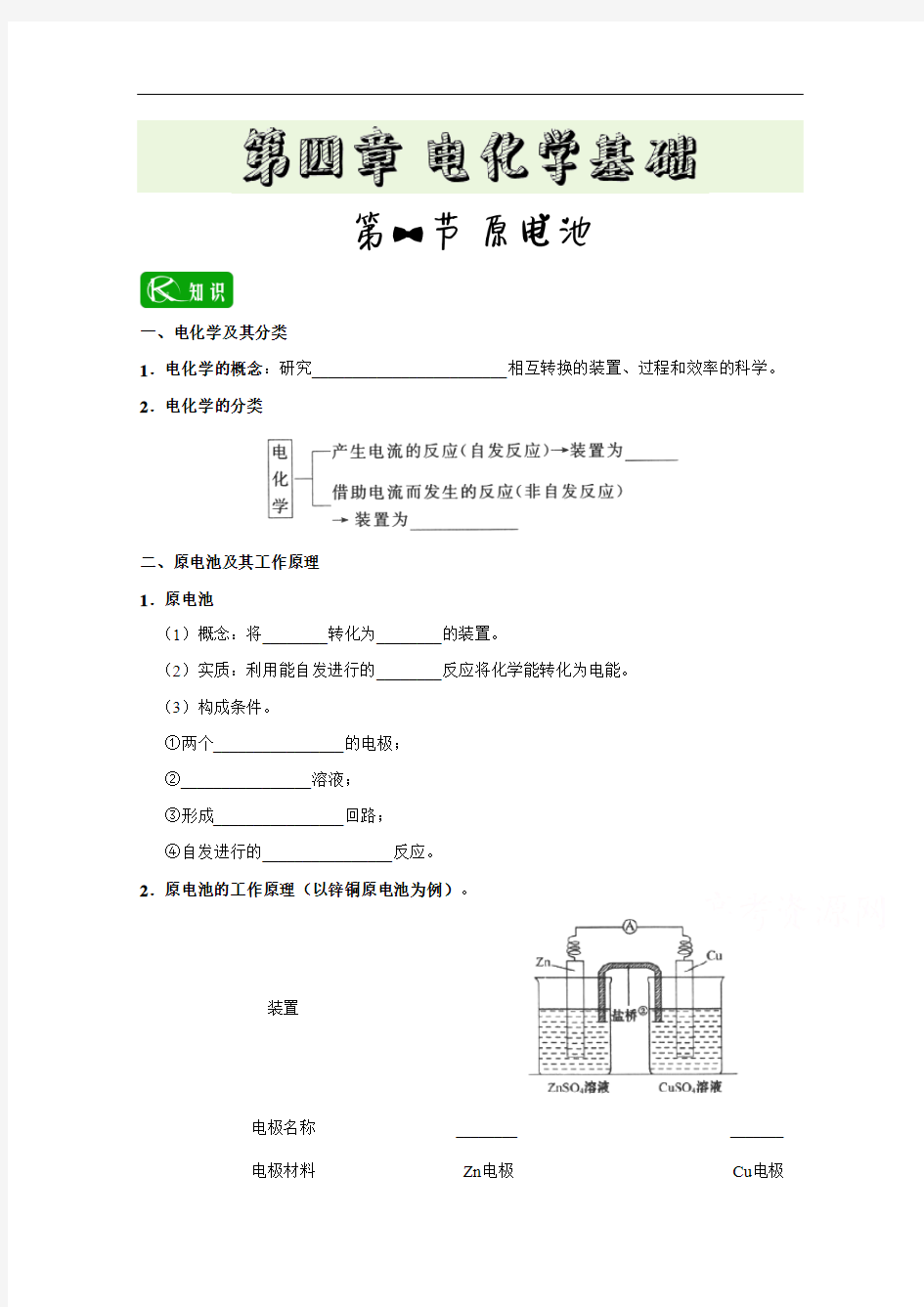
二、原电池及其工作原理 1.原电池 (1)概念:将________转化为________的装置。 (2)实质:利用能自发进行的________反应将化学能转化为电能。 (3)构成条件。 ①两个________________的电极; ②________________溶液; ③形成________________回路; ④自发进行的________________反应。 2.原电池的工作原理(以锌铜原电池为例)。
装置
电极名称 电极材料
________ Zn电极
_______ Cu电极
Zn棒逐渐变细 实验现象 电流表指针发生偏转 得失电子 电子流向 溶液离子移动方向 反应类型 电极反应式 总反应 三、原电池的设计 ________ ________ ________ ________ ________
Cu棒逐渐变粗
_______ _______ _______ _______ _______
__________________________
1.设计依据:理论上,任何一个自发的______________________都可以设计成原电池。 2.设计步骤 以根据反应:Fe+CuSO4 FeSO4+Cu设计原电池为例:
(1)首先分析所给的氧化还原反应,将其拆分成两个半反应:________反应和________反 应: 氧化反应:Fe?2e? Fe2+;还原反应:Cu2++2e? Cu。
(2)根据原电池的特点再结合两个半反应确定正、负极的材料及电解质溶液。 ①负极材料:__________________。 ②正极材料:比负极____________________________________。 ③电解质溶液:负极区:__________________;正极区:__________________。 (3)画出装置图。
一、1.化学能与电能 二、1.(1)化学能 (3)①活泼性不同 电能
2.原电池 电解池 (2)氧化还原 ③闭合 ④氧化还原
②电解质
2.负极 正极 失电子 得电子 流出 流入 阴离子移向负极 阳离子移向正极 氧化反 应 还原反应 Zn?2e? Zn2+ Cu2++2e? Cu Zn+Cu2+ Zn2+ +Cu
三、1.氧化还原反应 (2)①还原剂(Fe) 溶液
2.(1)氧化 还原 ②不活泼的金属(如Cu)或非金属(如C) ③FeSO4溶液 CuSO4
一、原电池的判定 先分析有无外接电源,有外接电源的为电解池,无外接电源的可能为原电池;然后依据 原电池的形成条件分析判断,主要是“四看” : 一看电极??两极为导体且存在活泼性差异(燃料电池的电极一般为惰性电极); 二看溶液??两极插入电解质溶液中; 三看回路??形成闭合回路或两极直接接触; 四看本质??有无自发的氧化还原反应发生。
注意啦:多池相连,但无外接电源时,两极活泼性差异最大的一池为原电池,其他各池可 看做电解池。 下列装置是原电池的是_____________。
①
②
③
④
⑤
【解析】③④ 【答案】能否构成原电池可通过“四看”来判断:两极为导体且存在活泼性差异(燃料电池的 电极一般为惰性电极);两极插入电解质溶液中;形成闭合回路;能否自发地发生氧化还原反 应。③④符合要求。①中只有一个电极,②中两极材料不能同时为 Zn,⑤中没有形成闭合回 路。
二、原电池正、负极的判断方法 1.根据电极材料判断 负极??活泼性较强的金属; 正极??活泼性较弱的金属或能导电的非金属;
注意啦:活泼金属不一定作负极,如 Mg、Al 在 NaOH 溶液中,Al 做负极。 2.根据电子流动方向或电流方向或电解质溶液内离子的定向移动方向判断 负极??电子流出极,电流流入极或阴离子定向移向极; 正极??电子流入极,电流流出极或阳离子定向移向极。 3.根据两极发生的变化判断 负极??失去电子,化合价升高,发生氧化反应; 正极??得到电子,化合价降低,发生还原反应。 4.根据反应现象判断 负极??会逐渐溶解,质量减小; 正极??有气泡逸出或质量增加。
注意啦:原电池正负极判断的基础是氧化还原反应。如果给出一个方程式让判断正、负
极,可以直接根据化合价的升降变化来判断,发生氧化反应的一极为负极,发生还原反应的 一极为正极。 原电池的正极一定是 A.化学性质较活泼的金属 C.电子流出的一极 B.化学性质较不活泼的金属 D.电子流入的一极
【解析】原电池的正极材料可以是金属、非金属或金属氧化物等,但无论是哪种材料,正极 上都发生还原反应,是电子流入的一极。 【答案】D
三、原电池原理的应用 1.加快氧化还原反应的速率
在锌与稀硫酸反应时加入少量 CuSO4 溶液能使产生 H2 的速率加快。 2.寻求和制造干电池和蓄电池等化学能源(下节学习) 3.比较金属活动性强弱
两种金属 a 和 b,用导线连接后插入到稀硫酸中,观察到 a 极溶解,b 极上有气 泡产生。根据电极现象判断出 a 是负极,b 是正极,由原电池原理可知,金属活动性 a>b。 4.用于金属的防护
要保护一个铁闸,可用导线将其与一锌块相连,使锌作原电池的负极,铁闸作正 极。 5.设计化学电池
以 2FeCl3+Cu
2FeCl2+CuCl2 为依据,设计一个原电池。
(1)将氧化还原反应拆成氧化反应和还原反应两个半反应,分别作原电池的负极和正极 的电极反应式。
负极:Cu-2e
+
-
Cu2
-
+
正极:2Fe3 +2e
2Fe2
+
(2)确定电极材料 如发生氧化反应的物质为金属单质,可用该金属直接作负极;如为气体(H2)或溶液中的还 原性离子,可用惰性电极(如 Pt、碳棒)作负极材料。发生还原反应的电极材料必须不如负 极材料活泼。 本例中可用铜棒作负极,用铂丝或碳棒作正极。 (3)确定电解质溶液 一般选用反应物中的电解质溶液即可。如本例中可用 FeCl3 溶液作 电解液。 (4)构成闭合回路
注意啦:设计原电池时,若氧化还原方程式中无明确的电解质溶液,可用水作电解质, 但为了增强其导电性,通常加入强碱或一般的强酸。如燃料电池,水中一般要加入 KOH 或 H2SO4。 利用反应 Zn+2FeCl3 ZnCl2+2FeCl2 设计一个原电池。在下图方格内画出实验装
置图 ,并指出 正极材料为 ________ ,电 极反应式为 ____________________ ; 负极材料 为 ________,电极反应式为_______________________。
【解析】一般来说,自发的氧化还原反应都可以设计成相应的原电池。具体设计时,先将氧 化还原反应拆分为两个半反应(即氧化反应和还原反应),然后根据构成原电池的条件,选择合 适的电极材料及适宜的电解质溶液,将两电极用导线连接插入电解质溶液形成闭合回路,即 可成功设计原电池。将 Zn+2FeCl3 2Fe3 +2e
+ - +
ZnCl2+2FeCl2 拆分为 Zn-2e
-
Zn2 (氧化反应)和
+
2Fe2 (还原反应); 结合原电池的电极反应特点分析可知, 该电池的负极应为锌,
+
则正极所用材料活泼性应比锌弱,为保证 Fe3 在正极得电子,则电解质溶液为 FeCl3 等易溶的
铁盐的溶液。 【答案】Pt(或石墨) 2Fe3 +2e
+ -
2Fe2
+
Zn
Zn-2e
-
Zn2
+
【名师点睛】要牢记原电池正负极反应的反应类型,以便确定正负极材料,同时要根据总反 应式,选择合适的电解质溶液。为了确保能得出正确答案,可将所设计的原电池的总反应式 写出,与题中所给的反应方程式对比、检查。
1.下列说法正确的是 A.原电池中,负极上发生的反应是还原反应 B.原电池中,电流的方向是负极?导线?正极 C.双液原电池中的盐桥是为了连通电路,所以也可以用金属导线代替 D.在原电池中,阳离子移向正极,阴离子移向负极 2.把a、b、c、d四块金属板浸入稀硫酸中,用导线两两相连,可以形成原电池。若a、b相连 时,a为负极;c、d相连时,c溶解;a、c相连时,c极上产生大量气泡;b、d相连时,b极 上产生大量气泡。四块金属的活动性顺序是 A.a>c>d>b B.c>a>b>d C.a>c>b>d D.c>a>d>b
3.某原电池反应的离子方程式为Fe+ 2H+ A.用HNO3作电解质溶液 C.用铁作负极,铁质量不断减少 4.下列反应可用于设计原电池的是 A.H2SO4+2NaOH B.2FeCl3+Fe C.Mg3N2+6H2O Na2SO4+2H2O
Fe2++H2↑,则下列说法中正确的是 B.用锌作原电池正极 D.用铜作原电池正极
3FeCl2 3Mg(OH)2↓+2NH3↑
D.NaCl+AgNO3
NaNO3+AgCl↓
5.一个由锌片和石墨棒作为电极的原电池,电极反应分别是:
? ? 锌片:2Zn + 4OH ?4e
2ZnO + 2H2O
? 石墨:2H2O + O2 + 4e
4OH?
下列说法中不正确的是 A.电解质溶液为酸性溶液 B.锌片是负极,石墨棒是正极 C.电池反应为 2Zn + O2 2ZnO
D.该原电池工作一段时间后石墨棒附近溶液的 pH 增大 6. 选择适宜的材料和试剂设计一个原电池, 以便完成下列反应: 2FeCl3+Cu 画出原电池的示意图并写出电极反应。 _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ 2FeCl2+CuCl2。
7.图为一原电池装置,下列叙述中正确的是
A.该装置中电子由 Zn 电极流向 Cu 电极,溶液中的错误!未找到引用源。通过盐桥移 向 Zn 极 B.将上述装置中的 Zn 棒和 Cu 棒同时浸入 CuSO4 溶液,电流表的指针偏转幅度变小, 且很快减弱 C.将烧杯内溶液对换,电流表指针发生偏转 D.将盐桥改为铜导线连接两种溶液,电流由 Cu 电极移向 Zn 电极 8.如图所示,杠杆 AB 两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆 并使其在水中保持平衡,然后小心地向水槽中央滴入浓 CuSO4 溶液,一段时间后,下列有 关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)
A.杠杆为导体和绝缘体时,均为 A 端高,B 端低 B.杠杆为导体和绝缘体时,均为 A 端低,B 端高 C.当杠杆为绝缘体时,A 端低,B 端高;为导体时,A 端高,B 端低 D.当杠杆为绝缘体时,A 端高,B 端低;为导体时,A 端低,B 端高 9.已知某原电池的电极反应是 Fe – 2e? 回答问题。 Fe2+,Cu2+ + 2e? Cu,据此设计该原电池,并
(1)若原电池装置为图中甲: ①电极材料 A 是 ②观察到 A 电极的现象是 (2)若原电池装置为图中乙: ①电极材料 X 是 a.铁 ②电解质 Y 是 a.FeSO4 b.CuSO4 b.铜 (填序号,下同)。 c.石墨 。 c.CuCl2 ,B 是 (写名称)。 。
10.图 1 是铜锌原电池示意图。图 2 中,x 轴表示实验时流入正极的电子的物质的量,y 轴表 示
A.铜棒的质量 找到引用源。)
B.c(Zn2+)
C.c(H+)
D.c(错误!未
1.D 【解析】A 项,负极上发生氧化反应。B 项,电流的方向应是正极?导线?负极。C 项,盐 桥不能用导线代替。 2.A 【解析】该题考查根据原电池原理比较金属的活动性强弱。较活泼的金属为负极,被氧 化溶解;相对不活泼的金属为正极,冒气泡或析出金属。所以,四块金属的活动性顺序是 a>c>d>b。 3.CD 【解析】由原电池反应的离子方程式知,电池的负极应为铁,铁在反应中不断被消耗; 则正极应是比铁不活泼的金属(B 被否定),由于反应中放出了氢气并生成了 Fe2+ ,故知 电解质溶液不能是有强氧化性的 HNO3(A 被否定),由以上分析可知正确选项为 C、D。 4.B 【解析】用于设计原电池的化学反应必须属于氧化还原反应,故选 B。 5.A 【解析】由电极反应可知 Zn 发生氧化反应,是原电池的负极,O2 发生还原反应,石墨 棒是正极;电解质溶液应为碱性溶液;随着反应的进行锌片周围 pH 减小,石墨棒周围产 生 OH ,pH 增大;两电极反应相加得总反应式:2Zn+O2
?
2ZnO。
6.原电池设计如图所示:
负极:Cu-2e +2Fe2
+
-
Cu2
+
正极:2Fe3 +2e
+
-
2Fe2
+
总反应:Cu+2Fe3
+
Cu2
+
【解析】根据形成原电池的 3 个条件,可知必须选择两个电极的材料和电解质溶液。在反 应 2FeCl3+Cu 2FeCl2+CuCl2 中,Cu 是被氧化的,应该是原电池负极上发生的反应,
Cu 作负极材料最适宜,而正极只需选活泼性比 Cu 弱的金属或非金属电极即可,可选择石
墨电极。Fe3 在正极上被还原,所以选择 FeCl3 溶液作为电解液。
+
7.B 【解析】Zn 作负极,Cu 作正极,在外电路中电子由 Zn 电极流向 Cu 电极,在内电路的 盐桥中 Cl 移向 ZnSO4 溶液,K 移向 CuSO4 溶液,A 错误;若将 Zn 棒和 Cu 棒同时浸入 CuSO4 溶液,也构成原电池,产生电流,但效率不高,电流会很快衰减,B 正确;若将溶 液对换,则 Zn 直接将 Cu 置换出来附着在 Zn 表面,不能形成电流,C 错误;因 Cu 导线不 能传递离子,用其替换盐桥不能构成闭合电路,不产生电流,D 错误。 8.D 【解析】若杠杆为导体则构成原电池,铁作负极失电子而溶解:Fe?2e? Fe2+,溶液
? +
2+ 中 Cu 在正极(铜极)得电子生成铜,质量增大,A 端低,B 端高;若杠杆为绝缘体,则铁
与 CuSO4 溶液发生置换反应生成 Cu 覆于表面,质量增大,A 端高,B 端低。 9.(1)①铜(或石墨棒) 铁 ②有红色物质析出(或变粗) (2)①bc ②bc
? 【解析】(1)结合氧化还原反应的知识可知 Fe?2e
Fe2+是负极反应,故 Fe 作负极,
Cu2++2e?
Cu 是正极反应,故 A 应是铜或石墨棒,现象是看到有红色物质析出,电极变
粗。(2)不含盐桥的原电池中正极材料是比负极金属活泼性差的金属或导电的非金属, 故此时正极是铜或石墨,但负极只能是铁,电解质溶液是含不活泼金属离子的盐溶液, 可为硫酸铜、氯化铜或硝酸铜。
10.C 【解析】该装置构成原电池,Zn 是负极,Cu 是正极。A.在正极 Cu 上溶液中的 H+获 得电子变为氢气, Cu 棒的质量不变, 错误; B. 由于 Zn 是负极, 不断发生反应 Zn?2e?=Zn2+, 所以溶液中 c(Zn2+)增大,错误;C.由于反应不断消耗 H+,所以溶液的 c(H+)逐渐降低, 正确;D.SO42?不参加反应,其浓度不变,错误。
一、化学电源 1.定义:将_____________________的装置。 2.分类 一次电池 活性物质消耗到一定程度,就不能使用了,如普通的锌锰电池,碱性锌锰电池。 二次电池 放电后可以再___________使活性物质获得再生,如铅蓄电池、铬镍电池。
燃料电池 燃料___________,氧化剂_________________的电池,可以连续地将燃料和氧 化剂的化学能直接转换为电能的化学电池。 3.衡量电池优劣的指标 (1)比能量:_____________________所能输出电能的多少。 (2)比功率:_____________________所能输出功率的大小。 (3)电池的_____________________的长短。 二、一次电池 1.碱性锌锰电池 (1)基本构造
(2)工作原理 负极反应:_____________________; 正极反应:2MnO2+2e?+2H2O 总反应:Zn+2MnO2+ 2H2O (3)特点 碱性锌锰电池比普通锌锰电池性能好,它的比能量和可储存时间均有提高,适用于大电流 和连续放电。 2.锌银电池 (1)基本构造及工作原理 2MnOOH + 2OH?; 2MnOOH+Zn(OH)2。
(2)工作原理 负极反应:_______________________________________; 正极反应:_______________________________________;
总反应:Zn+Ag2O+H2O (3)特点
Zn(OH)2+2Ag。
比能量大,电压稳定,储存时间长,适宜小电流连续放电。 3.锂电池 (1)基本组成 负极:________,正极:MnO2、CuO、FeS2等,电解质:非水溶剂。 (2)特点 比能量高、电压高、工作温度宽,可储存时间长。 三、二次电池(以铅蓄电池为例) 1.基本构造
2.工作原理 (1)放电过程: 负极:_______________________________________; 正极:PbO2+4H++错误!未找到引用源。+2e? 总反应:Pb+PbO2 + 2H2SO4 (2)充电过程: 阴极:______________________ 阳极:PbSO4+2H2O?2e? 总反应:2PbSO4 +2H2O (_______反应); 2PbSO4 + 2H2O。 PbSO4+ 2 H2O;
PbO2+4H++错误!未找到引用源。 (________反应); Pb+PbO2+2H2SO4。
(3)铅蓄电池的充、放电过程: Pb+PbO2 +2H2SO4 3.铅蓄电池的优缺点 (1)优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉。 (2)缺点:比能量低、笨重、废弃电池污染环境。 四、燃料电池(以酸性氢氧燃料电池为例) 1.基本构造 2PbSO4+2H2O
2.工作原理 负极反应:_______________________________________; 正极反应:_______________________________________; 电池反应:H2+错误!未找到引用源。O2 3.特点 ①能量转换率高,污染小。 ②电极本身不包含________,只是一个催化转化元件。 ③工作时,________和________连续地由外部供给,在电极上不断进行反应,________不 断地被排除。 H2O。
一、1.化学能变成电能 (2)单位质量或单位体积 二、1.(2)Zn+2OH??2e? Ag2O+2e?+H2O 2Ag+2OH?
2.充电 失去电子 得电子 (3)可储存时间 Zn(OH)2
3.(1)单位质量或单位体积
2.(2)Zn+2OH??2e? 3.(1)锂 PbSO4
Zn(OH)2
三、2.(1)Pb+错误!未找到引用源。?2e? 未找到引用源。 四、2.H2?2e? 3.②活性物质 还原 氧化 2H+ ③燃料
(2)PbSO4 + 2e?
Pb+错误!
错误!未找到引用源。O2+2H++2e? 氧化剂 生成物
H2O
原电池电极反应式的书写 1.书写要遵循的原则 原电池两电极上分别发生氧化反应和还原反应,因此电极反应式的书写要遵循质量守恒、 电子守恒及电荷守恒。弱电解质、气体和难溶物均写成化学式,其余的以离子符号表示。 正极反应、负极反应产物根据题意或化学方程式确定,也要注意电解质溶液的成分对电极
产物的影响。 2.电极反应式的书写类型 (1)根据装置书写电极反应式。 首先判断该电池所依据的化学反应,从而确定两个半反应即电极反应。 (2)给出总反应式,写电极反应式。 各类电极反应式的一般书写步骤为: ①列出物质,标电子的得失;②选离子,配电荷;③配个数,巧用水;④两式加,验总式。
以 2H2+O2
2H2O 为例,当电解质溶液为 KOH 溶液时的电极反应式的书写步骤如下:
◆负极反应式的书写 ①根据总反应方程式列出总式两边化合价升高的有关物质为 H2,转移电子数为 4e :2H2-4e
- -
4H 。
+ -
+
②根据电解质溶液的酸碱性,用 H 或 OH 或其他离子配平,使两边电荷总数相等:2H2-4e
-
+4OH
-
4H2O。
注意啦:在碱性溶液中,电极反应式不出现 H 。 ③利用 H2O 使两边的元素守恒,即得:2H2-4e +4OH ◆正极反应式的书写 ①O2+4e
- - -
+
4H2O。
2O2 。
-
②O2+4e +2H2O
-
4OH ,注意在碱性溶液中提供 H 使 O2 变为 OH 的是水,要写成化学
- + - -
式的形式。将正负极反应式相加,若得到总反应式,说明写法正确。 (3)可充电电池电极反应式的书写 书写可充电电池电极反应式时,由于电极都参加反应,且正方向、逆方向反应都能反应,所 以要明确电池和电极,放电为原电池,充电为电解池;原电池的负极与电解池的阳极发生氧 化反应,对应元素化合价升高;原电池的正极与电解池的阴极发生还原反应,对应元素化合 价降低。 (4)给出电极反应书写总反应方程式 根据给出的两个电极反应式,写出总反应方程式时,首先要使两个电极反应式的得失电 子相等然后将两式相加,消去反应物和生成物中相同的物质即可。注意若反应式同侧出
现不能共存的离子,如 H 和 OH 、Pb2 和 SO2 4 ,要写成反应后的物质如 H2O、PbSO4。
+ - + -
注意啦:解答书写有关电极反应式的题目时,应先写出总化学方程式,再找出电解质溶 液的成分,最后分别写出正极反应式和负极反应式,从而作出合理的判断。
+ 依据氧化还原反应:2Ag (aq)+Cu(s)
Cu2+(aq)+2Ag(s)设计的原电池如图所示:请
回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________; (2)银电极为电池的________极,发生的电极反应为 _______________________________________; X电极上发生的电极反应为________________; (3)外电路中的电子是从________电极流向________电极。
【解析】由电池反应2Ag+(aq) +Cu(s)
Cu2+(aq) + 2Ag(s)可知:Cu?2e?
Cu2+发生氧化反
应,所以负极材料必须选择Cu。外电路电子从负极出发,流向正极,因此电子从铜极出发流 向银极。 【答案】(1)Cu AgNO3溶液 (2)正 Ag++e? Ag Cu ?2e? Cu2+ (3)铜 银
1.下列有关化学电池的说法中正确的是 A.化学电池只能将化学能转化为电能 B.燃料电池能将全部化学能转化为电能 C.锌银电池比能量大,电压稳定,储存时间长 D.一次电池包括干电池和蓄电池 2.一些废电池必须进行集中处理,其首要原因是
A.为了回收利用电池外壳的金属材料 B.防止汞、镉和铅等重金属离子对土壤和水源的污染 C.不使电池中渗出的电解质溶液腐蚀其他物品 D.回收其中的石墨电极 3.氢氧燃料电池是一种污染小、效率高的新型化学电源,可用于航天器上,其总反应的化学 方程式为2H2+O2 A.2H2?4e? B.4H++4e? 4H+ 2H2↑ 4OH? 2H2O+O2↑ 2H2O。该电池的负极反应式可表示为
C.2H2O+O2+4e? D.4OH??4e?
4.下列关于铅蓄电池的说法正确的是
A.放电时,正极发生的电极反应是 Pb(s)+错误!未找到引用源。(aq) B.放电时,该电池的负极材料是铅板 C.充电时,电池中硫酸的浓度不断减小 D.充电时,阳极发生的反应是 PbSO4(s)+2e?
PbSO4(s)+2e?
Pb(s)+错误!未找到引用源。(aq)
5.镍(Ni)镉(Cd)可充电的电池,放电时,电极材料是Cd和NiO(OH),电解质是KOH,电 极反应分别是Cd + 2OH??2e? 列说法不正确的是 A.电池放电时,负极周围溶液的pH不断减小 B.电池放电时总反应是Cd + 2NiO(OH) + 2H2O C.电池充电时,镉(Cd)元素被氧化 D.电池充电时,电池的正极和电源的正极相连接 6.实验室用铅蓄电池作电源电解饱和食盐水制取 Cl2(提示:2NaCl + 2H2O H2↑+ Cl2↑),已知铅蓄电池放电时发生如下反应: 负极:Pb +错误!未找到引用源。?2e? PbSO4 PbSO4 +2H2O 2NaOH + Cd(OH)2+2Ni(OH)2 Cd(OH)2;2NiO(OH) +2H2O+2e? 2Ni(OH)2+2OH?。下
正极:PbO2 + 4H+ +错误!未找到引用源。+2e?
今若制得 0.050 mol Cl2,电池内消耗的 H2SO4 的物质的量至少是 A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol
7.生物燃料电池(BFC)是一种真正意义上的绿色电池,其工作原理如图所示。下列说法中不 正确的是
A.C2 极为电池正极 B.C1 极的电极反应式为:C2H5OH + 3H2O – 12e? C.电子由 C2 极经外电路导线流向 C1 极 D.稀硫酸中的 H+向 C2 极移动 8.一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是 2CO2 + 12H+
A.反应 CH4+H2O
3H2+CO,每消耗 1 mol CH4 转移 12 mol 电子 2H2O
B.电极 A 上 H2 参与的电极反应为:H2+2OH??2e? C.电池工作时,错误!未找到引用源。向电极 B 移动 D.电极 B 上发生的电极反应为:O2+2CO2+4e?
2 错误!未找到引用源。
9.可用于电动汽车的铝?空气燃料电池,通常以 NaCl 溶液或 NaOH 溶液为电解液,铝合金为 负极,空气电极为正极。下列说法正确的是 A.以 NaCl 溶液或 NaOH 溶液为电解液时,正极反应均为 O2+2H2O+4e? B.以 NaOH 溶液为电解液时,负极反应为 Al+3OH??3e? Al(OH)3 4OH?
C.以 NaOH 溶液为电解液时,电池在工作过程中电解液的 pH 保持不变 D.电池工作时,电子通过外电路从正极流向负极
10.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。 下列有关微生物电池的说法错误的是
A.正极反应中有 CO2 生成 B.微生物促进了反应中电子的转移 C.质子通过交换膜从负极区移向正极区 D.电池总反应为 C6H12O6+6O2 6CO2+6H2O
11.Mg?AgCl 电池是一种以海水为电解质溶液的水激活电池。下列叙述错误的是 A.负极反应式为 Mg?2e? B.正极反应式为 Ag++e? Mg2+ Ag
C.电池放电时 Cl?由正极向负极迁移 D.负极会发生副反应 Mg+2H2O Mg(OH)2+H2↑
12.某电池以 K2FeO4 和 Zn 为电极材料,KOH 溶液为电解溶质溶液。下列说法正确的是 A.Zn 为电池的负极 B.正极反应式为 2FeO42?+ 10H++6e? Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变 D.电池工作时错误!未找到引用源。向负极迁移 13 . 某 电 动 汽 车 配 载 一 种 可 充 放 电 的 锂 离 子 电 池 。 放 电 时 电 池 的 总 反 应 为 : Li1?xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是 A.放电时,Li+在电解质中由负极向正极迁移 B.放电时,负极的电极反应式为 LixC6?xe?= xLi++ C6 C.充电时,若转移 1 mol e?,石墨 C6 电极将增重 7x g D.充电时,阳极的电极反应式为 LiCoO2?xe?=Li1?xCoO2+Li+
14.金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车 和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O 4M(OH) n。已
知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说 法不正确 的是 ...
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极 表面 B.比较 Mg、Al、Zn 三种金属–空气电池,Al–空气电池的理论比能量最高 C.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne– 4M(OH)n
D.在 Mg–空气电池中,为防止负极区沉积 Mg(OH)2,宜采用中性电解质及阳离子交换膜
1.C 【解析】蓄电池不但可以将化学能转化为电能(放电),也可以将电能转化为化学能(充 电)。燃料电池的能量转换率超过 80%,但不可能 100%转换。蓄电池可重复使用,属于二 次电池。 2.B 【解析】废电池中汞、镉和铅等重金属离子会对土壤和水源造成污染,必须进行集中处 理。 3.A 【解析】氢气是负极燃料,在反应中失去电子,A项正确。 4.B 【解析】铅蓄电池充放电总反应为 Pb(s)+PbO2(s)+2H2SO4(aq) 放电时 Pb 作负极,电极反应为 Pb(s)?2e +错误!未找到引用源。(aq) PbO2(s)+2e?+4H+(aq)+错误!未找到引用源。(aq) PbSO4(s)+
?
2PbSO4(s)+2H2O(l)。 PbSO4(s),正极反应为
2H2O(l)。充电时,H2SO4 的浓度不断增大,阳极上失去电子发生氧化反应。 5.C 【解析】C项,充电时,Cd(OH)2+2e? Cd+2OH?,所以镉元素应被还原。
6.C 【解析】欲求消耗 H2SO4 的物质的量,可以根据铅蓄电池放电时的总反应
人教版高二化学选修4第二章测试题及答案解析(B卷)
第二章化学反应速率和化学平衡测评卷(B卷) (时间:90分钟满分:100分) 第Ⅰ卷(选择题,共45分) 一、选择题(每小题3分,共45分) 1.对于A 2+3B22AB3反应来说,以下反应速率表示反应最快的是() A.v(AB3)=0.5 mol/(L·min) B.v(B2)=0.6 mol/(L·min) C.v(A2)=0.4 mol/(L·min) D.无法判断 解析:A项由v(AB3)=0.5mol/(L·min)可推出v(A2)=0.25 mol/(L·min);B项由v(B2)=0.6mol/(L·min),可得v(A2)=0.2 mol/(L·min),由此可知表示反应最快的是C项。 答案:C 2.(2009·杭州高二检测)在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)C(g)+D(g)已达到平衡状态() A.混合气体的压强 B.混合气体的密度 C.各气体物质的物质的量浓度 D.气体的总物质的量 解析:解题时明确平衡状态的判断标志是变量不再发生变化。特别注意A的状态为固体。由于A为固体,反应前后气体的物质的量
相等,在刚性容器中整个反应过程中压强不变,故A 、D 错;由于A 为固体,气体的质量在反应中会发生变化,直到达平衡状态,ρ=m V ,由于V 不变,故混合气体的密度平衡前后会发生变化,不变时即达到平衡,B 对;任何物质的物质的量浓度不变均可表明达到平衡状态,C 对。 答案:BC 3.下列是4位同学在学习“化学反应速率与化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是( ) A .化学反应速率理论是研究怎样在一定时间内快出产品 B .化学平衡理论是研究怎样使用有限原料多出产品 C .化学反应速率理论是研究怎样提高原料转化率 D .化学平衡理论是研究怎样使原料尽可能多地转化为产品 解析:化学反应速率是研究化学反应快慢的问题,化学平衡是研究化学反应进行的程度问题。 答案:C 4.常温常压下,注射器甲中装有NO 2气体,注射器乙中装有相同体积的空气,注射器与U 形管连通,如图所示,打开两个止水夹,同时向外拉两注射器的活塞,且拉动的距离相等,将会看到U 形管中液面(不考虑此条件下NO 2与水的反应)( )
人教版高中化学选修4第一章测试题(经典含解析)
人教版选修4第一章《化学反应与能量变化》测试题(A卷) (45分钟,100分) 一、单项选择题(每小题4分,共60分) 1.下列措施不能达到节能减排目的的是() A.利用太阳能制氢燃料B.用家用汽车代替公交车 C.利用潮汐能发电D.用节能灯代替白炽灯 2. 未来氢气将作为新能源的优点的是() ①燃烧时发生氧化反应②充分燃烧的产物不污染环境 ③氢气是一种再生能源④燃烧时放出大量热量 A. ①②③ B. ①②④ C. ①③④ D. ②③④ 3.下列变化过程,属于放热反应的是() ①液态水变成水蒸气②酸碱中和反应③浓H2SO4稀释 ④固体NaOH溶于水⑤ H2在Cl2中燃烧⑥弱酸电离 A、②③④⑤ B、②③④ C、②⑤ D、①③⑤ 4.下列对化学反应的认识错误的是() A.一定有化学键的变化B.一定会产生新的物质 C.一定有物质状态的变化D.一定伴随着能量的变化 5.25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是() A.2H2(g)+O2(g) == 2H2O(1) △H=―285.8kJ/mol B.2H2(g)+ O2(g) == 2H2O(1) △H=+571.6 kJ/mol C.2H2(g)+O2(g) == 2H2O(g) △H=―571.6 kJ/mol D.H2(g)+1/2O2(g) == H2O(1) △H=―285.8kJ/mol 6.热化学方程式C(s)+H2O(g) ==CO(g)+H2(g);△H =+131.3kJ/mol表示()A.碳和水反应吸收131.3kJ能量 B.1mol碳和1mol水反应生成一氧化碳和氢气,并吸收131.3kJ热量 C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ D.1个固态碳原子和1分子水蒸气反应吸热131.1kJ 7.已知25℃、101kPa条件下: 4Al (s) + 3O2 (g) == 2Al2O3 (s) △H = -2834.9 kJ·mol-1 4Al (s) +2O3 (g) ==2Al2O3 (s) △H = -3119.91 kJ·mol-1 由此得出的结论正确的是() A.等质量的O2比O3能量低,由O2变O3为吸热反应 B.等质量的O2比O3能量低,由O2变O3为放热反应
文言文阅读(一)-学易试题君之每日一题君2018学年下学期七年级语文人教版(期末复习)
1 中考频度:★★★★☆ ┇ 难易程度:★★☆☆☆ 【2017届中考江苏南通卷】阅读下面的文言文,完成下列小题。 崇明老人记 【清】陆陇其 崇明具有吴姓老人者,年已九十九岁,其妇亦九十七岁矣。老人生四子,壮年家贫,鬻① 子以自给,四子尽为富家奴。及. 四子长,咸能自立,各自赎身娶妇,遂同居而共养父母焉。 伯仲叔季②,列肆五间:每户一铺,另辟一间,为出入之所。四子奉养父母,曲尽孝道。始拟膳每月一轮,周而复始,其媳曰:“翁姑老矣,若一月一轮,则必历三月后,方得侍奉颜色,太疏。”拟每日一家,周而复始。媳又曰:“翁老矣,若一日一轮,则历三日后,方. 得侍奉颜色,亦疏。”乃以一餐为率③,如蚤餐伯,则午餐仲,晚餐叔,则明日.. 蚤餐季,周而复始。若逢五及十,则四子共设于中堂,父母南向坐,东则四子及诸孙辈,西则四媳及诸孙媳辈。分伯仲坐定,以次称觞④献寿。率⑤以为常。 老人饮食之所,后置一橱,橱中每家各置钱一串,每串五十文。老人每食毕. ,反手于橱中随意取钱一串,即往市中嬉,买果饼啖之。橱中钱缺,则其子潜补之,不令老人知也。老人间往知交游,或对弈,或樗蒲⑥。四子知其所往,随遣人密嘱其家佯输于老人,老人亦不知也。老人胜,辄踊跃归。亦率以为常。盖数十年无异云。 (选自《明清散文名篇集粹》,有删改) 【注】①鬻(yù):卖。②伯仲叔季:兄弟排行的次序。③率(lǜ):文中指频次。④称觞(shāng ):举杯。 ⑤率(shuài ):大致,一般。⑥樗蒲(chū pú):古代一种游戏。 1.请用斜线(/)标出下面句子的朗读停顿。(共两处) 遂 同 居 而 共 养 父 母 焉 2.请写出下列句子中加点词的意思。 (1)及. 四子长( ) (2)方. 得侍奉颜色( ) (3)则明日.. 蚤餐季( ) (4)老人每食毕. ( ) 3.请用现代汉语写出文中画线句的意思。 橱中钱缺,则其子潜补之,不令老人知也。
高二化学选修5期末测试题1[1]
高二化学选修5期末测试题1 说明:1.考生务必将答案填写到答题卷上; 2.可能用到的元素的相对原子质量:C:12 H:1 O:16 一、选择题(共16小题,每小题3分,每小题只有一个 ..正确选项) 1.我国已成功发射了“神舟”七号,其中一名航天员身穿国产的舱外航天服首次实现了太空行走。该航天服的面料是由高级混合纤维制造而成的,据此分析,该面料一定不具有的性质是() A.强度高,耐高温 B.防辐射,防紫外线 C.能抗骤冷、骤热 D.有良好的导热性,熔点低 2.下列涉及有机物的性质或应用的说法不正确 ...的是 ( ) A.淀粉、纤维素、蛋白质都是天然高分子化合物 B.用于奥运“祥云”火炬的丙烷是一种清洁燃料 C.用大米酿的酒在一定条件下密封保存,时间越长越香醇 D.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 3.下列关于有机物的说法错误的是 ( ) https://www.wendangku.net/doc/404231517.html,l4可由CH4制得,可萃取碘水中的碘 B.石油和天然气的主要成分都是碳氢化合物 C.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 D.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 4.下列关于常见有机物的说法不正确 ...的是 ( ) A. 乙烯和苯都能与溴水反应 B. 乙酸和油脂都能与氢氧化钠溶液反应 C. 糖类和蛋白质都是人体重要的营养物质 D. 乙烯和甲烷可用酸性高锰酸钾溶液鉴别 5.下列各组物质中,一定互为同系物的是() A、乙烷和己烷 B、CH3COOH、C3H6O2 OH CH2OH C、和 D、HCHO、CH3COOH 6.下列化学用语正确的是() A.聚丙烯的结构简式: B.丙烷分子的比例模型: C.四氯化碳分子的电子式: D.2-乙基-1,3-丁二烯分子的键线式: 7.下列五组物质,其中一定互为同分异构体的组是 ( ) ○1淀粉和纤维素○2硝基乙烷C2H5NO2和甘氨酸NH2CH2COOH ○3乙酸和乙二酸 ○4二甲苯和苯乙烯○52—戊烯和环戊烷 A.○1○2 B.○2○3○4 C.○1○3○5 D.○2○5 8. 下列系统命名法正确的是() A. 2-甲基-4-乙基戊烷 B. 2,3-二乙基-1-戊烯 C. 2-甲基-3-丁炔 D. 对二甲苯
人教版高中化学选修四综合测试题及答案
高中化学学习材料 金戈铁骑整理制作 教材模块综合测试题 测试时间:120分钟试卷满分:150分 第Ⅰ卷(选择题,共64分) 一、单项选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题) 1.废弃的电子产品称为电子垃圾,其中含铅、汞等有害物质、危害严重。下列对电子垃圾处理应予提倡的是() ①将电子垃圾掩埋地下②改进生产工艺,减少有害物质使用③依法要求制造商回收废旧电子产品④将电子垃圾焚烧处理 A.①③B.②④C.②③D.①④ 2.下列实验指定使用的仪器必须预先干燥的是() ①中和热测定中所用的小烧杯②中和滴定中所用的滴定管③配制一定物质的量浓度溶液中所用的容量瓶④喷泉实验中用于收集氨气的烧瓶 A.①②B.②③C.①④D.③④ 3.在一定温度下,可逆反应2A (g)+B (g) C (g)+D (g)达到平衡的标志是() A.C的生成速率和B的消耗速率相等 B.v正(A)=2v正(B) C.2v正(A)=v逆(B) D.反应混合物中A、B、C、D的质量分数不再发生变化 4.某混合溶液中所含离子的浓度如下表,则M离可能为() 所含离子NO3-SO42-H+M 浓度/(mol·L-1) 2 1 2 1 A.Cl-B.Ba2+C.F-D.Mg2+ 5.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)==H2O ( l ) ΔH=-57.3 kJ / mol,分别向1 L 0.5 mol / L的NaOH溶液中加入:①稀醋酸;②浓磷酸;③稀硝酸,恰好完全反应时热效应分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是() A.ΔH1>ΔH2>ΔH2B.ΔH1<ΔH3<ΔH2 C.ΔH1=ΔH2=ΔH2D.ΔH1<ΔH3<ΔH2 6.下列事实中,不能用勒夏特列原理解释的是() A.对熟石灰的悬浊液加热,悬浊液中固体质量增加 B.实验室中常用排饱和食盐水的方式收集氯气 C.打开汽水瓶,有气泡从溶液中冒出 D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 7.下列叙述中,正确的是() ①锌跟稀硫酸反应制取氢气,加入少量CuSO4溶液能提高反应速率②镀层破损后,白铁(镀锌的铁)比
每周一测-学易试题君之每日一题君2018学年下学期高一英语人教版(课堂同步系列二) (2)
I. 阅读理解 阅读下列短文,从每题所给的A、B、C和D四个选项中,选出最佳选项。 A During a visit to Australia, former President George W. Bush tried to signal a peace sign by waving the two fingers or V-sign at the crowd. You may think of this as a simple gesture, but he made a big mistake. Instead of his palm facing outwards, it faced inwards. In Australia, it means "go to hell"!Therefore, it is very important to understand the meanings of hand gestures in different cultures before you travel to different countries. The dog call The dog call is a gesture where you curl your index finger (食指) and call someone towards you. It is acceptable in America and England. This gesture is considered rude in many Asian countries such as Japan. In Singapore this gesture means death. Do not use this hand gesture in the Philippines because this hand gesture is to be used only for dogs there. The moutza While talking to a friend, you may open your palm and stretch out your fingers. But it is a traditional gesture of insult(侮辱)among Greeks. It means that you are thrusting your hand in the face of the opposite person. This suggests that you are asking the person to leave you alone. In America, it means"talk to the hand", which basically means "I’m not listening to you". The fig The fig is a gesture that is indicated by a fist. The thumb is seen poking out of the index and middle fingers. This is a good hand gesture in different cultures, as it indicates good luck. However, the fig is a very offensive(冒犯的) gesture to the Italians and Turks. The clenched fist One of the aggressive (挑衅的) hand gestures is the clenched (紧握的) fist. This means one is trying to pick a fight or trying to warn the opposite person to back off. In Asian countries, a clenched fist will surely land you into a fist fight. 1
化学选修4期末测试试卷与答案
化学选修4期末测试试卷 可能用到的相对原子质量:H 1 O 16 Cu 64 Ag 108 一、选择题(每小题只有一个正确答案,每小题2分,共40分) 1.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直到反应完全生成新物质硫化亚铁。这一现象说明了 A.该反应是吸热反应 B.该反应是放热反应 C.铁粉和硫粉在常温下容易反应 D.硫化亚铁的总能量高于铁粉和硫粉的总能量 2. 25o C时若体积为Va,pH=a的某一元强酸与体积为Vb, pH=b的某一元强碱混合,恰好中和,且已知 Va<Vb和a=0.5b,则下列符合a值的是 A.3 B.4 C.5 D.6 3.pH=a某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH<a,则该电解质可能是 A.Ba(OH)2 B.HCl C.Na2SO4 D.AgNO3 4.把分别盛有熔融的氯化钠、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钠、镁、铝的物质的量之比为 A.1︰2︰3 B.3︰2︰1 C.6︰3︰1 D.6︰3︰2 5.0.1mol/L HF溶液的pH=2,则该溶液中有关浓度关系式不正确...的是 A.c(H+)>c(F-) B.c(HF) >c(H+) C.c(OH-)>c(HF) D.c(HF)>c(F-) 6.以铁为电极电解U形管中的氯化钠溶液,液面上覆盖一层苯,电解一段时间后,在阴极周围溶液中加入酚酞,在阳极周围加入KSCN和K3[Fe(CN)6]溶液,则阴、阳极周围溶液颜色变为 A.红色、血红色 B.红色、蓝色 C.无色、红色 D.蓝色、红色 7.物质的量浓度相同的三种酸HX、HY、HZ的溶液,其pH依次为4、5、6,则KX、KY、KZ的碱性由强到弱的顺序是 A.KX、KZ、KY B.KX、 KY、KZ C.KZ、KY 、KX D.KY、KZ、KX 8.在100mL0.1mol/LCH3COOH溶液中,欲使CH3COOH的电离程度和溶液的pH都增大,可 A.加少量的NaOH(1mol/L)溶液 B.加少量1mol/L盐酸 C.加少量CH3COONa固体 D.微热 9.不考虑水的电离,在H2CO3溶液中,下列离子浓度关系正确的是 A.c(H+)=c(HCO3-)+2c(CO32-) B.c(H+)=c(HCO3-)+c(CO32-) C.2c(CO32-)=c(H+) D.c(CO32-)=c(HCO3-) 10.以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀;经过滤除去包括MnS在内的沉淀,再经蒸发、结晶得纯净的MnCl2。 根据上述实验事实,可推知MnS具有的相关性质是 A.溶解度与CuS、PbS、CdS 等相同 B.溶解度大于CuS、PbS、CdS C.溶解度小于CuS、PbS、CdS D.具有吸附性 11.右图是可逆反应A+2B2C+3D的化学反应速率与化学平衡 随外界条件改变(先降温后加压)而变化的情况,由此可推断 A.反应物的转化率先降低后增大 B.若A、B是气体,则D是液体或固体 C.逆反应是放热反应 D.A、B、C、D均为气体 12.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为: 2AgCl+Mg=Mg2++2Ag+2Cl-。有关该电池的说法正确的是 A.Mg为电池的正极 B.负极反应为AgCl+e-=Ag+Cl- C.不能被KCl 溶液激活 D.可用于海上应急照明供电
化学选修4期中考试试题(含答案)
化学选修4期中考试试题(二) 相对原子质量:H—1 C—12 O—16 N—14 一.选择题: 1.对于放热反应2H2(g)+O2(g)= 2H2O(l),下列说法正确的是A.产物H2O所具有的总能量高于反应物H2和O2所具有的总能量 B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量 D.反应物H2和O2比产物H2O稳定 2.升高温度能加快反应速率的主要原因是 A.活化分子的能量明显增加 B.降低了反应的活化能 C.增加了活化分子的百分数 D.改变了化学反应的能量变化 3.已知H2(g)+Cl2(g)= 2HCl(g)⊿H= —184.6 kJ/mol ,则反应HCl(g)=1/2 H2(g)+1/2Cl2(g)的⊿H为 A.+184.6 kJ/mol B.—92.3 kJ/mol C.—369.2 kJ/mol D.+92.3 kJ/mol 4.已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的反应速率为1mol/(L ·min),则此段时间内以C的浓度变化表示的化学反应速率为 A.0.5 mol/(L ·min) B.1 mol/(L ·min) C.2 mol/(L ·min) D.3 mol/(L ·min) 5.如图,横坐标表示加水量,纵坐标表示导电能力,能表示冰醋酸(即无水醋酸)加水稀释的图是 6.体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量 A.中和CH3COOH的多B.中和HCl的多 C.相同D.无法比较 7.一定温度下, 向aL的密闭容器中加入2molNO2(g), 发生如下反应:2NO22NO+O2,此反应达到平衡的标志是 A.单位时间内生成2nmolNO同时生成2nmolNO2 B.混合气体中NO2、NO和O2的物质的量之比为2:2:1 C.单位时间内生成2nmolNO同时生成nmolO2 D.混合气体的颜色变浅 8.下列不属于自发进行的变化是 A.红墨水加到清水使整杯水变红B.冰在室温下融化成水
狂刷52 统计及统计案例-学易试题君之小题狂刷2020年高考数学(理)(解析版)
专题十一概率与统计 狂刷52统计及统计案例 1.完成下列抽样调查,较为合理的抽样方法依次是 ①从30件产品中抽取3件进行检查; ②某校高中三个年级共有2460人,其中高一830人、高二820人、高三810人,为了了解学生对数学 的建议,拟抽取一个容量为300的样本; ③某剧场有28排,每排有32个座位,在一次报告中恰好坐满了听众,报告结束后,为了了解听众意 见,需要请28名听众进行座谈. A.简单随机抽样,系统抽样,分层抽样B.分层抽样,系统抽样,简单随机抽样 C.系统抽样,简单随机抽样,分层抽样D.简单随机抽样,分层抽样,系统抽样 【答案】D 【解析】对于①,从30件产品中抽取3件进行检查,总体的数量较少,且个体差异不明显,符合简单随机抽样的特点; 对于②,该校高中的三个年级,是差异明显的三个部分,符合分层抽样的特点; 对于③,该剧场有28排,每排有32个座位,显然总体数量较多,又有编号,符合系统抽样的特点. 故选D. 【名师点睛】三种抽样方法的特点、联系及适用范围: 类别共同点各自特点联系适用范围 简单随机抽样①抽样过程中每 个个体被抽到的 可能性相等; ②每次抽出个体 后不再将它放回, 即不放回抽样 从总体中逐个抽取总体个数较少 系统抽样将总体均分成几部分, 按预先定出的规则在 各部分中抽取 在起始部分取样 时,采用简单随机 抽样 总体个数较多 分层将总体分成几层,分层各层抽样时,采用总体由差异明
抽样 进行抽取 简单随机抽样或系统抽样 显的几部分组成 2.某工厂利用随机数表对生产的600个零件进行抽样测试,先将600个零件进行编号,编号分别为001,002,?,599,600从中抽取60个样本,如下提供随机数表的第4行到第6行: 32 21 18 34 29 78 64 54 07 32 52 42 06 44 38 12 23 43 56 77 35 78 90 56 42 84 42 12 53 31 34 57 86 07 36 25 30 07 32 86 23 45 78 89 07 23 68 96 08 04 32 56 78 08 43 67 89 53 55 77 34 89 94 83 75 22 53 55 78 32 45 77 89 23 45 若从表中第6行第6列开始向右依次读取3个数据,则得到的第6个样本编号为 A .522 B .324 C .535 D .578 【答案】D 【解析】第6行第6列开始的数为808(不合适),436,789(不合适),535,577,348,994(不合适),837(不合适),522,535(重复不合适),578, 则满足条件的6个编号依次为436,535,577,348,522,578. 则第6个编号为578. 本题正确选项为D. 【名师点睛】本题主要考查随机抽样的应用,根据定义选择满足条件的数据是解决本题的关键.求解本题时,根据随机抽样的定义进行判断即可. 3.从编号为001,002,…,460的460个产品中用系统抽样的方法抽取一个样本,已知样本中编号最小的两个编号分别为007,030,则样本中第5个产品的编号应该为 A .099 B .122 C .145 D .168 【答案】A 【解析】由系统抽样所有样本编号成等差数列,可以理解为由127,30a a ==求5a 的值. 由127,3023a a d ==?=,514742399a a d ∴=+=+?=,所以编号为099,故选择A . 【名师点睛】本题考查系统抽样特点:所有样本编号成等差数列,从而转化为数列题,属于简单题. 4.为了了解我校今年准备报考飞行员的学生的体重情况,将所得的数据整理后,画出了频率分布直方图(如图),已知图中从左到右的前3个小组的频率之比为1:2:3,第2小组的频数为12,则抽取的学生总人数是
含蓄条件句-学易试题君之每日一题君2018年高考英语二轮复习
1 2018年1月30日 高考频度:★★★★★ 难易程度:★★★☆☆ Without his wartime experiences, Hemingway____ his famous novel A Farewell to Arms . A. didn’t write B. hadn’t written C. wouldn’t write D. wouldn’t have written 【参考答案】D 【应试必备】 含蓄条件句中的虚拟语气 有时候,虚拟条件不是通过if 引导的条件句来表示,而是暗含在上下文中。 (1)用but for 、without(如果没有)等来代替条件从句。 ?Without electricity human life would be quite different. =If there were no electricity, human life would be quite different. 如果没有电,人类的生活将会有很大不同。 (2)用otherwise 、or(or else)、even though 等表示与上文的情况相反,从而引出虚拟语气。 ?I lost your address. Otherwise, I would have visited you long before. =I lost your address. If I hadn ’t lost your address, I would have visited you long before. 你的地址我弄丢了,要不我早就去拜访你了。学¥科网 (3)虚拟条件通过but 暗示出来。 ?He would have given you more help,but he was too busy. 他本来会给你更多的帮助,但是他太忙了。 也就是说,如果那时他不忙,他可以给你更多的帮助。句中but he was too busy 实际上暗示了一个虚拟条件——如果那时他不忙。
人教版高中化学选修四高二化学期末考试试卷
高中化学学习材料 (精心收集**整理制作) 高二化学期末考试试卷 本试卷分第I卷(选择题)和第II卷(非选择题)两部分。考试结束后,将本试卷和答题卡一并交冋。试卷满分100分,考试时间90分钟。 注意事项:1.开始答卷前,考生务必将0己的学校、班级、姓名和准考证号填写清楚。 2.将试题答案填在相应的答题卡内,在试题卷上作答无效。 第I卷(选择题共48分) 可能用到的相对原子质量:H 1 C 12 N 14 0 16 Mg 24 A1 27 S 32 Cl 35.5 —、选择题:本题共16小题,每小题3分,满分48分,每题只有一个选项是最符合题意的。 1.化学与生产、生活密切相关。对下列现象或事实解释,不正确的是 3. 下列有关电池的说法,不正确的是 A.智能手机上用的锂离子电池属于二次电池 B. 碱性锌锰干电池中,锌电极是负极 C. 铅蓄电池中,Pb02做负极 D. 铜锌原电池(稀硫酸做电解质)工作时,锌电极发生氧化反应 A.热化学方程式中,化学式前面的化学计量数只能表示物质的量 B. 1 moL H2生成1 mol H20时放出的热量就是氢气的燃烧热的值 C. 用1 mol/L的硫酸和适量的稀的Ba(OH)2溶液反应可以测量中和热的值
D. 条件相同,用16 g固体硫或32 g固体硫分别在02中充分燃烧,测定的硫的燃烧热不同 6. 下列溶液一定显碱性的是 A.含OH-的溶液 B. pH>7的溶液 C. c(OH-)>c(H+)的溶液 D.能与金属A1反应放出H2的溶液 7. 对于反应4C0(g)+2N02(g) N2(g)+4C02(g),以下化学反应速率的表示中,所表示反应 速率最慢的是 A. v(CO)= 1.6 mol/(L?min) B. v(N02)=0.9 mol/(L?min) C. V(N2)=0.25 mol/(L?min) D. v(CO2>2)=1.2 mol/(L?min) 8. 化学反应可以从不同的角度进行分析,以下观点中正确的是 A. 放热反应在常温下均能自发进行 B. 原电池工作时所发生的反应一定有氧化还原反应 C. 加热时,化学反应只向吸热反应方向进行 D. 化学平衡常数的表达式与化学反应方程式的书写无关 9. 下列过程不需要通电就能进行的是①电离②电解③电镀④电化学腐蚀 A. ①② B.②③ C. ③④ D. ①④ 10. 2015年2月科学家成功观察到CO与O形成化学键生成C02的全过程(CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000 K)。下列说法不正确的是 A. 该过程可以表示为:CO+O催化剂C02 B.该过程中有热量放出 C.催化剂能降低反应的活化能 D.钌催化剂能改变该反应的焓变 11. 下列关于Na2CO3溶液的说法,正确的是 A. 相同温度下,Na2C03溶液中水的电离程度比纯水的电离程度小 B. 相同温度下,Na2C03溶液中滴加酚酞呈红色,NaHC03溶液中滴加酚酞颜色更深 C. VLamoL/L的Na2C03溶液中,若C032-的数目为NA;则Na+的数目大于2N A D. CaC03在饱和Na2C03溶液中的K SP比在纯水中的K SP小 12已知:①4NH 3(g)+502(g)= 4N0(g)+6H20(g) H=-908 kJ/mol; ②N 2(g)+02(g) = 2NO(g) H= + 180 kJ/mol。 则汽车工作时氨气和NO发生反应的热化学方程式为 A.2NH 3(g)+3NO(g) = 2.5N2(g)+3H20(g) H= —1808 kJ/mol
(最新整理)化学选修四测试题
(完整)化学选修四测试题 编辑整理: 尊敬的读者朋友们: 这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)化学选修四测试题)的内容能够给您的工作和学习带来便利。同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。 本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)化学选修四测试题的全部内容。
第二章《化学反应速率与化学平衡》单元检测试题 一、选择题(本题包括16小题,每小题3分,共48分。) 1.在2A+B 3C+4D反应中,表示该反应速率最快的是 A.v(A)=0。5 mol·L-1·s-1 B.v(B)=0.3 mol·L-1·s-1 C.v(C)=0。8 mol·L-1·s-1 D.v(D)=1 mol·L-1·s-1 2.下列说法正确的是 A.增大反应物浓度,可增大单位体积内活化分子百分数,从而使有效碰撞次数增大 B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 C.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 3.在2升的密闭容器中,发生以下反应:2A(气)+B(气) 2C气+D(气)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0。12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是 A.1.6 mol B.2.8 mol C.2.4 mol D.1。2 mol 4.下列变化过程中,ΔS<0的是 A.氯化钠溶于水中 B.NH3(g)和HCl(g)反应生成NH4Cl C.干冰的升华D.CaCO3(S)分解为CaO(S)和CO2(g) 5.在一定温度不同压强(P 1<P2=下,可逆反应2X(g) 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题
湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题 19 大题综合训练 学校_________ 班级__________ 姓名__________ 学号__________ 一、原理综合题 -1 溶质CH 3 COONa NaHCO 3 Na 2 CO 3 NaClO NaCN Na 2 SO 4 pH 8.8 9.7 11.6 10.3 11.1 7.0 (1)上述六种溶液中的阴离子,结合H+能力最强的是____________(填离子符号)。 (2)上述六种溶液中,水的电离程度最小的是____________(填化学式)。 (3)若欲增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是________、________(每空填写一种物质)。 (4)依据复分解反应的规律,判断下列反应不能进行的是________。 A.CH 3COOH+Na 2 CO 3 =NaHCO 3 +CH 3 COONa B.CH 3COOH+NaCN=CH 3 COONa+HCN C.CO 2+H 2 O+2NaCN=Na 2 CO 3 +2HCN (5)将CO 2 气体通入饱和碳酸钠溶液中,可以观察到的现象是_______,原因为_________(用离子方程式表示)。 2. 氨是重要的工业原料,在农业、医药、国防和化工等领域有重要应用。 I.(1)工业上用N 2和H 2 在一定条件下合成氨,下列措施能使正反应速率增大, 且使平衡混合物中NH 3 的体积分数一定增大的是________。 A.降低反应温度 B.压缩反应混合物 C.充入 N 2 D.液化分离NH 3 (2)常温下向100mL0.2mo/L的氨水中逐滴加入0.2mol/L的盐酸,所得溶液的 pH、溶液中NH 4+和NH 3 ·H 2 O物质的量分数与加入盐酸的体积的关系如下图所示, 根据图像回答下列问题。
高二化学选修四 盐类的水解测试题二
高二化学选修四盐类的水解测试题二 班级姓名学号 一、选择题 1.下列关于FeCl3水解的说法错误的是 ( ) A.水解达到平衡时(不饱和),加氯化铁达饱和溶液,溶液的酸性会增强 B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小 C.有50℃和20℃的同浓度的两种FeCl3稀溶液,其他条件相同时,Fe3+的水解程度前者比后者小 D.为抑制Fe3+的水解,较好地保存FeCl3溶液,应加少量盐酸 2.正常人胃液的pH在0.3~1.2之间,胃酸(一般以盐酸表示)多了需要治疗。某些用以治疗胃酸过多的药物中含MgCO3、NaHCO3,也有用酒石酸钠来治疗的。这说明 ( ) A.碳酸、酒石酸都不是强酸 B.对人而言,酒石酸是营养品 C.MgCO3、NaHCO3与胃酸作用产生CO2,在服药后有喝汽水的舒服感 D.酒石酸钠水解显酸性 3.能使电离平衡H 2O H++OH-向右移动,且使溶液呈酸性的是 ( ) A.向水中加入少量硫酸氢钠固体 B.向水中加入少量硫酸铝固体 C.向水中加入少量碳酸钠固体 D.将水加热到100℃,使水的pH=6 4.有①Na2CO3溶液;②CH3COONa溶液;③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是 ( ) A.3种溶液pH的大小顺序是③>②>① B.若将3种溶液稀释相同倍数,pH变化最大的是② C.若分别加入25 mL 0.1 mol/L盐酸后,pH最大的是① D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② 5.恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:①固体NaOH;②固体KOH; ③固体NaHSO4;④固体CH3COONa;⑤冰醋酸。其中一定可使c(CH3COO-)/c(Na+)比值增
每周一测-学易试题君之每日一题君2019年高考英语一轮复习 (9)
2018年7月29日 每周一测 Ⅰ.单句改错 1.Lots of studies have been shown that global warming has already become a very seriously problem. 2. I thought the biscuits were really well. 3. My mum makes the better biscuits in the world,so I decided to ask her for help. 4.I had noticed that the carriage was noise and filled with people. 5. Don't panic or get out of line,and trying to remain quiet and calmly. 6. So really friendship should be able to stand all sorts of tests. II.阅读理解 阅读下列短文,从每题所给的A、B、C和D四个选项中,选出最佳选项。 A(2018·新课标III卷) Adults understand what it feels like to be flooded with objects. Why do we often assume that more is more when it comes to kids and their belongings? The good news is that I can help my own kids learn earlier than I did how to live more with less. I found the pre-holidays a good time to encourage young children to donate less-used things, and it worked. Because of our efforts, our daughter Georgia did decide to donate a large bag of toys to a little girl whose mother was unable to pay for her holiday due to illness. She chose to sell a few larger objects that were less often used when we promised to put the money into her school fund(基金)(our kindergarten daughter is serious about becoming a doctor) For weeks, I've been thinking of bigger, deeper questions: How do we make it a habit for them? And how do we train ourselves to help them live with, need, and use less? Yesterday, I sat with my son, Shepherd, determined to test my own theory on this. I decided to play with him with only one toy for as long as it would keep his interest. I expected that one toy would keep his attention for about five minutes, ten minutes, max. I chose a red rubber ball-simple, universally available. We passed it, he tried to put it in his mouth, he tried bouncing it, rolling it, sitting on it, throwing it. It was totally, completely enough for him. Before I knew it an hour had passed and it was time to move on to lunch. We both became absorbed in the simplicity of playing together. He had my full attention and I had his. My little experiment to find joy in a single object worked for both of us. 1. What do the words “more is more” in paragraph 1 probably mean? 1
完整word版,高二化学选修4期末考试试卷
2015---2016学年度第一学期高二期末化学试题 可能用到的部分原子量:H—1 C—12 O—16 S—32 Na—23 第I卷(共36分) 一、单选题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意) 1、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是 ①天然气②太阳能③风能④石油⑤煤⑥生物质能⑦核能⑧氢能 A.①②③④B.②③⑥⑧ C.①②⑤⑥⑦⑧D.③④⑤⑥⑦⑧ 2、氨水有下列平衡:NH3·H2O NH4+ + OH–当其它条件不变时,改变下列条件,平衡向左移动,且c(NH4+)增大的是 A.加NaOH B.加盐酸C.加NH4Cl D.加热 3、铜锌原电池(如图)工作时,下列叙述错误的是 A.正极反应为:Cu2++2e–= Cu B.电池反应为:Zn+Cu2+=Zn2+ +Cu C.在外电路中,电子从负极流向正极 D.盐桥中的K+移向ZnSO4溶液 4、在由水电离产生的c(H+)=1×10–14mol/L的溶液中,一定可以大量共存的离子组是A.K+、Ba2+、Cl–、NO3–B.Na+、Ca2+、I–、NO3– C.NH4+、Al3+、Br–、SO42–D.K+、Na+、HCO3–、SO42– 5、已知:K sp(AgCl)=1.8×10—10,K sp(AgI)=1.5×10—16 ,K sp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是 A.AgCl>AgI> AgBr B.AgCl> AgBr>AgI C.AgBr >AgCl>AgI D.AgBr >AgI>AgCl 6、已知:△G=△H-T△S,△H为焓变,T为热力学温度,△S熵变,当△G<0时反应能自发进行,△G>0时反应不能自发进行,据此,下列叙述中正确的是A.熵变大于零的反应肯定能自发进行 B.焓变小于零的反应肯定能自发进行
- 高二化学选修四 盐类的水解测试题二
- (完整版)高中化学选修4第三章测试题
- 最新高二化学选修4期末考试试题汇总
- 高中化学选修4测试题
- 人教版高中化学选修4第一章测试题(经典含解析)
- 高二化学选修四测试题及答案解析
- (新人教版)高二化学选修4期中考试试题附答案
- 高中化学选修四期末测试题
- -2018高二化学选修4测试题及答案
- 高二化学选修4期末考试试题汇总
- (最新整理)化学选修四测试题
- 20172018高二化学选修4测试题及答案
- 高二化学选修四第一章测试题(精选.)
- 高二化学选修四第一章测试题 (1)
- 化学选修4-第四章测试题汇编
- 高二化学选修四第一二章测试题考试
- 人教版高中化学选修四高二化学期末测试题
- (完整word版)高二化学选修四练习题及其参考答案(完整版)
- 人教版高二化学选修4第二章测试题及答案解析
- 人教版高二化学选修四全套练习题
