最新高中化学必修一第三章知识点

金属及其化合物
前言:
1.金属元素在元素周期表中的位置在左边以及左下方;
2.金属元素最外层电子数一般小于4,比同一周期非金属元素原子半径大。
3.主要化合价为+1 +2 +3少数为+4
4.通常只能失去电子不能得到电子(还原剂)
分类1.黑色金属有色金属。黑色:铁锰铬
2. 轻金属重金属。密度4.5g/cm3为界限。
3.常见金属和稀有金属(锆)
金属中唯一的液态金属:汞。
一、钠及其化合物
1、(1)钠的物理性质:银白色、质软、比水轻、熔点低
(2)钠的化学性质:
与非金属反应:2Na+Cl2点燃
2NaCl (白烟)
2Na+S==Na2S
与O2反应:缓慢氧化:4Na+O2== 2Na2O (白色固体)
剧烈燃烧:2Na+O2== Na2O2 (淡黄色固体)
与H2O 反应:2Na+2H2O==2NaOH+H2↑
(2Na+2H2O==2Na++2OH―+H2↑)
与酸反应:2Na+2H+==2Na++H2↑
与盐溶液反应:(先与水作用生成NaOH,NaOH再与盐发生复分解反应) 2Na+2H2O+CuSO4 ==C u(O H)2↓+Na2SO4 +H2↑
6Na+6H2O+2FeCl3==2F e(O H)3↓+6NaCl+3H2↑
2Na+2NH4Cl===2NaCl+2NH3↑+H2↑
与熔融盐:4Na+TiCl4△
4NaCl+Ti
钠与氢气的反应:2Na + H2 == 2NaH。NaH + H2O == NaOH + H2 ↑;NaH是强的还原剂。
2、氧化钠与过氧化钠
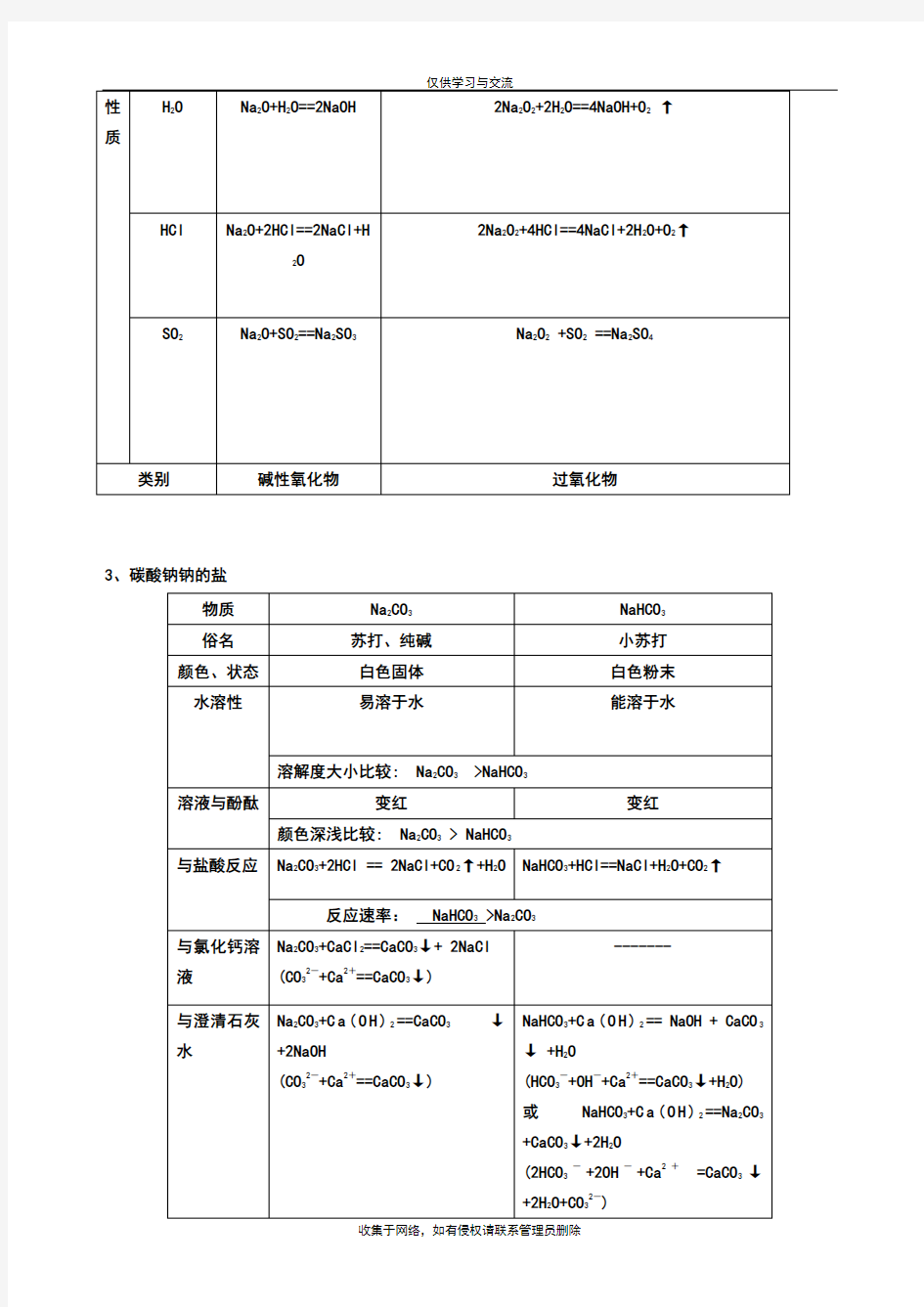
3、碳酸钠钠的盐
(3)工业制钠:电解熔融的NaCl,2NaCl(熔融) == 2Na + Cl2↑。
(4)钠的用途:①在熔融的条件下钠可以制取一些金属,如钛、锆、铌、钽等;
②钠钾合金是快中子反应堆的热交换剂;
③钠蒸气可作高压钠灯,发出黄光,射程远,透雾能力强
注意几个实验的问题:
1、向饱和的Na2CO3溶液中通足量的CO2有晶体NaHCO3析出。
2、Na2CO3溶液与稀HCl的反应①向Na2CO3溶液中滴加稀HCl,先无气体,后有气体,如果n(HCl)小
于n(Na2CO3)时反应无气体放出。发生的反应:先①Na2CO3 + HCl == NaCl + NaHCO3,后②NaHCO3 + HCl == NaCl + H2O +CO2 .
②向稀HCl中滴加Na2CO3溶液,先有气体,反应是:Na2CO3 + 2HCl == 2NaCl + H2O + CO2.
如果用2mol的Na2CO3和2.4mol的稀HCl反应,采用①方法放出CO2是0.4mol;采用②方法放出CO2
为1.2mol。希望同学们在解题时要留意。
3、Na2CO3溶液和NaHCO3溶液的鉴别:取两种试液少量,分别滴加CaCl2或BaCl2溶液,有白色沉淀
的原取溶液为Na2CO3,另一无明显现象的原取溶液为NaHCO3。
4、侯氏制碱法
反应式:NaCl + NH3 + CO2 + H2O == NaHCO3 ↓+ NH4Cl.
注意:在生产中应先在饱和的NaCl溶液中先通入NH3,后通入CO2,NaHCO3晶体析出过滤,在滤液中加入NaCl细末和通NH3析出NH4Cl晶体为副产品。NH4Cl晶体析出后的母液进行循环试用,提高原料的利用.
二、镁及其化合物
1、镁的性质
(1)物理性质:镁是银白色金属,质较软,密度1.74g/cm3,是轻金属,硬度小。
(2)化学性质:镁是较活泼金属
①与非金属反应:2Mg + O2 == 2MgO,Mg + Cl2 MgCl2,3Mg + N2 Mg3N2等。
②与沸水反应:Mg + 2H2O(沸水)== Mg(OH)2 + H2 ↑.
③与酸反应:与非强氧化性酸反应:是酸中的H+与Mg反应,有H2放出。
与强氧化性酸反应:如浓H2SO4、HNO3,反应比较复杂,但是没有H2放出。
④与某些盐溶液反应:如CuSO4溶液、FeCl2溶液、FeCl3溶液等。
Mg + 2FeCl3 == 2FeCl2 + MgCl2, Mg + FeCl2 == Fe + MgCl2.
2、镁的提取:海水中含有大量的MgCl2,因此,工业上主要是从分离了NaCl的海水中来提取MgCl2.
流程:海水中加入CaO或Ca(OH)2 Mg(OH)2沉淀、过滤、洗涤沉淀,用稀HCl溶解 MgCl2溶液,蒸发
结晶 MgCl2?6H2O晶体,在HCl气体环境中加热 MgCl2固体,电解熔融的MgCl2 Mg + Cl2 ↑。
主要反应:MgCl2 + Ca(OH)2 == Mg(OH)2↓+ CaCl2, Mg(OH)2 + 2HCl == MgCl2 + 2H2O, MgCl2?6H2O MgCl2 + 6H2O , MgCl2(熔融) Mg + Cl2↑。
3、镁的用途:镁主要是广泛用于制造合金。制造的合金硬度和强度都较大。因此镁合金被大量用火箭、导弹、飞机等制造业中。
4、氧化镁(MgO):白色固体,熔点高(2800℃),是优质的耐高温材料(耐火材料)。是碱性氧化物。MgO + H2O == Mg(OH)2, MgO + 2HCl == MgCl2 + H2O 。
注意以下几种情况的离子方程式的书写:
(1)n(Mg(HCO3)2):n(NaOH)=1:4:Mg2+ + 2HCO3- + 4OH- == Mg(OH)2↓+ 2CO32- + 2H2O;
(2)n(Mg(HCO3)2):n(NaOH)=1:2:Mg2+ + 2HCO3- + 2OH- == MgCO3↓+ CO32- + 2H2O;
(3)n(Mg(HCO3)2):N(NaOH)=1:1: Mg2+ + HCO3- + OH- == MgCO3↓+H2O 。
三. 铝及其化合物
(1)物理性质:银白色金属,质较软,但比镁要硬,熔点比镁高。有良好的导电、导热性和延展性。(2)化学性质:铝是较活泼的金属。
①通常与氧气易反应,生成致密的氧化物起保护作用。4Al + 3O2 == 2Al2O3。同时也容易与Cl2、S 等非金属单质反应。
②与酸反应:强氧化性酸,如浓硫酸和浓硝酸在常温下,使铝发生钝化现象;加热时,能反应,但无氢气放出;非强氧化性酸反应时放出氢气。
③与强碱溶液反应:2Al + 2NaOH + 2H2O == 2NaAlO2 + 3H2↑。
④与某些盐溶液反应:如能置换出CuSO4、AgNO3等溶液中的金属。
⑤铝热反应:2Al + Fe2O3 = Al2O3 + 2Fe。该反应放热大,能使置换出的铁成液态,适用性强。在实验室中演示时要加入引燃剂,如浓硫酸和蔗糖或镁条和氯酸钾等。
2.氧化铝和饥饿氢氧化铝
4、铝的冶炼:铝是地壳中含量最多的金属元素,自然界中主要是以氧化铝的形式存在。工业生产的流程:铝土矿(主要成分是氧化铝) 用氢氧化钠溶解过滤 向滤液中通入二氧化碳酸化,过滤 氢氧化铝 氧化铝 铝。主要反应:Al2O3 + 2NaOH == 2NaAlO2 + H2O ,CO2 + 3H2O + 2NaAlO2 == 2Al(OH)3↓+ Na2CO3 ,2Al(OH)3== Al2O3 +3 H2O ,2Al2O3== 4Al + 3O2↑。
5、铝的用途:铝有良好的导电、导热性和延展性,主要用于导线、炊具等,铝的最大用途是制合金,铝合金强度高,密度小,易成型,有较好的耐腐蚀性。迅速风靡建筑业。也是飞机制造业的主要原料。
6、明矾的净水:化学式:KAl(SO4)2?12H2O ,它在水中能电离:KAl(SO4)2 == K+ + Al3+ + 2SO42-。铝离子与水反应,生成氢氧化铝胶体,具有很强的吸附能力,吸附水中的悬浮物,使之沉降已达净水目的。Al3+ + 3H2O == Al(OH)3 (胶体)+ 3H+ 。 知识整理:
①(Al(OH)3)的制备:在氯化铝溶液中加足量氨水。AlCl3 + 3NH3?H2O == Al(OH)3↓+ 3NH4Cl 。 ②实验:A 、向氯化铝溶液中滴加氢氧化钠溶液,现象是先有沉淀,后溶解。 反应式:先Al3+ + 3OH- == Al(OH)3↓, 后Al3+ + 4OH- == AlO2- + 2H2O 。
B 、向氢氧化钠溶液中滴加氯化铝溶液,现象是开始无沉淀,后来有沉淀,且不溶解。 反应式:先Al3+ + 4OH- == AlO2- + 2H2O ,后Al3+ + 3AlO2- + 6H2O == 4Al(OH)3↓。
③实验:向偏铝酸钠溶液中通二氧化碳,有沉淀出现。CO2 + 3H2O + 2NaAlO2 == 2Al(OH)3↓+ Na2CO3。 ④将氯化铝溶液和偏铝酸钠溶液混和有沉淀出现。 Al3+ + 3AlO2- + 6H2O == 4Al(OH)3↓。 ⑤实验:A 、向偏铝酸钠溶液中滴加稀盐酸,先有沉定,后溶解。
反应的离子方程式:AlO2- + H+ + H2O == Al(OH)3 ,Al(OH)3 + 3H+ == Al3+ + 2H2O 。 B 、向稀盐酸中滴加偏铝酸钠溶液,先无沉淀,后有沉淀且不溶解。
反应的离子方程式:AlO2- + 4H+ == Al3+ + 2H2O ,3AlO2- + Al3+ + 6H2O == 4Al(OH)3↓。 四.铁及其化合物:
一.物理性质:银白色,具有金属光泽;质地较软,有良好的导电性、延展性。密度7.86 g/cm3,熔沸点较高。
位置:第四周期,第Ⅷ 族 二.化学性质:1.与非金属反应 1)Fe+S (I 2)
FeS (FeI 2) 2)4Fe+3O 2
2Fe 3O 4 3)2Fe+3Cl 2(Br 2) 2FeCl 3
弱氧化剂 Fe 3+
、H +
、I 2、S 、铁后的金属阳离子(置换)…
Fe 2+
Fe 强氧化剂 Cl 2、Br 2、HNO 3、浓H 2SO 4、MnO 4-(H +
) …
Fe 3+
2.与水反应 3Fe + 4H 2O(g)
Fe 3O 4 + 4 H 2 ↑(置换)
注意:铁在常温下不会和水发生反应,但在水和空气中O 2和CO 2的共同作用下,铁却很容易被腐蚀(生锈/电化学腐蚀)
中为无色晶体。
化 学 性 质
与酸 反应 Al 2O 3 +6HCl==AlCl 3 +3H 2O
(Al 2O 3+6H +
==Al 3+
+3H 2O) A l (O H )3+3HCl==AlCl 3+3H 2O (A l (O H )3+3H +
==Al 3+
+3H 2O)
与碱 反应
Al 2O 3+2NaOH==2NaAlO 2+ H 2O (Al 2O 3+2OH ―
=2AlO 2―
+H 2O)
A l (O H )3+NaOH=NaAlO 2+ 2H 2O A l (O H )3+OH ―
=AlO 2―
+2H 2O
相互转化 ----
2A l (O H )3
△
Al 2O 3+3H 2O
3 与酸反应
1)与非氧化性酸反应 Fe +2H+== Fe2+ + H2
2)与氧化性酸反应
a)常温下,铁在冷浓硫酸,浓硝酸中发生钝化
b)与浓硫酸反应:2Fe +6 H2SO4(浓)Fe2(SO4)3 +3SO2 +6 H2O
c)与稀硝酸反应:①当Fe少量时,离子方程式为:Fe + 4H+ + NO3-== Fe3++NO↑+2H2O
②当Fe过量时,,离子方程式为:3Fe+8H++2NO3-== 3Fe2++2NO↑+4H2O
③当1:4<n( Fe) :n (HNO3)<3:8 时,此情况下,Fe3+ 和Fe2+共存。
4.与盐溶液反应 2Fe 3++ Cu = 2Fe 2++ Cu 2+
Fe + 2Fe3+ = 3 Fe2+
Fe + Cu2+ = Fe2+ + Cu
铁的氧化物
FeO Fe2O3Fe3O4
颜色、
状态
黑色粉末红棕色粉末黑色晶体俗名---铁红磁性氧化铁
水溶性不溶不溶不溶
稳定性不稳定,在空气里
加热迅速被氧化,
稳定稳定
氧化物
类别
碱性氧化物碱性氧化物复杂氧化物
与非氧化性酸反应FeO+2HCl==FeCl2+
H2O
(FeO+2H+==Fe2+
+H2O)
Fe2O3+6HCl==2FeC
l3 +3H2O (Fe2O3+6H
+==2Fe3+ +3H
2O )
Fe3O4+8HCl==2FeCl3+FeCl2+4H2O
Fe3O4+8H+==2Fe3++Fe2++4H2O
2、铁的氢氧化物
(1)Fe(OH)2的制备
Fe(OH)2易被氧化,在制备时应注意:⑴ FeS O4晶体中不能有 Fe3+;⑵配制后的FeSO4溶液中要加入
少量铁粉;⑶配制溶液的蒸馏水以及所用NaOH溶液均须煮沸以除去其中溶解的氧气;
实验:FeSO4溶液中加NaOH.
①现象:生成白色沉淀,后又迅速转变为灰绿色,最后生成红褐色
②Fe2+容易被氧化,所以FeSO4溶液要新配制.
③为了防止滴加NaOH时带入空气,可将吸收NaOH的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液.
④为了防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量煤油或其它密度比水小但不溶于水的有机物以隔绝空气.
化学方程式: FeSO4 + 2NaOH = Fe(OH)2↓+Na2SO4 Fe2++ 2OH -= Fe(OH)2↓(白色)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(红褐色)
(白色→灰绿色→红褐色)
(2)Fe(OH)3的制备
实验:FeCl3溶液中加NaOH溶液.
①现象:生成红褐色沉淀
②化学方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaCl Fe 3++ 3OH -= Fe(OH)3↓(红褐色)
③热稳性:Fe(OH)3对热不稳定,受热能失去水生成红棕色的Fe2O3粉末.
化学方程式: 2Fe(OH)3 Fe2O3 +3H2O
[小结]难溶性或微溶性的碱受热不稳定,容易分解。生成相应的氧化物和水
(3)Fe(OH)3胶体的制备
向加热沸腾的蒸馏水中加入FeCI3溶液,待出现红褐色时,停止加热,便可得到 Fe(OH)3胶体。制备时要注意:⑴不可长时间加热,因为加热会使胶体凝聚;⑵不能用自来水,因为自来水中的电解质也可使胶体凝聚。
四.铁的两种氢氧化物的比较
化学式Fe(OH)2Fe(OH)3
色、态白色固体红褐色固体
溶解性难溶于水难溶于水
物质类别二元弱碱三元弱碱
与非氧化性酸的
反应Fe(OH)2+H2SO4=FeSO4+2H2O
Fe(OH)2+2H + =Fe2+ +2H2O
2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O
Fe(OH)3+3H + =Fe3+ +3H2O
与氧化性酸的反
应
3Fe(OH)2+10HNO3(稀)=3Fe(NO3)3+NO↑
+8H2O
3Fe(OH)2+10H + +NO3 -=3Fe 3+ +NO↑+8H2O
Fe(OH)3+3HNO3(稀)=Fe(NO3)3+3H2O
Fe(OH)3+3H+=Fe3++3H2O
与还原性酸的反
应Fe(OH)2+2HI=FeI2+2H2O
Fe(OH)2+2H+ =Fe2++2H2O
2Fe(OH)3+6HI=2FeI2+6H2O+I2
2Fe(OH)3+6H + +2I-=2Fe2++6H2O+I2
热稳定性分解产物复杂2Fe(OH)3 Fe2O3 +3H2O 五.铁盐和亚铁盐
(1)Fe3+、Fe2+的检验:
Fe3+的检验: 1.Fe3+盐溶液中滴加KSCN溶液。
现象是溶液变红色,反应方程式:FeCl3+3KSCN= Fe(SCN)3+3KCl
Fe 3++3SCN -= Fe(SCN)3(红色)
2.向Fe3+盐溶液中滴加NaOH溶液。
现象是产生红褐色沉淀,反应方程式:FeCl3+3NaOH= Fe(OH)3↓+3NaCl
Fe 3++ 3OH -= Fe(OH)3↓(红褐色)
3. 向Fe3+盐溶液中滴加苯酚溶液。
现象是溶液变为紫色,则证明溶液中含有Fe3+。
Fe2+的检验: ①向Fe2+盐溶液中滴加KSCN溶液,再滴加氯水(硝酸、H2O2等)。
现象是先无现象,加氯水后溶液呈红色
反应方程式:2FeCl2+Cl2=2FeCl3 FeCl3+3KSCN= Fe(SCN)3+3KCl
②向Fe2+盐溶液中滴加NaOH溶液。
现象是产生白色沉淀迅速转变为灰绿色,最后变成红褐色沉淀
反应方程式:FeCl2+2NaOH= Fe(OH)2↓+2NaCl
