由本胺合成对硝基苯胺

实验一 乙酰苯胺的制备
姓名:闫国芳 班级:应化1302 学号:201309030230
一、实验目地和要求
1. 掌握由苯胺制备乙酰苯胺的实验原理;
2. 进一步熟悉重结晶、测熔点等操作技术。
二、实验原理
+
O
O
O
OH
O
H N
O
OH
O
+
1,实验机理;
H
H
+
C
O
O
C O
H 3C
CH 3
N H H CH 3
O
C O
O CH 3
H N
CH 3
O +
CH 3COOH
2,实验方法或操作原理:
重结晶:重结晶是利用固体混合物中目标组分在某种溶剂中的溶解度随着温度的变化有明显差异,在较高温度下溶解度较大,降低温度时溶解度减小,从而实现分离提纯。其中,选择溶剂的标准如下:(1)不与被提纯物质发生化学反应:(2)在较高温度下能溶解多亮被提纯物质,而使温度降低时,溶解度减小;(3)对杂质的溶解度非常大(杂质留在母液中)或非常小(热过滤滤去);(4)容易挥发(溶剂的沸点较低),使其易于结晶分离。
三、主要药品的用量及规格
名称 理论用量 实际用量 过量 理论产量
苯胺 5mL/55mmol 5mL 0 醋酸酐 10mL/64mmol
10mL 0 乙酸 乙酰苯胺
6mL
5mL
7.43g
四、物性常数
名称分子量熔点沸点理溶解度
苯胺93.12 -6.3 184 微溶于水,溶于乙醇乙酸酐102.09 -73.1 138.6 微溶于水,溶于乙醇
乙酸
乙酰苯胺
60.1
135.16
16.6
114.3
117.9
305
溶于水,溶于乙醇
微溶于冷水,溶于热水与乙醇
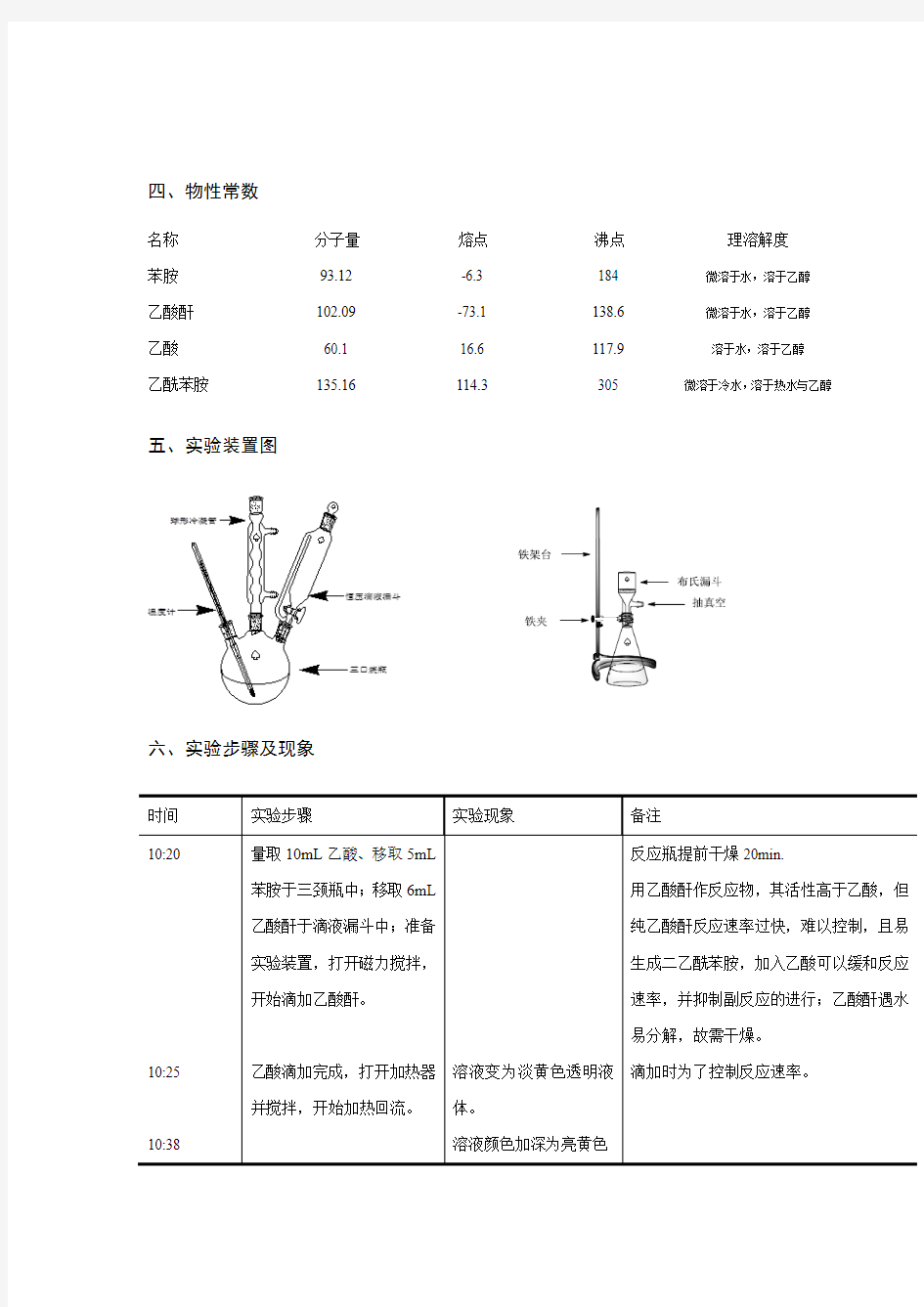
五、实验装置图
六、实验步骤及现象
时间实验步骤实验现象备注
10:20
10:25 10:38 量取10mL乙酸、移取5mL
苯胺于三颈瓶中;移取6mL
乙酸酐于滴液漏斗中;准备
实验装置,打开磁力搅拌,
开始滴加乙酸酐。
乙酸滴加完成,打开加热器
并搅拌,开始加热回流。
溶液变为淡黄色透明液
体。
溶液颜色加深为亮黄色
反应瓶提前干燥20min.
用乙酸酐作反应物,其活性高于乙酸,但
纯乙酸酐反应速率过快,难以控制,且易
生成二乙酰苯胺,加入乙酸可以缓和反应
速率,并抑制副反应的进行;乙酸酐遇水
易分解,故需干燥。
滴加时为了控制反应速率。
10:40 10:52
11:04 11:15 11:30
11:40 11:55 12:02
12:10 12:15
12:35 停止加热,冷却反应瓶
冷却完毕,加入5mL水,并
加热。
停止加热,并冷却,将产物
加入到40mL冷水中,静置
冷却。
对粗产品进行抽滤,并用冷
水洗涤两次。
取少量粗品于表面皿,置于
干燥箱干燥,待测熔点
转移其余粗品于烧杯,加适
量水,于电炉上加热溶解
向烧杯中加入少量活性炭
将产物热抽滤,取母液。
将母液进行二次抽滤,取滤
饼
转移产品于表面皿,置于干
燥箱进行干燥
打开熔点测试仪,准备载玻
片测粗品熔点。
将产品进行称重装袋.
加入到冷水中时,有白
色晶体迅速析出,固体
呈蓬松状。
有油状液滴产生
产品为亮白色晶体
初熔:119℃;全熔:
121℃
乙酰苯胺溶于热水,微溶于冷水,产物在
冷水中充分结晶。
洗去附着在晶体上的可溶杂质。
乙酰苯胺在水中的溶解度随着温度的升
高而增大。因此水可作为提纯溶剂;
油状液滴为含水的熔融状态的乙酰苯胺
(83℃时含水13%)。
活性炭用于脱色及吸附杂质。
将活性炭及不溶杂质滤掉
滤去可溶性杂质。
不用水蒸汽干燥,因乙酰苯胺易溶于热
水。
熔程119℃-121℃,乙酰苯胺熔点:114℃,
熔程偏高原因:(1)加热太快,升温过
高;(2)装样不够紧密,内有空气,传
热慢,导致温度偏高。
m产+袋=2.05g,m袋=0.31g,m产=2.34g.
七、产品与产率
产品:乙酰苯胺,分子量135.17,白色片状结晶,熔点114℃。产率:(5?1.022)/93.13=0.055mol 0.055?135.17=7.42g
ω(产率)=2.34/7.42=31.54%
八、结论与分析
本实验产量较低,原因有:1,实验中转移药品不规范,损耗药品;2,重结晶过程中抽滤瓶结晶物析出过快,未能充分抽滤。
九、实验配图;
十、熔点数据
T
初熔(℃)T全熔
(℃)
熔程
粗品测量1 119 121 119-121 测量2 119 121 119-121
纯品测量1 118 120 118-120 测量2 118 120 118-120
实验二 对硝基苯胺的制备
一、实验目的和要求
1. 掌握由乙酰苯胺经硝化、酸解制备对硝基苯胺的实验原理;
2. 熟悉各过程的操作技术。
二、实验原理
1.反应方程式
NHCCH 3
O HNO 3H 2SO 4
NHCCH 3
O
NO 2
+
NHCCH 3
O NO 2
NHCCH 3
O NO 2
+
NHCCH 3
O NO 2
1.H 2SO 4,H 20
2.NaOH,H 2O
NH 2
NO 2
+
NH 2
NO 2
2.机理
NHCCH 3
O NHCCH 3
O HO-NO 2
NHCCH 3
O
+
NO 2
NO 2
NHCH 2CH 3
NHCCH 3
O +
O
H
NO 2
H
NO 2
-H +
NHCCH 3
O NO 2
+
NHCCH 3
O NO 2
NHCCH 3O NO 2
S O
O
OH
O H
NCCH 3O
NO 2
H
H S O
O
OH
O
NH 2NO 2
3,操作原理:TLC 分析
因吸附剂对不同物质有不同程度的吸附,展开剂对不同物质的溶解度液不相同。用毛细管将混合液点在薄层板上,将板放入展缸后,溶剂上升,上升至标线后,混合物溶解,溶解后随着不断上升的溶剂移于标线之上,遇到吸附剂又被吸附,接着又溶解、解吸,使斑点不断上移。在上升过程中,由于有的成分吸附的牢些,上移速度慢,反之则快。从而达到“差速迁移”,当展开一定距离后,就可以达到分离的目的。斑点上升的高度用R f 表示,:R f =标线至斑点中心的距离/标线至溶剂前沿的距离。展开剂的选择主要根据样品的极性、溶解度、和吸附剂的活性等因素来考虑;常用的吸附剂有硅胶、活性氧化铝等。
三、主要药品的用量及规格
名称 理论用量 实际用量 过量 理论产量
乙酰苯胺 2.4g/0.018mol
2.34g -0.06g 冰醋酸 4.0mL 4.0mL 浓硫酸
5.0mL
5.0mL
浓硝酸
对硝基苯胺1.5mL 1.5mL
2.45g
四、物性常数
名称分子量熔点沸点理溶解度浓硫酸98.08 10 337 混溶浓硝酸63.01 -42 120.5 混溶冰醋酸60.05 16.6 117.5 混溶
乙酰苯胺
对硝基乙酰苯胺邻硝基乙酰苯胺对硝基苯胺邻硝基苯胺135.17
180.16
180.16
138.12
138.12
114.3
215.6
94
148.5
69.7
304
100
100
331.7
284.5
溶于热水,微溶冷水
溶于热水,微溶冷水
溶于热水,微溶冷水
溶于热水,微溶冷水
溶于热水,微溶冷水
五、实验装置图
六、实验步骤及现象
时间实验步骤实验现象备注
8:35 准确移取1.5mL浓硝酸于
锥形瓶,置于冰水浴中,移本反应在温度低于5℃时产物以对硝基乙酰苯胺为
8:40
8:50 9:00 9:15
10:05 10:15 10:25 10:40 10:58 取2.0mL浓硫酸于浓硝酸
中,冷却在冰水浴中。称取
2.34g乙酰苯胺于圆底烧瓶
中,并分别移取4.0mL冰
醋酸和5.0mL浓硫酸溶解
乙酰苯胺。静置在冰水浴中
将冷却的混酸转移至滴液
漏斗中,架好反应装置,滴
加混酸。
混酸滴加完毕,静置锥形瓶
测本次反应物乙酰苯胺的
熔点
回流完毕,将溶液倒入
15mL水中,
向溶液中滴加氢氧化钠,用
pH试纸不断测溶液的pH,
使溶液呈碱性。
氢氧化钠滴加完毕,抽滤产
品,并用冷水洗涤两次。
测产物熔点
取少量产物用乙醇溶解,以
乙酸乙酯:石油醚1:2作展
开剂作TLC分析。用毛细
管在硅胶板上点样,置于紫
溶液变为淡黄色
溶液变为红棕色
初熔:184℃;全熔:188℃。
溶液呈红棕色
每次滴加氢氧化钠后,溶液
中均有棕色沉淀产生并快
速溶解。
有红棕色粉末析出
初熔:144℃;全熔:150℃
明显观察到两个点,测量
后,一个距标线0.8cm,另一
个距 1.35cm。展开剂距标
线3.8cm.
主,故需冰水浴;
冰醋酸的作用:加快乙酰苯
胺的溶解;抑制乙酰苯胺的
水解。
滴加时控制滴速2s/滴左
右,以便控制反应瓶内温
度。(本反应为放热反应)
反应过程中有其他硝基副
产物产生,使颜色加深。
熔程:184-188℃,对硝基
乙酰苯胺的熔点为
215.6℃,邻硝基乙酰苯胺
的熔点为94℃。说明产物
为两者的混合物。且以对位
为主。
由于下一步要中和硫酸,中
和放热,需用冷水降温,水
温不宜过低,防止析出硫酸
钠。
中和多余的酸,使产物析
出。
洗去可能析出的硫酸钠及
其他附着在晶体上的杂质
熔程144-150℃,对硝基苯
胺熔点:148.5℃,在熔程
范围内,产物较纯。
R f1=0.8/3.8=0.21;
R f2=1.35/3.8=0.36
外灯下观察
七、产品与产率
产品:对硝基苯胺,黄色针状晶体,高毒,易升华。熔点148.5℃。
本次试验中制得的产品为红棕色晶体,经过TLC分析,有两个点。其R f不同,因邻硝基苯胺极性弱于对硝基苯胺。因此它在薄板上移动得更快。故可判断邻硝基苯胺的R f=0.36,对硝基苯胺的R f=0.21。
八、实验感悟
由于在实验操作中用氢氧化钠中和多余的酸时,对pH的估计有误,导致氢氧化钠滴加过量,使得产品析出很少,只能用于测熔点和进行TLC分析。本次实验出错,是因为没有完全了解产品的性质以及药品的用处。只知道氢氧化钠用于中和,却不知道中和到什么程度;只知道对硝基乙酰苯胺可以酸式水解,不知道产品对硝基苯胺在什么pH值下最大程度的析出。以后预习的时候一定注意。
九、实验附图
十、测熔点数据
T初熔(℃)T全熔
(℃)
熔程
粗品测量1 184 188 184-188 测量2 184 188 184-188
纯品测量1 144 150 144-150 测量2 144 150 144-150
实验三对硝基苯胺纯化—水蒸气蒸馏
一、实验目的和要求
1. 掌握对硝基苯胺粗产物经水蒸气蒸馏进行纯化的原理;
2. 掌握水蒸气蒸馏的操作技术。
二、实验原理
水蒸气蒸馏法:水蒸气蒸馏是纯化分离有机化合物的重要方法之一。
当水和不溶或难溶于水的化合物一起存在时,整个体系的蒸汽压根据道尔顿分压定理,应为各组分蒸汽压之和。即:P=P水+P A(P A为不溶或难溶化合物的蒸汽压)。
当P与外界大气压相等时,混合物就沸腾,这时的的温度就为它们的沸点,所以混合物的沸点将比任何组分的沸点都要低。这样的操作就叫水蒸气蒸馏。
水蒸气蒸馏常用于以下场合:(1)某些沸点高的有机物,在常压蒸馏下虽可与副产品分离,但易将其破坏;(2)混合物中含有大量杂质,采用蒸馏、萃取等方法难以分离;(3)从较多固体反应物中分离出被吸附液体。
被提纯物质要求:(1)不溶于水或难溶于水;(2)共沸下与水不发生化学反应;(3)在100℃时,需有一定程度的蒸汽压。邻硝基苯胺形成的是分子内氢键,而对硝基苯胺形成的是分子间氢键。因此对硝基苯胺的极性较大。邻硝基苯胺的蒸汽压0.13KPa/104℃,对硝基苯胺的蒸汽压0.13KPa/142.4℃。它们的沸点均很高,常压蒸馏时,温度过高,或将其破坏,因此选择水蒸汽蒸馏。
三、主要药品的用量及规格
名称理论用量实际用量理论产量
粗产品CH2Cl2
0.5g
30mL
0.5g
30mL
四、物性常数
名称分子量熔点沸点密度理溶解度(水)
对硝基苯胺邻硝基苯胺二氯甲烷138.12
138.12
84.93
148.5
69.7
-95.1
331.7
284.5
39.8
1.424
1.440
1.327
微溶于冷水,溶于热水
微溶于冷水,溶于热水
微溶于水
五、实验装置图;
六、实验步骤及现象
时间实验步骤实验现象备注
8:20 8:30 8:50 8:52 称取0.5g对硝基苯胺粗品
于三口瓶中,加入15mL
水。
往蒸汽瓶中加入约1/2体
积水,置于电炉上加热,搭
建水蒸气蒸馏装置。
将T型管用夹子夹住,并
调节蒸汽流速
少量固体溶解,溶液呈淡黄
色
有液滴从T型管口滴出,
并很快产生蒸汽
三口瓶中液体呈沸腾状,溶
液逐渐转变为棕黄色。
对硝基苯胺微溶于水,粗品
中也有可溶性杂质
加热过程中T型管是不夹
夹子的,它用来检验是否有
蒸汽产生。
说明水蒸气已经形成。
蒸汽使三口瓶内温度升高,
对硝基苯胺开始溶解,呈现
出棕色
8;55
9:10 9:20
9:25 9:35 9:55 10:02 10:10 关闭电炉,去掉水蒸气蒸馏
装置,将装置改为普通蒸馏
装置
收集完最后一瓶副产物,关
闭加热套,拆除蒸馏装置,
将三口瓶进行常温冷却。
将分出液用等体积的二氯
甲烷萃取,并收集有机相
取1mL乙酸乙酯,2mL石
油醚加入到展开缸,准备硅
接受瓶中有淡黄色液滴滴
出
第一瓶溶液接满,呈淡黄色
接受瓶中液滴滴速变缓,并
接收到第二瓶淡黄色液体
第三瓶中开始有液滴滴下
静置分液漏斗摇匀后,瓶内
液体分两层,上层颜色较
淡,下层较深。均呈黄色。
出现两个黄色斑点,上面的
较明显,下面的不清晰。并
水蒸气使得三口瓶内溶液
沸腾,蒸汽继续上升,同时
将蒸汽压较低的邻硝基苯
胺带出
随着水蒸气的大量蒸出,邻
硝基苯胺浓度减小,蒸出速
度变慢
在水蒸气蒸馏时,有大量水
进入到三口瓶中,导致三口
瓶中水过多,需除去
蒸馏过程中主要是水,还有
少量的邻硝基苯胺。(蒸馏
温度不应超过300℃,否则
对硝基苯胺也会被蒸出)
不用其他快速方式冷却是
因为温度的快速降低使晶
体结成块状,并会有大量的
杂质被包裹其中。
二氯乙烷的相对密度为
1.33,大于水,在下层。因
此下层颜色较深。上层有色
是对硝基苯胺微溶于水。
R f1=0.39,R f2=0.65
对硝基苯胺的机性大,R f
较小;应为0.39;邻硝基苯
胺的极性小,R f较小,应为
0.65.
纯对硝基苯胺性状:淡黄色
10:25 10:30 10:35 10:38 10:40 10:45 10:49 11:05 胶板、毛细管点样画标线。
作TLC分析。并在紫外灯
下观察样点
将冷却的三口瓶中液体进
行抽滤,并用冷水洗涤两次
将滤饼上的晶体转移至表
面皿置于干燥箱中干燥
向已经收集的有机相中加
入无水硫酸镁固体
转移已干燥的有机相至圆
底烧瓶,并连接在旋转蒸发
仪上。
调节烧瓶在水浴的高度,打
开真空泵开关,并打开旋转
按钮,设置水温,并间断性
打开活塞调节气压。
用无水乙醇溶解固体,点
样,置于展缸中。稍后在紫
外灯下观察
干燥固体完毕,取少量干燥
的固体溶于丙酮中,进行
TLC分析
且测出数据如下:
R1=1.25;R2=2.1;R=3.2
冷却后已有固体析出在瓶
底;抽滤后,滤饼上固体呈
黄色针状晶体
圆底烧瓶内液体逐渐蒸发
完,有红棕色固体附着在瓶
壁上。
出现两个黄色斑点,测得
R1=1.35,R2=1.9。R=3.0
出现一个黄色斑点
针状晶体
干燥箱的温度不宜过高,产
品中可能有熔点只有
69.7℃的邻硝基苯胺存在,
可能会熔化。
用无水硫酸镁吸水干燥有
机相
旋转蒸发仪:减压条件下连
续蒸馏易挥发性溶剂。
转动以增大蒸发面积。
真空泵和水浴锅使溶液在
负压下旋转进行加热扩散
蒸发。
高效冷却器加速蒸汽液化
水温大于40℃,石油醚的
沸点40~80℃。
R f1=0.45,R f2=0.63
同上一次测量值,对硝基苯
胺的Rf为0.45,邻硝基苯
胺的Rf为0.63。
R1=0.6,R=3.0,Rf=0.2
说明只有产物对硝基苯胺,
其Rf为0.2。
七、产品分析
水蒸气蒸馏后,对有机相作TLC分析,出现两个斑点,原因可能是在蒸馏时,开始时速率过大,将三口瓶中少量对硝基苯胺也冲到接受瓶中。使得收集到的邻硝基苯胺中含有对硝基苯胺。
对产物对硝基苯胺进行TLC分析,只出现一个黄色斑点,说明产物较纯。
八、实验体悟
本次实验中,由于没有很好的控制电炉的温度,水蒸气气流速率突然间增大,导致少量溶液被冲到接受瓶,影响了分离效果。对水蒸气的蒸馏操作技术还不够熟练。
九、实验附图;
实验四对硝基苯胺纯化—柱层析
一、实验目的和要求
1. 掌握对硝基苯胺粗产物经柱层析进行纯化的原理;
2. 掌握柱层析的原理及操作方法。
二、实验原理;
柱层析法的分离原理是根据物质在吸附剂上的吸附力不同而使各组分分离。一般情况下,极性较大的物质易被吸附剂吸附,极性较弱的物质不易被吸附,当采用溶剂洗脱时,发生一系列吸附-解吸-再吸附-再解吸的过程,吸附力较强的组分,移动距离小,后出柱;吸附能力较弱的组分,移动距离大,先出柱。
极性小的用乙酸乙酯:石油醚系统;极性较大的用甲醇:氯仿系统。极性大的用甲醇:水系统;拖尾可加入少量氨水或冰醋酸。
利用极性相似相容的原理,看流动相与固定相的极性,大部分固定相的极性小于流动相,然后流动相的极性与所要洗脱的物质极性比较接近,从而将物质洗脱出来。
三、物性常数
名称分子量熔点沸点极性对硝基苯胺138.12 148.5 331.7 较大
邻硝基苯胺138.12 69.7 284.5 较小
四、实验装置图
五、实验步骤及现象
时间实验步骤实验现象备注
8:30
8:32 8:35
8:45 9:10 9:20
9:35 9:47 9:55 10:12 10:25 安装柱色谱管,向底部加一
团棉花,并铺一层海砂
取2-3g硅胶,溶解于石油
醚中、搅拌。
置漏斗于柱色谱管中,边搅
拌边加入硅胶。并加入适量
石油醚,保证柱中一直有液
体留下。
取0.1g粗品溶于丙酮中,
加入2g硅胶,搅拌式丙酮
挥发出粉末状
将样品转移至柱色谱中,加
入一层海砂,用洗耳球加压
1-2次,并加入展开剂。
对接收到的两种溶液进行
TLC分析
色谱柱上出现明显分层,下
层为淡黄色,上层为黄色
下层淡黄色溶液开始滴下
下层淡黄色溶液基本流出
上层黄色溶液开始流出
上层黄色溶液流出
在点样的两个点中,淡黄色
斑点移动的距离:R1=1.2,
黄色斑点移动距离:
R2=0.9。展开剂移动距离:
棉花防止硅胶随着展开
剂留下来,相当于过滤
装置中的滤纸;海砂使
得棉花更致密。
湿法装柱。(搅拌时必
须快速,不能让硅胶沉
淀下去)
准备干法加样。
海砂将样品压平,提高
分离效果,同时避免洗
耳球加压时将样品吹
起。
R f1=0.41;R f2=0.31。
R=2.9
六:产品分析
由于邻硝基苯胺形成的是分子内氢键,对硝基苯胺形成的是分子间氢键。因此,对硝基苯胺的极性较大,在色谱柱中后出来呢。故色谱柱上的黄色谱带是对硝基苯胺的。在进行TLC分析时,R f值为0.31的也就是对硝基苯胺。同样,R f值为0.41的是邻硝基苯胺。
七、实验感悟
本实验采用的是湿法装柱,干法上样。湿法装柱的操作之前没有接触过,第一次装柱时,由于硅胶太稀,搅拌不均,导致硅胶沉在底部,只有石油醚进入到柱色谱中。使得第一次装柱失败。第二次有了经验,装柱顺利了许多。
本实验该注意的点有:1,溶解硅胶所用的丙酮量要控制恰当;
2,滴加洗脱剂要用滴管,且要边旋转;
九、实验附图
关于三种分离方法优缺点的比较
分离邻硝基苯胺和对硝基苯胺可通过分馏、水蒸气蒸馏法以及柱色谱分离法。特点如下:
(一)分馏法
由于邻硝基苯胺的沸点为284.5℃,对硝基苯胺的沸点为331.7℃,温差为47.2℃,因此可用分馏的方式分离。
分馏原理及特点:分馏混合液沸腾后蒸气进入分馏柱中被部分冷凝,冷凝液在下降途中与继续上升的蒸气接触,二者进行热交换,蒸汽中高沸点组分被冷凝,低沸点组分仍呈蒸气上升,而冷凝液中低沸点组分受热气化,高沸点组分仍呈液态下降。结果是上升的蒸汽中低沸点组分增多,下降的冷凝液中高沸点组分增多。如此经过多次热交换,就相当于连续多次的普通蒸馏。以致低沸点组分的蒸气不断上升,而被蒸馏出来;高沸点组分则不断流回蒸馏瓶中,从而将它们分离。
分馏实际为多次蒸馏,更适合于分离提纯沸点相差不大的液体有机混合物。
(二)水蒸气蒸馏
邻硝基苯胺的蒸汽压为0.13Kpa/104℃,而对硝基苯胺的为0.13Kpa/142.4℃,将混合液进行水蒸气蒸馏,可有效分离。
水蒸气蒸馏特点:(1)某些沸点高的有机物,在常压蒸馏下虽可与副产品分离,但易将其破坏;(2)混合物中含有大量杂质,采用蒸馏、萃取等方法难以分离;(3)从较多固体反应物中分离出被吸附液体。
水蒸气蒸馏蒸馏分离效果不如柱层析好,因蒸馏过程中总有粗品没被蒸出,而且产品有时会被带出,会很消耗产品。
(三)柱层析分离
邻硝基苯胺形成分子内氢键,对硝基苯胺形成分子间氢键。故对硝基苯胺极性较大,邻硝基苯胺极性较小。可通过极性的不同进行柱层析分离。
柱层析分离常用于分离极性不同的少量有机物,是有效分离混合物组分的一种方法。它操作简单,分离效果好,普遍用于有机合成中。但由于各组分的吸附力不同,有些组分吸附力很大,流动时间长,需要长时间保证洗脱剂在柱中流动。比较耗时间。
对硝基苯胺的制备及纯化
对硝基苯胺的制备 段东斑 (武汉大学化学与分子科学学院湖北武汉430072)
目录 一、实验目的-------------------------------------------------------3 二、实验原理-------------------------------------------------------3 2.1合成-----------------------------------------------------------3 2.2产品的分离与纯化-------------------------------------------4 三、主要试剂及产物的物理常数--------------------------------5 四、主要试剂规格、用量-----------------------------------------6 五、实验装置图-----------------------------------------------------6 六、实验步骤与现象-----------------------------------------------6 6.1苯胺的乙酰化--------------------------------------------------7 6.2乙酰苯胺的硝化---------------------------------------------7 6.3硝基乙酰苯胺的水解-----------------------------------------7 6.4柱层析与薄层层析------------------------------------------8 6.5蒸馏-----------------------------------------------------------8 七、产品的表征与纯度分析-------------------------------------9 7.1熔点的测定--------------------------------------------------9 7.2薄层色谱(TLC)---------------------------------------------10 7.3核磁共振氢谱1HNMR -------------------------------------10 八、产率计算及分析---------------------------------------------11 九、讨论------------------------------------------------------------12 十、其他合成方法------------------------------------------------13
对硝基苯胺的合成
对-硝基苯胺的制备MSDS 化合物名称 分子 量 性状 比重 (d ) 熔点 (℃) 沸点 (℃) 折光率 (n) 溶解度 水乙醇乙醚 苯胺93.12 液体 1.022 -6.1 184.4 1.586 3.618∞∞冰醋酸60.05 液体 1.049 16.5 118.1 1.371 ∞∞∞ 乙酰苯胺135 .1 斜方晶 体 1.214 133.4 305 - 0.53 3.580 21.20 46.60 7.25 对硝基苯胺138 .1 淡黄色 针状结 晶 1.424 148.5 331.7 0.000 8 邻硝基苯胺138. 12 橙黄色 针状结 晶 1.44 69.7 284.5 一、实验目的 1利用乙酰苯胺制备对-硝基苯胺; 2掌握连续合成的方法,复习抽滤、重结晶等实验基础操作。 二、实验原理 由于氨基对于苯环是强活化基团(亲电试剂主要进攻其邻对位),故可生成对硝基苯胺及邻硝基苯胺,降低了对-硝基苯胺的产率,因此我们用乙酰基对氨基进行保护。而且,加入乙酰基后,由于其空间结构较大并且降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使氨基由很强的第1类定位基变成中等强度的第1类定位基,使反应由多元取代变为有用的一元取代,这些均有利于后来的硝基在对位进行取代。在某些情况下,酰化可以避免氨基与其它功能基或试剂(如RCOCl,-SO2Cl,HNO2等)之间发生不必要的反应。 综合以上考虑,本实验中采用“乙酰苯胺→对-硝基乙酰苯胺→对-硝基苯胺”步骤进行合成。 以乙酰苯胺为反应物制备对-硝基乙酰苯胺,进而脱保护制备对-硝基苯胺,反应方程式如下:
NHCOCH3 +HNO3H2SO4 HOAc NHCOCH3NHCOCH3 + NO2 NO2 NHCOCH3NHCOCH3 + NO2 NO2NH2NH2 + NO2 NO2 +H2O KOH EtOH +CH3COOK 在制备对-硝基乙酰苯胺时,用醋酸做溶剂同时可以防止乙酰苯胺或对-硝基乙酰苯胺水解。对于产物来说,酸或碱都能够促使其水解,为了将粗产物中残留的酸中和掉而又不过量,实验中使用磷酸二氢钠,其中和结果是一种pH接近中性的缓冲溶液。由于邻-硝基苯胺形成分子内氢键,沸点低,对-硝基苯胺形成分子间氢键,沸点高,所以二者可以用水蒸气蒸馏的方法进行分离。 三、实验试剂 苯胺、浓盐酸、活性炭、乙酸酐、乙酸钠、冰醋酸、浓硫酸、浓硝酸、冰块、15%磷酸氢二钠溶液、95%乙醇、1:1硫酸、20%氢氧化钠溶液、石油醚、丙酮 四、实验步骤 乙酰苯胺→对-硝基乙酰苯胺→对-硝基苯胺 1..对-硝基乙酰苯胺的制备 在干燥的50ml锥形瓶中放入5克乙酰苯胺(0.037mol),加入7.9ml冰醋酸,加热至溶解。稍冷后相继用冷水浴和冰水浴冷却到10℃,滴入7.9ml浓硫酸,再在冰水浴中冷到10℃左右,溶液变得浓稠。 在干燥的25ml锥形瓶中混合3ml浓硝酸(含硝酸约0.044mol)和2.1ml浓硫酸,塞住瓶口,用冷水浴冷却到10℃到15℃,然后用滴管慢慢滴加到已制备的乙酰苯胺溶液中,边滴加边摇匀,控制反应温度在15℃到20℃之间,10到15分钟滴完。之后再室温下放置半小时以上,并注意监视温度变化。若发现温度上升超过室温,应以冰水浴冷却到15℃,然后重新在室温下放置并观察温度变化,直至在室温下连续放置半小时而温度不超过室温为止。 在100ml烧杯中放置42.5ml水和10克碎冰,将反应混合物倾注其中,搅拌,抽滤,尽量压干。 将固体转移到100ml烧杯中,加入15%磷酸氢二钠水溶液42.5到45ml,使液体呈中性,搅拌成糊状,抽滤。用约15ml水荡洗烧杯,一并转入抽滤漏斗,抽干后再用约25ml冷水洗涤滤饼,重新抽滤,用玻璃塞挤压滤饼,尽量抽干。将固体转移到表玻璃上晾干。分出一半产物,用95%乙醇重结晶纯化,另外一半不作处理,分别编号为A和B。 2.对-硝基乙酰苯胺的纯度测定 取少许A和B的晶体做熔点测定,记录三次熔点测定数值。 以石油醚与丙酮的等体积混合液作为展开剂进行薄层层析,计算比移值与样点数。
苯硝化生产硝基苯工艺过程与防范对策
苯硝化生产硝基苯工艺过程与防范对策 摘要 本文对硝基苯的生产工艺进行了简要阐述,分析了生产工艺危险性,并列举案例分析,最后针对硝基苯的安全生产,提出了安全预防措施,这对硝基苯的生产能长期、稳定、安全运行具有重要意义。 关键词:硝基苯工艺危险性预防措施 引言 硝基苯是一种重要的化工原料和中间体,用于生产苯胺、联苯胺、二硝基苯等多种医药和染料行业,也可用作于农药、炸药及橡胶硫化促进剂的原料,其中主要用途是制取苯胺和聚氨酯泡沫塑料,目前,90%以上的硝基苯用于生产苯胺[1-3]。工业上硝基苯生产工艺过程主要包括苯硝化反应、硝基苯洗涤、硝基苯精馏等单元过程,生产过程中使用了大量易燃易爆、有毒有害、强腐蚀、强氧化的化学危险品。由于苯硝化反应中副反应生成的杂质(主要是硝基酚盐类)爆炸危险性很高,而且极易积累在精馏塔釜等受热部位,监测和处理不及时就容易发生爆炸,使其生产过程中安全事故具有突发性、灾害性的特点。因此对苯硝化生产硝基苯工艺过程进行危险性定量分析及对爆炸事故的安全研究,并提出具体的预防措施意义重大。 1 硝基苯生产工艺 1.1硝基苯简介 硝基苯,有机化合物,又名密斑油、苦杏仁油,无色或微黄色具有苦杏仁味的油状液体[4]。化学式为C6H5NO2,难溶于水,密度比水大,相对密度1.205,熔点6℃,沸点210~211℃,闪点为87.8℃,爆炸下限为1.8%(93.3℃)。易溶于乙醇、乙醚、苯和油。遇明火、高热会燃烧、爆炸。与硝酸反应剧烈。低毒,半数致死量(大鼠,经口640mg/kg),硝基苯由苯经硝酸和硫酸混合硝化而得。实验室制硝基苯由于溶有硝酸分解产生的二氧化氮而有颜色,除杂方式:加氢氧化钠溶液,分液。 1.2硝基苯的应用 硝基苯是重要的基本有机化工原料,用于生产染料、香料、炸药等有机合成工业,经催化加氢或铁粉还原可得苯胺,这是硝基苯的最主要用途,由苯胺进而生产各种有机
对硝基苯胺的制备.doc1111
对硝基苯胺的合成实验 一.对硝基苯胺的基本理化性质 淡黄色针状结晶,易于升华。 熔点148.5℃, 沸点331.7 ℃, 相对密度1.424(20/4℃)。 闪点199°F[1], 水中溶解度为0.0008g。微溶于冷水,溶于沸水、乙醇、乙醚、苯和酸溶液。 该品有毒,空气中容许浓度为5mg/m3。吸入、口服和皮肤接触有害。 毒性高毒。可引起比苯胺更强的血液中毒。如果同时存在有机溶剂或在饮酒后,这种作用更为强烈。急性中毒表现为开始头痛、颜面潮红、呼吸急促,有时伴有恶心、呕吐,之后肌肉无力、发绀、脉搏频弱及呼吸急促。皮肤接触后会引起湿疹及皮炎。 二.预备知识 芳胺的酰化在有机合成中的作用: (1)乙酰化反应常被用来“保护”伯胺和仲胺官能团,以降低芳胺对氧化性试剂的敏感性。 (2)氨基经酰化后,降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使其由很强的第I类定位基变成中等强度的第I类定位,使反应由多元取代变为有用的一元取代。 (3)由于乙酰基的空间效应,往往选择性地生成对位取代产物。(4)在某些情况下,酰化可以避免氨基与其它功能基或试剂(如RCOCl,-SO2Cl,HNO2等)之间发生不必要的反应。
乙酰苯胺可由苯胺与酰氯、酸酐或是冰醋酸来制备,由于是实验室制备,所以选成本较小且污染小的冰醋酸来进行乙酰化,冰醋酸是一种无色液体,有强烈刺激性气味。熔点16 .6℃,沸点117 .9℃,是典型的脂肪酸。被公认为食醋内酸味及刺激性气味的来源。在家庭中,乙酸稀溶液常被用作除垢剂。食品工业方面,在食品添加剂列表E260中,乙酸是规定的一种酸度调节剂。 三.实验原理 1.乙酰苯胺的制备原理 乙酰苯胺为无色晶体,具有退热镇痛作用,是较早使用的解热镇痛药,因此俗称“退热冰”。乙酰苯胺也是磺胺类药物合成中重要的中间体。由于芳环上的氨基易氧化,在有机合成中为了保护氨基,往往先将其乙酰化转化为乙酰苯胺,然后再进行其他反应,最后水解除去乙酰基。 乙酰苯胺可由苯胺与乙酰化试剂如:乙酰氯、乙酐或乙酸等直接作用来制备。反应活性是乙酰氯>乙酐>乙酸。由于乙酰氯和乙酐的价格较贵,本实验选用纯的乙酸(俗称冰醋酸)作为乙酰化试剂。反应式如下: 冰醋酸与苯胺的反应速率较慢,且反应是可逆的,为了提高乙酰苯胺的产率,一般采用冰醋酸过量的方法,同时利用分馏柱将反应中生成的水从平衡中移去。由于苯胺易氧化,加入少量锌粉,防止苯胺在反应过程中氧化。 2.由乙酰苯胺合成对硝基苯胺的原理
以硝基苯为原料合成对溴苯胺
2011级化学教育有机化学 综合性与设计性实验 题目:以硝基苯为原料合成对溴苯胺以硝基苯为原料合成对溴苯胺 (华南师范大学化学与环境学院) 摘要对溴苯胺是非常重要的有机化工原料,常被用作染料原料,如偶氮染料、喹啉染料等,医药及有机合成的中间体等。本实验合成过程以硝基苯为原料,经历制备苯胺、乙酰苯胺、对溴乙酰苯胺等中间体的过程,最终制得目标产物对溴苯胺。其合成过程经历硝化、还原、保护、溴代、去保护等多个步骤,可以制得纯度较高的对溴苯胺。同时,掌握了芳烃硝化、硝基的还原、氨基的保护与去保护、芳烃卤代等方法。通过实验可得,用此实验方法制备对溴苯胺,操作方法简单,可控性强。 关键词合成;对溴苯胺;硝基苯;苯胺;乙酰苯胺;对溴乙酰苯胺Abstract P-bromo-aniline is very important to the organic chemical raw materials, dyes were often used as raw materials, such as the azo dyes, kuilin dyes, medicine and synthetic organic intermediates, etc. The synthesis process of nitrobenzene in as raw material, through preparation aniline, acetyl aniline, bromine acetyl aniline intermediates such as to the process, finally made of bromine aniline target product.
由苯胺设计合成对硝基苯胺
实验名称由苯胺设计合成对硝基苯胺院系化学化工学院 班级化基1101 学号20110903215 姓名刘永超
一、实验目的 1、掌握由苯胺设计合成对硝基苯胺的原理 2、掌握邻硝基苯胺和对硝基苯胺的分离方法 3、学会对有毒药品的操作和处理 二、预备知识 1、反应中各步化合物的物理性质 化合物 名称 分子量性状熔点℃沸点℃溶解度 水乙醇乙醚苯胺93.12 无色油 状液体 -6.3 184 微溶溶溶 乙酸酐102.09 无色透 明液体 -73.1 138.6 微溶溶溶 乙酰苯胺135.16 斜方晶 体 133.4 305 微溶于 冷水, 溶于热 水 溶溶 对硝基乙酰苯胺180.16 无色晶 体 100 215.6 微溶于 冷水, 易溶于 沸水 溶溶 邻硝基乙酰苯胺180.16 淡黄色 片状 94 100 微溶于 冷水, 易溶于 沸水 溶溶 对硝基苯胺138.12 淡黄色 针状 148.5 331.7 微溶于 冷水, 易溶于 沸水 溶溶 邻硝基苯胺138.12 橙黄色 针状 69.7 284.5 微溶于 冷水, 易溶于 沸水 溶溶 2、酰化反应的反应活性:酰氯>酸酐>酯>酰胺,故乙酰苯胺可由苯胺与酰氯、酸酐或冰醋酸来制备。在芳胺的反应中,常将氨基通过乙酰化反应保护起来,降低了氨基在亲电取代反应中的活化能力,以
防止氨基被氧化。由于乙酰基的空间位阻效应,酰胺基属于邻对位定位基,在苯环上往往选择性地生成邻对位取代产物。 三、实验原理 先以苯胺为原料,经乙酰化合成乙酰苯胺,再经过硝化,水解得到邻硝基苯胺和对硝基苯胺的混合物,再通过蒸馏,柱层析,或水蒸气蒸馏分离即可得到对硝基苯胺。 1、乙酰苯胺的制备 乙酸和苯胺的反应是可逆的,且反应速率较慢,可采用乙酸过量的方法和利用分馏柱将反应中生成的水蒸除,使平衡向水生成的方向移动而提高乙酰苯胺的产率。 2、硝化反应 乙酰苯胺与混酸反应,硝化的位置与温度有关。在低温(低于5℃)下产物以对硝基乙酰苯胺为主。硝化温度升高,邻硝基乙酰苯胺产物将增多。 3、水解反应:
对硝基苯胺的合成与纯化研究
对硝基苯胺的合成与纯化研究 陆文心(2012301040179) 武汉大学化学与分子科学学院化学弘毅班430072 指导老师:熊英 一、实验目的 1. 以苯胺为原料,经乙酰化、硝化、水解制得对硝基苯胺。 2. 了解乙酰化反应可采取的途径,知道反应机理及反应条件。 3. 认识芳香环上的亲电取代反应,了解其类型和本实验中涉及到的亲电取代反应——硝化反应的机理;理解先将氨基乙酰化的原因,了解苯环上取代基的定位效应。 4. 会配制硝化试剂,理解硝鎓离子产生的机理。 5. 学会用熔点仪测定固体物质的熔点,认识晶体化合物熔点测定的重要性及作用;熟练进行重结晶操作。 6. 认识酰胺在酸催化条件下水解反应的机理,了解本实验中强酸和强碱的作用。 7. 了解薄层层析的原理及操作,并用该方法分析产品的纯度。 8. 了解柱层析的基本原理,掌握柱层析实验的基本操作,用柱层析分离对硝基苯胺和邻硝基苯胺,得到其溶液;初步学会使用旋转蒸发仪,了解旋转蒸发的实质和优点,用该方法获得对硝基苯胺固体。 9. 在老师的指导下对产品对硝基苯胺和邻硝基苯胺进行核磁共振表征,了解化学位移等概念,初步学会分析NMR图谱。 二、实验原理 芳香环上的硝化反应是有机合成中的常见反应,它是一种亲电取代反应。芳香环上常见的亲电取代反应还有卤化、磺化、以及傅-克烷基化和酰基化反应。亲电取代反应由亲电试剂(多为带正电荷的缺电子基团如NO2+等路易斯酸)启动,进攻芳香环上的离域π电子云,将氢原子取代。 本实验为连续合成实验,分三个主要步骤,从苯胺出发,合成对硝基苯胺。每步的反应式如下: 第一步: 苯胺乙酸酐乙酰苯胺乙酸第二步: 乙酰苯胺对硝基乙酰苯胺(大量)邻硝基乙酰苯胺(少量)
由苯胺合成对硝基苯胺
由苯胺设计合成对硝基苯胺 一、实验目的 1.了解由苯胺和乙酸酐制备对硝基苯胺的原理及方法。 2.了解水蒸气蒸馏,分馏,柱层析分离 3.熟悉固体样本熔点的测定方法 4.掌握重结晶的操作步骤和方法 5.掌握氨基的保护和去保护的原理和实验操作 二、实验原理 芳环上的氨基易被氧化,因此由苯胺制备对硝基苯胺,不能直接硝化,须先保护氨基。 将苯胺转化为乙酰苯胺,保护氨基后再硝化,在芳环引入硝基后,再水解去保护恢复氨基,从而得到对硝基苯胺。另外,氨基酰化后,降低了氨基对苯环亲电取代反应的活化能力,又因为乙酰基的空间效应,可提高生成对位产物的选择性。 1、苯胺的乙酰化 乙酸与苯胺的反应是可逆的,且反应速率较慢,实验中使用过量乙酸,利用分馏柱将反应中生成的水蒸气除去使平衡向右移动而提高乙酰苯胺的产率。 2、对硝基乙酰苯胺的制备乙酰苯胺与混酸反应,硝化的位置与温度有关,低于5℃时产物以对硝基苯胺为主,硝化温度升高,邻硝基苯胺产物增多。
3、除邻位副产物pH=10时,邻位产物较对位产物易水解,生成的邻硝基苯胺又溶于50℃的碱液,故将混合产物与碳酸钠溶液共沸水解,50℃过滤即可除去邻位副产物。对位产物再与氢氧化钠溶液共沸,水解得对硝基苯胺。 三、实验试剂及主要参数
四、实验步骤及现象 1.由乙酰苯胺合成对硝基苯胺
2.薄层层析法检验纯度 取一块已铺好硅胶的薄板( 只能碰触边缘和背面) 和层析缸,向层析缸中加入3ml 展开剂(乙酸乙酯与石油醚1: 3混合物)盖好盖子;在薄板距下边缘约1cm 处用软铅笔画一条水平横线,点三个点。取两端开口的毛细管,在1%的对硝基苯胺丙酮溶液中蘸一下,在第一个点处轻点,如颜色太浅,可待丙酮完全挥发后再点一次。用1%邻硝基苯胺点第二个点,用自己配制的粗对硝基苯胺丙酮溶液点第三个点,然后将薄板小心放入层析缸中,注意边缘不要碰壁。待溶剂线靠近上边缘后,取出薄板,用铅笔划线标记展开剂上升的高度,圈出各点的轮廓并点出中点。 实验结果分析:粗对硝基苯胺丙酮溶液在硅胶板上有两个点,分别与对硝基苯胺和邻硝基苯胺对齐,与邻硝基苯胺对齐的点颜色较淡,说明产物较纯,含杂质较少。 3.水蒸气蒸馏
对硝基苯胺
对硝基苯胺 p-nitroaniline 分子式C6H6N2O2 相对分子质量138.12, CAS NO 100-01-6 名称:4-硝基苯胺 别名:对硝基苯胺 主要性质: 淡黄色针状结晶,易于升华。 熔点148.5℃, 沸点331.7 ℃, 相对密度1.424(20/4℃)。 闪点199°F[1], 水中溶解度为0.0008g。微溶于冷水,溶于沸水、乙醇、乙醚、苯和酸溶液。 该品有毒,空气中容许浓度为5mg/m3。吸入、口服和皮肤接触有害。 毒性高毒。可引起比苯胺更强的血液中毒。如果同时存在有机溶剂或在饮酒后,这种作用更为强烈。急性中毒表现为开始头痛、颜面潮红、呼吸急促,有时伴有恶心、呕吐,之后肌肉无力、发绀、脉搏频弱及呼吸急促。皮肤接触后会引起湿疹及皮炎。大鼠经口LD50为1410mg/kg。 生产方法 工业生产对硝基苯胺。可采用乙酰苯胺硝化、水解的方法,也可用对硝基氯苯氨解的方法。 1.以乙酰苯胺为原料,经硝化、水解而制得。 原料消耗定额:乙酰苯胺1210kg/t;硝酸(90%)580kg/t;硫酸3620kg/t;液碱(30%)660kg/t。 2.以对硝基氯苯为原料,可采用高压釜间歇法生产,也可采用管道反应器连续化生产,收率都在94%左右。 原料消耗定额:对硝基氯苯(97%)1170kg/t;氨水(28%)700kg/t。 产品用途 对硝基苯胺是染料工业极为重要的中间体,可直接用于合成品种有:直接耐晒黑 G,直接绿B、BE、2B-2N,黑绿NB,直接灰D、酸性黑10B、ATT,分散红P-4G、阳离深黄2RL,毛皮黑D,对苯二胺,邻氯对硝基苯胺,
2.6-二氯-4硝基苯胺,5-硝基-2-氯苯酚等,也可合成农药氯硝胺,医药卡柳肿;同时还是防老剂,光稳定剂,显影剂等的原料。国外以对硝基苯胺为重氮组份合成的分散染料有:C,I分散橙1,3,7,21等、红色1,2,7,17等,蓝259;黑2,3,28,29等 该品即冰染染料大红 GG色基,可作黑色盐 K,供棉麻织物染色、印花之用。但主要用作偶氮染料中间体,如用于生产直接墨绿B、酸性媒介棕G、酸性黑10B、酸性毛元ATT、毛皮黑D和直接灰D等。还可作农药和兽药的中间体,在医药工业中可用于生产氯硝柳胺、卡巴肿、硝基安定、喹啉脲硫酸盐等。还可用于生产对苯二胺;抗氧化剂和防腐剂等。 应急处理 隔离泄漏污染区,限制出入。切断火源。建议应急处理人员戴防尘面具(全面罩),穿防毒服。不要直接接触泄漏物。小量泄漏:避免扬尘,用洁净的铲子收集于干燥、洁净、有盖的容器中。大量泄漏:用塑料布、帆布覆盖。然后收集回收或运至废物处理场所处置。
间二硝基苯生产工艺规程
主反应: + HNO3 = NO2 +H2O 2 2 +HNO3 = 2 +H2O 副反应: 2 +HNO3=O22 +H2O 2 3.3酸性二硝基苯的中和精制,酸性二硝基苯中含有酸(主要为硝酸)和副反应生成的邻、对二硝基苯,用氢氧化钠中和酸性硝基苯中的硝酸,利用亚硫酸钠磺化取代反应,生成不溶于水的邻、对硝基苯磺酸钠,以达到精制的目的。 3.4精制锅的间二硝基苯的水洗。用水洗去除中和精制后产生的少量的碱和邻、对硝基苯磺酸钠,从而制得高纯度的间二硝基苯。有关反应如下: NO2 SO3Na +Na2SO4 2 +H2O 2 NO22 +Na2SO4 NO23Na +NaNO2 3.5硝化反应的抽取。用硝基苯萃取硝化废酸中的二硝基苯,同行斯硝基苯同硝化废酸中的剩余硝酸反应生成二硝基苯。抽取后的废
酸送浓酸岗位提炼后循环使用或外售。硝基苯抽取后成为酸性硝基苯,作为硝化的原料。 有关反应如下: HNO3+NaOH=NaNO3+H2O 四、工艺过程的叙述 4.1各种原料的接受 4.1.1粗硝基苯从硝基苯车间粗硝基苯储罐由输送泵送到本工段硝基苯计量槽(V102)中。 4.1.2硫酸从废酸回收工段浓缩岗位槽自流到本工段硫酸计量槽(V105)中。 4.1.3 .98%硝酸从硝基苯工段硝酸储罐经泵送至本工段硝酸计量槽(V104)中 4.1.4.30%的液碱从硝基苯工段液碱储罐经泵送至本工段液碱计量槽(V106)中。 4.1.5亚硫酸钠经提升机(LS101)送至三楼,供亚硫酸钠配制罐(104AB)使用。 4.2硝基苯的硝化 4.2.1硝化开车前的检查和准备 1)检查硝化锅各部位是否正常,水压、汽压、电压是否稳定,温度计,真空表,报警装置是否好用。 2)硝化锅的数字显示仪和记录仪,两表温差不能超过2度,并记录好两表的同步温度水温差。
苏州大学有机化学实验-邻、对硝基苯胺的制备(一)
苏州大学化学化工学院课程教案 [实验名称] 邻硝基苯胺和对硝基苯胺的制备(一) [教学目标] 学习氨基的保护、芳环上的硝化和酰胺水解的实验方法;学习薄板的制备。[教学重点] 芳环上的硝化、氨基脱保护。 [教学难点] 芳环硝化反应的条件控制。 [教学方法] 讨论法,演示法,讲述法 [教学过程] [引言] 【实验内容】邻硝基苯胺和对硝基苯胺的制备(一) 【实验目的】学习氨基的保护、芳环上的硝化和酰胺水解的实验方法;学习薄板的 制备。 [提问并讲述] 【实验原理】以乙酰苯胺为原料,通过硝化、水解得到邻硝基苯胺和对硝基苯胺的混合物,以此来验证芳环上的亲电取代反应的定位规律,巩固硝化反应、酰胺的水解 等基本有机反应。反应式如下: NHCOCH3 +HNO3H2SO4 NHCOCH3NHCOCH3 + NO2 2 NHCOCH3NHCOCH3 + NO2 2NH2NH2 + NO2 2 +H2O KOH +CH3COOK [讲述] 苯胺因其极易被氧化,故不能用混酸直接进行硝化,但是可以通过先将氨基保护后硝化,最后脱保护的方法来实现硝基苯胺的合成,本实验以乙酰苯胺为原料来制 备邻、对硝基苯胺。 [讲述] 【实验装置图】
【实验步骤】 一. 乙酰苯胺的硝化 在50 mL三颈瓶中放入2.7 g(0.02 mmol)乙酰苯胺,加入8 mL冰醋酸[1]。安装上电磁搅拌装置。在三颈瓶口分别装上温度计、回流冷凝管、恒压漏斗[2]。在恒压漏斗中加入2.0 mL浓硝酸(比重为1.14 g/mL,0.03 mol)和4 mL浓硫酸(比重为 1.84 g/mL)的混合液[3]。三颈瓶外用水浴控温在50±5 o C[4](理论上如此,实际控温最 好不低于55℃,太低反应难开始而造成积聚,一旦开始又过于剧烈发生冲料;控温在55-60℃较为适宜),边搅拌边慢慢加入混酸(约需20 min,注意恒压滴液漏斗是否积液,控制滴加速度,若反应液变绿则需减缓滴加)[5],加完后在60 o C继续反应1小时(尽量控温不超过70℃,在60-65℃较宜,反应液应为橙红色,淡黄色或绿色都会影响产率)。然后将反应液倒入30 g碎冰中,即有黄色沉淀析出,过滤、冰水洗至近中性[6],再用少量石油醚淋洗,晾干,称重,计算产率。(用纸包裹写好名字放置,下次称量后继续使用) 二.邻、对硝基乙酰苯胺的水解 将制得的邻、对硝基乙酰苯胺1.3 g (0.007 mol) 放入25 mL圆底烧瓶中[7],加入 8.5 mL氢氧化钾醇溶液[8],摇匀,加沸石;装上回流冷凝管(接口处涂真空油脂避免粘 连),在水浴上加热回流半小时,然后从冷凝管口加入3 mL热水。继续在沸水浴中加热20 min,稍冷后倒入20 g冰水中,过滤,用冰水洗至弱碱性或中性[9],晾干[10]得水解产物,称重并计算水解产率。
对硝基苯胺的制备
对硝基苯胺的制备 化学一班常拯波201309020103 1前言 对硝基苯胺,黄色针状结晶,高毒,易升华。微溶于冷水,溶于沸水、乙醇、乙醚、苯和酸溶液。广泛应用于染料工业的人工合成化学物,是多种印染及医药化工品的中间体,也可用于分析试剂。操作时需穿戴防护措施,避免释放至环境。 工业生产对硝基苯胺。可采用乙酰苯胺硝化、水解的方法,也可用对硝基氯苯氨解的方法。 1. 以乙酰苯胺为原料,经硝化、水解而制得。原料消耗定额:乙酰苯胺1210kg/t、硝酸(90%)580kg/t、硫酸3620kg/t、液碱(30%)660kg/t。 2. 以对硝基氯苯为原料,可采用高压釜间歇法生产,也可采用管道反应器连续化生产,收率都在94%左右。原料消耗定额:对硝基氯苯(97%)1170kg/t、氨水(28%)700kg/t 高毒。可引起比苯胺更强的血液中毒。如果同时存在有机溶剂或在饮酒后,这种作用更为强烈。急性中毒表现为开始头痛、颜面潮红、呼吸急促,有时伴有恶心、呕吐,之后肌肉无力、发绀、脉搏频弱及呼吸急促。皮肤接触后会引起湿疹及皮炎。大鼠经口LD50为1410mg/kg 2实验目的 1掌握由苯胺设计合成对硝基苯胺的原理 2、掌握邻硝基苯胺和对硝基苯胺的分离方法 3、学会对有毒药品的操作和处理 3反应中各步化合物的物理性质 化合物名称分子量性状熔点℃沸点℃溶解度水乙醇乙醚 苯胺93.12 无色油状液体-6.3 184 微溶溶溶 乙酸酐 102.09 无色透明液体-73.1 138.6 微溶溶溶
乙酰苯胺135.16 斜方晶体133.4 305 微溶于冷水,溶于热水溶溶 对硝基乙酰苯胺180.16 无色晶体100 215.6 微溶于冷水,易溶于沸水溶溶 邻硝基乙酰苯胺180.16 淡黄色片状94 100 微溶于冷水,易溶于沸水溶溶 对硝基苯胺138.12 淡黄色针状148.5 331.7 微溶于冷水,易溶于沸水溶溶 邻硝基苯胺138.12 橙黄色针状69.7 284.5 微溶于冷水,易溶于沸水溶溶 4实验原理 先以苯胺为原料,经乙酰化合成乙酰苯胺,再经过硝化,水解得到邻硝基苯胺和对硝基苯胺的混合物,再通过蒸馏,柱层析,或水蒸气蒸馏分离即可得到对硝基苯胺 1乙酰苯胺的制备 乙酸和苯胺的反应是可逆的,且反应速率较慢,可采用乙酸过量的方法和利用分馏柱将反应中生成的水蒸除,使平衡向水生成的方向移动而提高乙酰苯胺的产率 2、硝化反应
硝基苯工艺介绍
硝基苯生产工艺技术方案 硝基苯的生产历史:硝基苯自一八三四年家由英国科学家米尔斯琪第一次有苯硝化制取,并于一八五六年在英国实现工业化生产,迄今已有一百多年历史。作为最早发展起来的化学工业原料之一,硝基苯在有机化工原料工业中一直占有重要地位。 硝基苯是生产苯胺的传统原料,其产量的95%用来做苯胺,还可以作染料中间体、用做溶剂等,五十年代后期随着橡胶橡胶助剂和聚氨基泡沫塑料工业的发展和应用,苯胺的需求量也越来越大,对其硝基苯的需求猛增。近年来,由于以美国ArCO化学公司的一种由硝基苯直接制MDI的新工艺的推广应用再很大程度上促进了硝基苯生产的发展。 目前硝基苯的生产方法主要有两种: 直接硝化法和绝热硝化法。 1、直接硝化法是将苯用混酸直接硝化生产硝基苯。该方法又有不同 的生产工艺路线。 a、锅式间歇式连续硝化工艺 b、环式硝化器连续硝化工艺 c、锅环混用连续硝化工艺 d、泵式连续硝化工艺 这四种工艺共用的优点是工艺技术成熟,操作易掌握,设备材料较普通,常压低温,主要缺点是设备腐蚀严重,副产稀硫酸浓缩回收
需耗大量能源。目前各生产厂家以其技术优势和能源优势不同而各自采用适合自己情况的不同工艺。 2、绝热硝化法:绝热硝化法是由美国氰胺公司和加拿大工业公司联合开发,并在美国罗比康公司和第一化学公司建成了工业化生产装置。该法是将过量苯和硝酸与硫酸的混合物加至一组反应器中,与135度和0.5Mpa压力下进行连续硝化反应,将反应物与稀硫酸分离,反应产物经中和、水洗和精制得到成品硝基苯,稀硫酸在真空下闪蒸出水后浓缩至70---75%循环使用。该工艺突出优点在于反应热被稀硫酸吸收,硝化反应器内不需设置复杂的冷却系统,节省了浓缩所需的大量能耗。该工艺还不能在国内普遍推广,主要障碍是对设备材料的苛刻要求及昂贵的工程造价。 国内硝基苯生产技术主要有锅式串联连续生产工艺和环式串联连续生产工艺。使用锅式串联连续生产工艺的厂家主要有南化工业公司等7家,采用环式串联连续生产工艺的厂家有烟台合成革厂和河南化工厂两家,而两家工艺和设备又有所部同,砚台合成革厂为两器串联,河南化工厂为三器一锅串联。绝热硝化在国内尚属实验阶段,还没有工业化装置。根据原行业交流资料表明,硝化各项工艺指标和各项物耗指标河南化工厂均优于烟台合成革厂。因此,我们认为河南化工厂开发应用的三器一锅串联硝化工艺是成功的,具有一定程度的先进技术水平和成熟可靠性。本厂如果上马硝基苯的话,我们推荐采用四器串联连续硝化生产硝基苯的工艺技术方案。 产品说明:
对硝基苯胺的制备
对硝基苯胺的制备(一) 一、实验目的 了解芳香族硝基化合物的制备方法,尤其是由芳胺制备芳香族硝基化合物的方法。 二、实验原理 主反应: 副反应: 三、实验药品 乙酰苯胺5g (0.037mol ),硝酸(d =1.40)2.2mL (0.032mol ),浓硫酸,冰醋酸,乙醇,碳酸钠,20%氢氧化钠溶液。 四、实验仪器 锥形瓶,烧杯,滴管,抽滤装置。 五、实验步骤 1.对硝基乙酰苯胺的制备 在100ml 锥形瓶内,放入5g 乙酰苯胺和5mL 冰醋酸[1]。用冷水冷 却,一边摇动锥形瓶,一边慢慢地加入10mL 浓硫酸。乙酰苯胺逐 渐溶解。将所得溶液放在冰盐浴中冷却到0~2℃。 在冰盐浴中用2.2mL 浓硝酸和1.4mL 浓硫酸配置混酸。一边摇动 锥形瓶,一边用吸管慢慢地滴加此混酸,保持反应温度不超过5℃ [2]。 从冰盐浴中取出锥形瓶,在室温下放置30min ,间歇摇荡之。在搅 拌下把反应混合物以细流慢慢地倒入20mL 水和20g 碎冰的混合物 中,对硝基乙酰苯胺立刻成固体析出。放置约10min ,减压过滤, 尽量挤压掉粗产品中的酸液,用冰水洗涤三次,每次用10mL 。称 取粗产品0.2g (样品A ),放在空气中晾干。其余部分[3]用95%乙醇进行重结晶[4]。减压过滤从乙醇中析出的对硝基乙酰苯胺,用少许冷乙醇洗涤,尽量压挤去乙醇。将得到的对硝基乙酰苯胺(样品B )放在空气中晾干。 将所得乙醇母液在水浴上蒸发到其原体积的2/3。如有不溶物,减压过滤。保存母液(样品+CH 3COOH O 2N NH 2H 2SO 4H 2SO 4H 2O +O 2N NHCOCH 3H 2O ++O 2N NHCOCH 3HONO 2 NHCOCH 3+CH 3COOH NHCOCH 3NO 2H 2SO 4H 2SO 4 H 2O +NHCOCH 3H 2O ++NH 2HONO 2 NHCOCH 3
实验六 对硝基苯胺的制备
实验六 对硝基苯胺的制备(一) 一、实验目的 了解芳香族硝基化合物的制备方法,尤其是由芳胺制备芳香族硝基化合物的方法。 二、实验原理 主反应: +CH 3COOH O 2N NH 2H 2SO 4H 2SO 4H 2O +O 2N NHCOCH 3H 2O ++O 2N NHCOCH 3HONO 2 NHCOCH 3 副反应: +CH 3COOH NHCOCH 3NO 2H 2SO 4H 2SO 4 H 2O +NHCOCH 3H 2O ++NH 2HONO 2 NHCOCH 3 三、实验药品 乙酰苯胺5g (0.037mol ),硝酸(d =1.40)2.2mL (0.032mol ),浓硫酸,冰醋酸,乙醇,碳酸钠,20%氢氧化钠溶液。 四、实验仪器 锥形瓶,烧杯,滴管,抽滤装置。 五、实验步骤 1.对硝基乙酰苯胺的制备 在100ml 锥形瓶内,放入5g 乙酰苯胺和5mL 冰醋酸[1]。用冷水冷 却,一边摇动锥形瓶,一边慢慢地加入 10mL 浓硫酸。乙酰苯胺逐 渐溶解。将所得溶液放在冰盐浴中冷却到0~2℃。 在冰盐浴中用2.2mL 浓硝酸和1.4mL 浓硫酸配置混酸。一边摇动 锥形瓶,一边用吸管慢慢地滴加此混酸,保持反应温度不超过5℃ [2]。 从冰盐浴中取出锥形瓶,在室温下放置30min ,间歇摇荡之。在搅 拌下把反应混合物以细流慢慢地倒入20mL 水和20g 碎冰的混合物 中,对硝基乙酰苯胺立刻成固体析出。放置约10min ,减压过滤, 尽量挤压掉粗产品中的酸液,用冰水洗涤三次,每次用10mL 。称 取粗产品0.2g (样品A ),放在空气中晾干。其余部分[3]用95%乙醇进行重结晶[4]。减压过滤从乙醇中析出的对硝基乙酰苯胺,用少许冷乙醇洗涤,尽量压挤去乙醇。将得到的对硝基乙酰苯胺(样品B )放在空气中晾干。 将所得乙醇母液在水浴上蒸发到其原体积的2/3。如有不溶物,减压过滤。保存母液(样品
N-甲基-对硝基苯胺研究进展
N-甲基-对硝基苯胺研究进展 崔建兰, 曹端林, 徐春彦 (中北大学化工系,山西,太原,030051) 摘 要:介绍了N-甲基-对硝基苯胺(PNMA)的应用,综述了 PNMA 的合成方法, 通过分析和比较这些合成方法, 得出了今后合成PNMA 的主要方法是在常压下对硝基氯苯先磺化再氨解是工业化生产PNMA 的首选路线;在有高压设备的条件下,对硝基氯苯直接氨解是一条有发展前景的方法。 关键词:N-甲基-对硝基苯胺;应用;合成路线 中图分类号 TQ560.4 文献标识码 A Progress of P-nitro-N-methylamine Cui jian-lan , Caoduanlin , Xuchunyan (The Department of Chemical Technology, North university of China ShanXi, Taiyuan, 030051,China) Abstract: The application of P-nitro-N-methylamine (PNMA) is introduced in this paper as well as its synthesizing methods in this paper. On the basic of analysis and comparison, if in the ordinary pressure, the process of first sulfonation and amination is the main way to synthesizing PNMA in the future; in the high pressure, the process of direct amination of P-nitrochlorobenzen will be promising method. Keywords : P-nitro-N-methylamine; methylamine; application; synthesizing routine 1 应 用 N-甲基对硝基苯胺(P-nitro-N-methylamine 简称PNMA 或NMA )分子式为C 7H 8O 2N ,结构是如下 CH 3N H O 2N CA 的登记号:100-15-2,黄色针状结晶,熔点(151.6~153.5)℃。 N-甲基-对硝基苯胺可作为火药的安定剂,广泛使用的有机中间体,并可以作为检测其他物质的基准,现在越来越受到人们的关注. 1.1火药推进剂中作为安定剂或中定剂 火药在贮存过程中,分解出氮的氧化物等产物,这些产物会加速火药的分解,使其失效并导致自燃的危险,PNMA 作为推进剂中的安定剂或中定剂应用是最广泛的,它易于NO,NO 2,HNO 2反应。与其 他类型的安定剂相比,PNMA 的反应活性最高,但对硝酸的活性最差[1-4] 。 同时,人们对PNMA 在各种环境下的反应和测量方法进行了深入研究: 1)NEPE 固体推进剂中的安定剂NMA 的消耗速率可通过把推进剂在某一温度下进行加速老化实验来测出。从不同温度下老化反应的活化能可以看出PNMA 从60℃,开始老化的速度明显加快。所以只 要把老化速率控制在一个较低的范围内就可更容易测出推进剂中安定剂的含量[5] 。 2)通过用高压液相色谱法对铸装双基火箭推进剂中的混合安定剂—PNMA 消耗状况的测定发现,在80℃-90℃左右会加速老化。而对安定剂消耗状况的测定就是依靠对含N-亚硝基类化合物含量的测
由苯胺出发合成对硝基苯胺(论文)
由苯胺出发合成对硝基苯胺 姓名:刘昌彬、余婵 大连大学环境与化学工程学院化学 指导老师:李争宁 摘要:利用苯氨经酰基化,硝化,水解制备对硝基苯胺,研究了反应物物料比例,反应温度、反应时间对产物对硝基苯胺的产率的影响。以得到制备对硝基苯胺的产率最高的反应物比例方案。 关键字:苯胺,对硝基苯胺 1.前言: 对硝基苯胺,黄色针状结晶,高毒,易升华。微溶于冷水,溶于沸水、乙醇、乙醚、苯和酸溶液。广泛应用于染料工业的人工合成化学物,是多种印染及医药化工品的中间体,也可用于分析试剂。操作时需穿戴防护措施,避免释放至环境。 2.实验 2、1实验原理 先以苯胺为原料,经乙酰化合成乙酰苯胺,再经过硝化,水解得到邻硝基苯胺和对硝基苯胺的混合物,再通过蒸馏,柱层析,或水蒸气蒸馏分离即可得到对硝基苯胺。 2.2主要试剂及仪器 试剂:苯胺,乙酸酐,冰醋酸,浓硝酸,浓硫酸,NaOH固体,活性炭 仪器:圆底烧瓶,锥形瓶,烧杯250mL,玻璃棒,冷凝管,橡胶管,布氏漏斗,滤纸,铁架台,加热炉 2.3合成方法 3.3.1合成路线 1、乙酰苯胺的制备 乙酸和苯胺的反应是可逆的,且反应速率较慢,可采用乙酸过量的方法和利用分馏柱将反应中生成的水蒸除,使平衡向水生成的方向移动而提高乙酰苯胺的产率。 2、硝化反应 乙酰苯胺与混酸反应,硝化的位置与温度有关。在低温(低于5℃)下产物以对硝基乙酰苯胺为主。硝化温度升高,邻硝基乙酰苯胺产物将增多。 3、水解反应:
pH=10时,邻位产物较对位产物易水解,生成的邻硝基苯胺又溶于50℃的碱液,故将混合产物与碳酸钠溶液共沸水解,50℃过滤即可除去邻位副产物。对位产物再与氢氧化钠溶液共沸,水解得对硝基苯胺。 4、邻硝基苯胺和对硝基苯胺的分离 分馏:利用对硝基苯胺和邻硝基苯胺沸点的差异,采用分馏的方法。 2.3.2合成步骤 1、乙酰苯胺的合成 将5mL苯胺和10mL冰醋酸加入50mL圆底烧瓶中,再取6mL乙酸酐在搅拌下加入圆底烧瓶中,接上直型冷凝管,开通冷凝水,回流15min左右,待反应体系颜色接近橙黄色后,移开热源,从冷凝管口加入5mL蒸馏水,再回流5min。反应结束,在搅拌下趁热将反应物倒入盛有30mL水的烧杯中,待体系冷却后用蒸馏水洗涤抽干。重结晶,向250mL烧杯中加入100mL水和刚得到的产品,加热搅拌至产品全溶。若出现熔化呈油滴现象,就继续加热。预热一个布氏漏斗,趁热抽滤,得到部分产品,再将溶液冷却,最终析出晶体,洗涤,抽滤也是乙酰苯胺产品。 2、乙酰苯胺的硝化 将2.4g已干燥研细的自制乙酰苯胺和4.0mL冰乙酸放入50mL锥形瓶中,充分摇动,然后在冰水浴冷却下慢慢加入5mL浓硫酸,并放在冰浴中冷却至0℃左右。 在另一个 25mL 锥形瓶中配制混酸2.0mL浓硫酸和1.5mL浓硝酸。先加入浓硫酸,然后在冰浴中,边摇动锥形瓶边小心加入硝酸。冷至室温后,用滴管逐滴加到盛放乙酰苯胺溶液的锥形瓶中进行硝化。边加混酸边冷却,使体系温度始终低于 5C。混酸加完后,把锥形瓶移出冰浴,在室温中保持 30min,并间歇摇动锥形瓶。 在搅拌下,将硝化物料细流倒入盛有 25mL 水和25g碎冰的烧杯中,搅拌 5min,抽滤。压干滤饼,用适量冰水洗涤两次后抽干。 将滤饼放入250mL 锥形瓶中,加20~30mL水。在摇动下小心加入碳酸钠粉末,滴加几滴酚酞直至溶液呈微红色。加热至沸腾并保持5min ,再冷却到50℃ ,迅速抽滤。并用适量冰水洗涤两次后抽干。取少量样品重结晶,测定其熔点。
对硝基乙酰苯胺的制备与纯化
对硝基苯胺的制备与纯化 杨丽 2011301040057 化学基地班(三) 摘要:本实验用乙酰苯胺作为起始原料,首先经过硝化获得了邻硝基乙酰苯胺和对硝基乙酰苯胺的混合物。接着采取了两种分离纯化的途径:一种是先将制得的混合物经过重结晶后获得纯的对硝基乙酰苯胺,通过测定固体的熔点来验证所得对硝基乙酰苯胺的纯度。再将重结晶后的产品用氢氧化钠的醇溶液水解,取水解后的产品作薄层析和熔点测定来确定水解后的产物。 另一种方法是直接将硝化后的混合物水解,制得邻硝基苯胺和对硝基苯胺的混合物。通过薄层分析和熔点的测定来证实两者的存在。再分别用重结晶和水蒸气蒸馏的办法分离纯化所获得的产品。并通过薄层析和测熔点的方法来验证产品的组成和纯度。 最后,根据实验结果分析比较两种分离纯化途径的优劣。 绪言:对硝基苯胺常温下是淡黄色针状结晶,易于升华。熔点 148.5℃,沸点 331.7℃,相对密度1.424(20/4℃)。闪点199°,水中溶解度为0.0008g。微溶于冷水,溶于沸水、乙醇、乙醚、苯和酸溶液,有毒,空气中容许浓度为5mg/m3。吸入、口服和皮肤接触有害。所以在实验过程中要尽量避免与之接触。对硝基苯胺是染料工业极为重要的中间体,可直接用于合成:对苯二胺,邻氯对硝基苯胺, 2.6-二氯-4硝基苯胺,5-硝基-2-氯苯酚等,同时还是防老剂,光稳定剂,显影剂等的原料。可作黑色盐 K,供棉麻织物染色、印花之用。并且可作农药和兽药的中间体,在医药工业中可用于生产氯硝胺、卡巴肿、硝基安定、喹啉脲硫酸盐等。还可用于生产对苯二胺;抗氧化剂和防腐剂等。因此对硝基苯胺的合成具有很大的应用价值。工业上生产对硝基苯胺的方法有乙酰苯胺的硝化水解和对硝基氯苯氨解两种方法。 本实验采用的是乙酰苯胺硝化水解的方法,具体步骤将在实验部分给出。反应原理如下:1、乙酰苯胺的硝化 2、硝基乙酰苯胺的水解:
