氯化物溶液中铜溶剂萃取

氯化物溶液中铜溶剂萃取
一、吡啶羧酸酯
英国帝国化学(ICI)下属的阿科伽( Acorga )公司注册了一系列取代吡啶酯的专利,其中AcorgaDS5443(今称CLX50)是一种吡啶羧酸[1]。在氯化物溶液中,它对Cu2+具有很好的选择性。萃取铜的过程可写为:
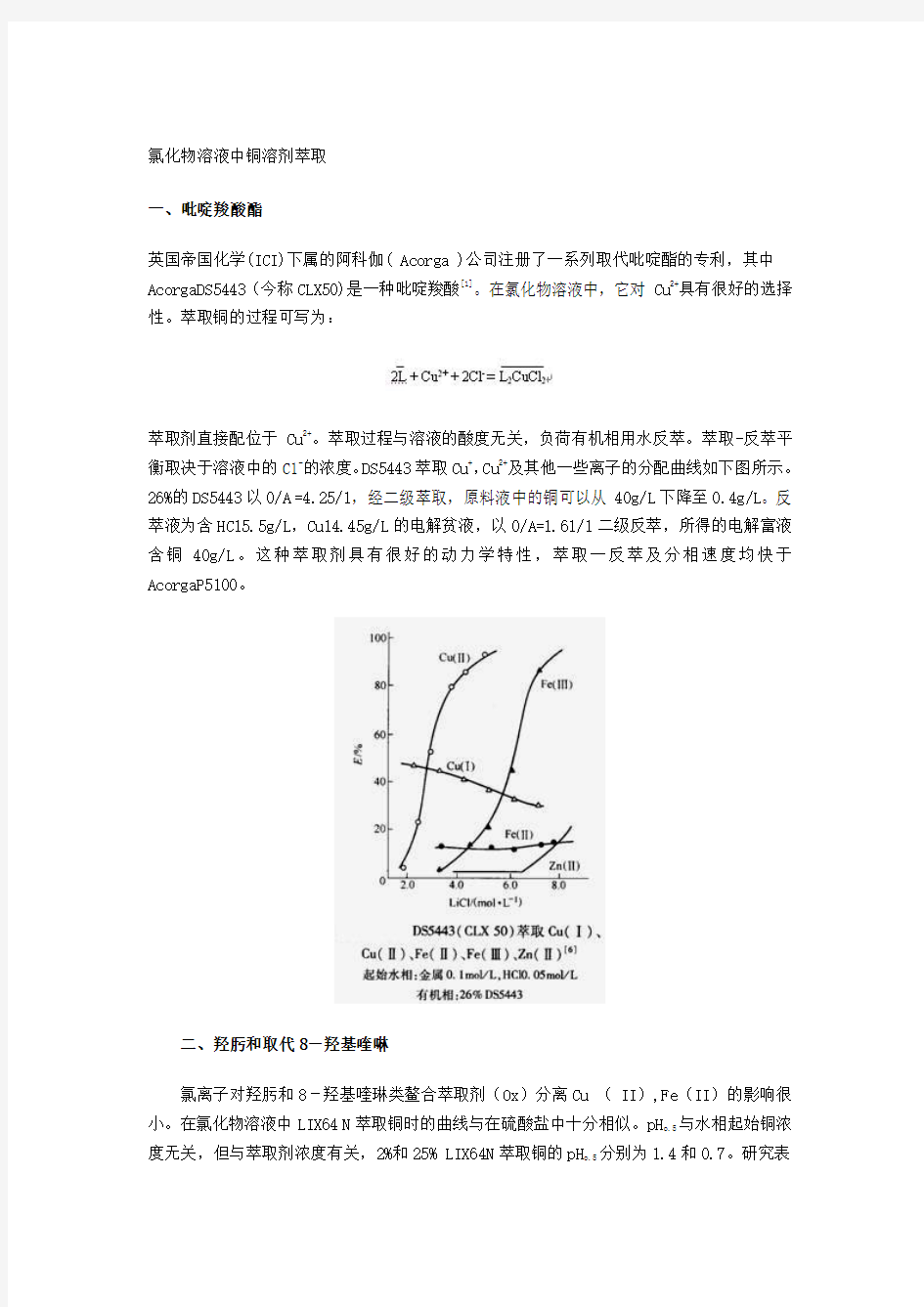
萃取剂直接配位于Cu2+。萃取过程与溶液的酸度无关,负荷有机相用水反萃。萃取-反萃平衡取决于溶液中的C1-的浓度。DS5443萃取Cu+,Cu2+及其他一些离子的分配曲线如下图所示。26%的DS5443以0/A =4.25/1,经二级萃取,原料液中的铜可以从40g/L下降至0.4g/L。反萃液为含HC15.5g/L,Cu14.45g/L的电解贫液,以0/A=1.61/1二级反萃,所得的电解富液含铜40g/L。这种萃取剂具有很好的动力学特性,萃取一反萃及分相速度均快于AcorgaP5100。
二、羟肟和取代8-羟基喹啉
氯离子对羟肟和8-羟基喹琳类鳌合萃取剂(Ox)分离Cu ( II),Fe(II)的影响很小。在氯化物溶液中LIX64 N萃取铜时的曲线与在硫酸盐中十分相似。pH o.5与水相起始铜浓度无关,但与萃取剂浓度有关,2%和25% LIX64N萃取铜的pH o.5分别为1.4和0.7。研究表
明,铜的萃合物为CuOx2,没有氯离子配合于被萃的Cu2+上,而被萃入有机相。萃入有机相的铜易为酸反萃。
三、β-二酮
霍齐斯特(Hoechst)化学公司首先开发了一种取代β-二酮的萃取剂牌号为Hostarex DK16。汉高公司也推出牌号为LIX54的β-二酮萃取剂,适合于在氨溶液中萃取铜。此后又生产了一种结构相似,但端甲基改为三氟甲基的产品XI51。
氯化物溶液中电积铜只能生成铜粉,而不能生成板状阴极,这是其致命弱点。为了避免在氯化物中电解,有时将铜从氯化物溶液转人硫酸盐溶液。一种简单办法是用胺类萃取,水反萃成为氯化物溶液,再用阳离子交换萃取剂萃取,而后以硫酸反萃生成硫酸盐溶液,这显然比较繁琐。
用混合萃取剂LIX54和三辛胺从氯化物介质中萃取铜可以通过洗涤和反萃转型。三辛胺首先起到萃取剂的作用,而后用氨洗涤有机相,将C1-转入水相。在与NH3溶液接触的条件下,有机相中的LIX54可以与Cu2+形成萃合物,而将其保留在有机相,最后用H2SO4反萃,得到无氯离子的CuS04及H2SO4溶液,叔胺则转变为R3N·H2SO4。为了避免H2SO4进入萃余液,应将有机相与盐酸溶液接触,以将其转化为胺的盐酸盐。
铜萃取中相夹带的产生及控制
铜萃取中相夹带的产生及控制 王朝华,邹潜,徐志刚,汤启明,李建 (重庆浩康集体金属萃取工程技术研究中心重庆401121) 摘要:介绍了铜萃取过程中夹带产生的原因,并提出了控制夹带的方法和措施。 关键词:萃取;铜萃取;夹带;湿法冶金 The Measures of Decreasing Entrainment of Solvent Extraction of Copper Wang Chao-hua,ZOU Qian, XU Zhi-gang, TANG Qi-ming, Li Jian (Kopper Chemical Industry Co.,Ltd. Chong qing 401121,China) Abstract: The factors of decreasing entrainment in the solvent extraction of copper were introduced.And solvent extraction entrainment control measures and strategies were discussed. Keyword: extraction;extraction of copper;entrainment;hydrometallurgy 溶剂萃取在铜湿法冶金中得到广泛应用。萃取指标的好坏直接影响到铜产品质量和工厂经济效益。夹带控制是萃取指标控制的重要内容。夹带包括有机相夹带的水相和水相夹带的有机相。国内很多工厂因夹带问题不能很好解决,影响了产品质量和经济效益,同时给生产带来诸多不利影响。 影响夹带的因素很多,有乳化原因引起的,有机相降解引起的,具体又涉及到料液特性、萃取工艺、萃取设备、萃取操作以及有机相组成等方面,因此,控制夹带需要全盘、系统地加以考虑。本文将夹带产生的原因进行分类叙述,并探讨相应的控制措施。 1 因乳化引起的夹带及控制措施 乳化液是一个多相体系,一般是分散相以细小而稳定的液滴均匀地分布于连续相中所形成的溶液。乳化液滴的直径一般大于0.1μ。 萃取中的乳化液有水包油型和油包水型。乳化是引起夹带的主要因素。因乳化液较稳定,需要长时间澄清分相或采取其它辅助方法才能有效消除,因此,若在混合时发生了乳化,经萃取澄清槽的澄清过程是很难消除乳化的,因而流出的水相或有机相将产生大量相夹带。 1.1乳化形成的原因及对策 1.1.1 料液成分 料液若含有SiO2、Ca、Mg、Fe、Al、Cr、Mn、固体微粒等成分会对萃取过程和分相产生不利影响。它们能稳定水包油型乳化液,使乳化液长时间稳定存在[1]。它们稳定乳化液的机理是:它们与有机相小液滴中的活性成分相互作用而吸附于有机相小液滴表面,形成固体界面膜[2],这些物质形成的固体界面膜是亲水的,因而在固体界面膜外围形成一层定域化水膜,进而阻碍有机相小液滴的凝并,此外,固体界面膜能显著降低有机相小液滴的表面张力[3,4],这就降低了小液滴凝并的推动力,使得乳化液更加稳定。这种乳化液的结构如图1所示。 其中以SiO2或硅酸盐对水包油型乳化的稳定作用最显著,当料液SiO2含量高时,有机相将夹带大量水相,严重时可使分相速度变得非常缓慢。一般来说,料液SiO2含量应控制在0.1g/L以下。此外,由于乳化液双电层结构产生的电场也可使Ca、Mg、Fe、Al、Cr等金属离子溶解度下降而沉淀析出,析出的固体微粒或胶体物质也会形成有机相小液滴的固体界面膜,所以,即使料液中的Ca、Mg、Fe、Al等金属离子没有达到饱和也会析出形成固体界面膜。 若乳化液液滴直径很小,形成固体界面膜后,其密度可能与水相接近,同时由于布朗运动的作用,难以上浮而悬浮于水相中,随着水相一起流失。若形成的乳化液滴较大
从铜铁浸出液中选择性萃取铜的工艺研究
从铜铁浸出液中选择性萃取铜的工艺研究 阳启华,汤启明,邹潜,徐志刚,李凤,李建 (重庆浩康集团金属溶剂萃取工程技术研究中心,重庆 401121) 摘要:针对某低铜高铁料液在萃取过程中存在除铁效果不佳的问题进行了模拟实验和原因分析,并比较了萃取段相比O/A、料液pH值、反萃段相比O/A和增加洗涤段等工艺条件对铜萃取率和除铁效果的影响,寻找改善萃取效果的措施。结果表明,采用“一萃一洗一反”工艺,合理控制工艺条件,可使铜萃取率达到96.15%,负载有机相铁浓度降低至0.022g/L。在工艺改进基础上,对Mextral5910H与Acorga M5910两种萃取剂进行了实验对比,发现使用Mextral5910H能进一步提高铜萃取率至97.80%,负载有机相铁浓度降低至0.013g/L,取得了更好的萃取效果。 关键词:萃取;铜;铁;萃取率;Mextral 5910H Process research on selective extraction of copper from leaching solution containing copper and iron Yang Qihua, Tang Qiming, Zou Qian, Xu Zhigang, Li Feng, Li Jian (Metal Solvent Extraction Research Center, Hallochem Group Co., Ltd, Chongqing 401121, China)Abstract: In order to improve iron removal in an extraction process involving a low copper and high iron concentration solution, simulation extraction experiments and cause analysis are carried out. Then the effects of the O/A of extraction stage, pH value of leaching solution, O/A of stripping stage and adding scrubbing stage on extraction rate of copper and iron removal are studied. Extraction process of “1E-1W-1S” is proposed to reduce extracted iron amount finally. The results show that extraction rate of copper reaches 96.15% and iron concentration in the loaded organic decreases to 0.022g/L by adjusting the parameters. Experimental comparisons of Mextral 5910H and Acorga M5910 through the process of “1E-1W-1S” are also included, and its results indicate that Mextral 5910H performs better. Extraction rate of copper further increases to 97.80% and extracted iron concentration decreases to 0.013g/L. Key words: solvent extraction; copper; iron; extraction rate; Mextral 5910H 传统的火法铜冶炼工艺能耗高,设备投资大,生产过程中产生含废气、废渣对环境污染严重。而且,随着世界各地铜矿山中的富矿、易开采矿量大量开采,适合于火法工艺的铜矿资源逐年减少,火法炼铜面临着难以为继的处境[1]。 溶剂萃取技术应用于铜工业始于上世纪六十年代,随着肟类、二酮类、三元胺类等新型高效铜萃取剂的成功开发,使得浸出-萃取-电积(L-SX-EW)湿法炼铜工艺真正实现了工业化应用,开创了现代湿法炼铜工业的新局面[1, 2]。实践证明,浸出-萃取-电积工艺具有流程简单、投资少、成本低、环保好、产品质量高等优点,尤其对于处理复杂低品位铜矿更具优势。 选择性分离Cu、Fe是从铜矿浸出液(PLS)中萃取铜的主要任务,Fe对萃取过程和电积过程影响较大,甚至可能导致严重的乳化现象[3]。在铜电积过程中,Fe2+在阳极氧化为Fe3+,Fe3+扩散到阴极又被还原为Fe2+,这样的反复的氧化还原过程会造成电流损耗。同时,因为在电积过程中铁离子不会被消耗,由萃取工序带入的铁离子将在电解液中逐渐累积。因此,提高Cu萃取选择性,严格控制Fe向电积过程的转移量具有重大意义。 溶剂萃取法具有较好的分离富集作用,但是在萃取过程中,料液pH值、萃取剂浓度、有机相水相相比、萃取级数、萃取温度、搅拌时间等都会对金属离子的萃取产生影响[4],而且,浸出低品位铜矿和选铜尾矿得到的料液一般含铜量低(1~5g/L),而铁浓度远高于铜浓度,这更加大了选择性分离、富集铜的难度。 某湿法炼铜企业采用Acorga M5910作为萃取剂,料液含Cu 1.82g/L、Fe 5.26g/L,萃取流程为“两萃一反(2E-1S)”,在增加有机相萃取剂浓度后,萃取工艺除铁效果恶化,电积过程电流效率
从铜氨溶液中萃取分离铜的试验研究
第5期2008年10月 矿产综合利用 M ulti purpose Utili za ti on of M i n era l Resources No .5 O ct .2008从铜氨溶液中萃取分离铜的试验研究 徐建林,史光大,钟庆文,李元坤,余平 (中国地质科学院矿产综合利用研究所,四川 成都 610041) 摘要:采用N902萃取剂从氨2氯化铵体系浸出液中萃取分离二价铜,考察了萃取剂浓度、萃取相比和振荡时间对铜萃取率的影响。结果表明:在单级萃取中,铜萃取率平均为98.60%;在两级萃取中,铜萃取率大于99.99%,而且铜离子也得到了富集。 关键词:萃取;铜;氨溶液;N902 中图分类号:TF111.3 文献标识码:A 文章编号:100026532(2008)0520007203 我国铜矿资源呈富矿少、贫矿多和矿石品位低 的特点,而且低品位难处理氧化铜矿占有的比例较大。随着铜矿石品位的逐年下降和近年铜价的上涨,使处理低品位铜矿的浸出-萃取-电积这一湿 法冶金工艺日益受到人们的重视[1] 。 在对低品位氧化铜矿采用浸出-萃取-电积工艺时,对氨-铵体系浸出液进行萃取分离和富集铜是其中重要的一道工序。从铜氨溶液中萃取分离铜的萃取剂有多种,如N902,L ix984N 和L ix54-100 等。国内的华南师范大学[2]、北京矿冶研究总院[3] 等都对从氨-铵体系浸出液中萃取分离铜进行了研究。 本文介绍了采用N902萃取剂对氨-氯化铵体系浸出液中的铜进行萃取分离和富集铜的试验研究,经过对萃取试验条件的探索,在二级萃取流程试验中,铜离子萃取率大于99.99%,负载有机相中铜浓度较浸出液中提高了近4倍。 1 试验原理及方法 1.1 试验原理 试验采用N902为萃取剂,它是由中国科学院上海有机化学研究所研制的。N902萃取剂外观为琥珀色液体,无可见杂质,密度0.95~0.97g/L,粘度<190CP,闪点>62℃。N902萃取剂是一种类似M5640的萃取铜的螯合萃取剂,主要活性成分为2-羟基-5-壬基水杨醛肟,属于醛肟类铜萃取 剂[4] 。用N902萃取剂从铜氨溶液中萃取铜的化学 反应为[2] : 2HR (o )+Cu (N H 3)2+4(a )CuR 2(o )+2N H + 4(a ) +2N H 3(a ) 式中HR 代表萃取剂的羟肟分子,下角标(a )和 (o )分别表示水相和有机相。 1.2 试验方法 试验的铜氨溶液由氨水-氯化铵对低品位氧化铜矿浸出得到,浸出原液中铜含量为3.7568g/L 。在从铜氨溶液中萃取分离铜的过程中,煤油作为稀释剂,把N902萃取剂用煤油稀释成一定浓度的有机相。将有机相和铜氨溶液(水相)按一定的体积比加入到分液漏斗中,在振荡器中振荡一定时间后进行静置,使含有铜离子的负载有机相和铜离子被萃取后的萃余液分离,分析萃余液中的铜离子浓度,并计算萃取率。然后根据条件试验确定的工艺参数,进行多级萃取试验。 2 结果与讨论 2.1 萃取剂浓度的影响 在萃取相比A /O (水相/有机相)=4,振荡时间为3m in,N902浓度分别为5%、10%、20%、30%、 40%和50%的条件下,萃取剂浓度对铜萃取率的影响见图1。 从图1可以看出:当萃取剂浓度小于30%时,随着萃取剂浓度增大,铜萃取率显著增加;当萃取剂 收稿日期:2008205209 基金项目:国土资源大调查项目(1212010561001) 作者简介:徐建林(1976-),男,硕士,工程师,研究方向为有色冶金。
乙酸水溶液的萃取
萃取(3课时) 【实验目的】 1、 学习萃取的原理与方法。 2、 掌握分液漏斗的使用及影响萃取效率的因素。 【实验原理】 1、萃取的概念: 萃取:是利用物质在两种互不相溶(或微容)溶剂中溶解度或分配比的不同来达到分离提纯或纯化的一种操作。 2、 萃取的原理: 设溶液由有机化合物小X 溶解于溶剂A 而成,现如要从中萃取X ,应选择一种对X 溶解 极好,而与溶剂A 不相混溶和不起化学反应的溶剂B 。X 在A 、B 两相间的浓度根据分配定律: = K (分配系数) W 0,每次萃取所用溶剂B 的体积均为S ,经过n 次萃取后溶质在溶剂A 中的剩余量为W n ,则: Wn = KV KV +S W 0 n 因为 KV ∕KV+S 恒小于1 所以 n 越大, W n 越小。一般n = 3~5,即萃取3~5次。 3、萃取的意义:分离和提纯固态或液态的有机化合物,从液体中萃取常用分液漏斗。 【药品和仪器】 仪器:分液漏斗;锥形瓶;碱式滴定管; 药品:冰醋酸与水的混合溶液(冰醋酸:水 = 1:19);乙醚; mol/L NaOH ; 酚酞指示剂; 【物理常数】 样品 M d 420 m..p S 水 CH 3COOH 60 ∞ Et 2O 74 -116。62 微 【基本操作】 1、 分液漏斗应用的范围: (1) 分离两种分层不起作用的液体; (2) 从溶液中萃取某种成分; (3) 用水或碱或酸洗涤某种产品;
(4)用来滴加某种试剂; 2、分液漏斗的使用方法: (1)选择合适大小的分液漏斗,比待处理液体积大1-2倍。 (2)检查玻璃塞和活塞是否严密,涂凡士林时,不能抹在活塞的孔中。 (3)洗净、烘干、备用。注意不能把活塞上附有凡士林的分液漏斗放在烘箱内烘干。 (4)将含有有机物的水溶液和萃取溶剂依次自上口倒入分液漏斗。 (5)振荡、?放气、静置。注意放气时漏斗向上倾斜,朝无人处放气;不能拿在手中静置。 (6)分离。上口玻璃塞打开后才能开启活塞;上层物从上口放出,下层物从下口放处。 【实验内容】 实验以乙醚从醋酸水溶液中萃取醋酸采用以下两种方法: 1、一次性用30 mL乙醚萃取乙酸。 2、进行多次萃取,用乙醚量为10mL∕次×3次。 【实验步骤】 1、一次萃取法 (1)用移液管准确量取10mL冰醋酸与水的混合液放入分液漏斗中,用30mL乙醚萃取。 (2)用右手食指将漏斗上端玻塞顶住,用大拇指及食指中指握住漏斗,转动左手的食指和中指蜷握在活塞柄上,使振荡过程中玻塞和活塞均夹紧,上下轻轻振荡分液漏斗,每隔几秒针放气。 (3)将分液漏斗置于铁圈,当溶液分成两层后,小心旋开活塞,放出下层水溶液于50mL三角烧瓶内。 (4)加入3-4滴酚酞作指示剂,用L NaOH溶液滴定,记录用去NaOH溶液的体积。 计算:a.留在水中醋酸量及质量分数。 b.留在乙醚中醋酸量及质量分数。 2、多次萃取法 (1)准确量取10mL冰乙酸与水的混合液于分液漏斗中,用10mL乙醚如上法萃取,分去乙醚溶液。 (2)将水溶液再用10mL乙醚萃取,分出乙醚溶液。 (3)将第二次剩余水溶液再用10mL乙醚萃取,如此共三次。 (4)用L年NaOH溶液滴定水溶液。 计算:a. 留在水中醋酸量及质量分数。 b.留在乙醚中醋酸量及质量分数。 比较两种方法的萃取效果。 【注意事项】 1、使用分液漏斗前要检查玻赛和活塞是否紧密, 2、漏斗向上倾斜,朝无人处放气。 3、使用前要先打开玻塞再开启活塞。 4、分液要彻底,上层物从上口放出,下层物从下口放处。 5、使用乙醚时,近旁不能有火。
铜萃取剂的性能维护和品质保养
铜萃取剂的性能维护及品质保养 徐志刚,邹潜,李建,汤启明,王朝华,李凤 (重庆浩康集团重庆康普化学工业股份有限公司,重庆邮编:401221) 摘要:本文简述了铜萃取剂在运行过程中的降解情况,分析了可能导致其降解或污染的外部因素。介绍了铜萃取剂性能维护及品质保养的方法,比如对浸出液(PLS)进行除杂净化,对有机相进行粘土处理,对萃取剂进行再生,对操作工艺进行优化等。阐述了维护萃取剂有机相良好品质和性能的重要性。 关键词:铜萃取剂;降解;性能;净化;再生 Performance and quality maintenance of copper extractants Xu Zhigang,Zou Qian,Li Jian,Tang Qiming, Wang Chaohua,Li Feng (Hallochem Group, Kopper Chemical Industry Corp.,LTD. ,Chong Qing 401221, China) Abstract:The hydrolysis and oxidation degradation of the copper extractants in the running process was introduced, the external factors that may lead to degradation or pollution of the extractants was analyzed. The methods of maintaining the performance and quality of copper extractants were introduced, such as the purification treatment of the leaching solution (PLS), the clay treatment on extracting reagents, the extractants regeneration, the process optimization and so on. The importance of maintaining the good quality and excellent performance of the copper extractants was clarified. Key words:Copper extractants;degradation;performance;purification;regeneration 铜的冶炼主要有两种方式:火法与湿法。火法冶炼有着悠久的历史,技术也非常成熟,是当前大多数国家所采用的主要冶炼方式,在我国也仍占据着主导地位。而湿法冶炼,起步于上世纪60年代美国亚利桑那州的蓝鸟铜矿(Blue bird)和巴格达铜矿(Bagdad)[1-2], 虽然起步较晚,但由于在节能降耗、环保排放以及对矿石资源品位的要求上比传统的火法冶炼有着明显的优势,目前发展势头迅猛,工艺技术也日趋成熟,应用规模在迅速扩大。湿法冶炼在我国尚处于起步阶段,应用规模较小,但在美国、澳大利亚、墨西哥、秘鲁以及赞比亚等国的应用较广,而智利更是以湿法冶炼为主。 由于湿法冶炼在国外起步较早,应用较广,规模较大,研究较多,因此技术相较于国内要成熟一些,经验也丰富一些,操作运行的情况较国内也好一些。反观国内,许多方面与国外先进水平尚存差距,有些领域的差距还非常大。国外操作得好的L-SX-EW工厂连续运行20-30年后还依然保持着良好的运行状态,而国内的湿法冶炼企业可能运行短短几年就会因为有机相的品质恶化而造成分相不好或难以分相最终不得不停产进行清理。为何会出现这样的情况呢?究其原因是我们对有机相的性能和品质没有引起足够的重视,生产经营中在这方面的投入也比较少,再加上国内对于这方面的研究和报道也不多,能够为湿法炼铜企业提供技术支持和经验分享的渠道有限。 本文对如何有效地维护铜萃取剂在运行过程中的性能和品质进行了研究,供同行们在解决类似的问题时提供参考。 1 铜萃取剂在运行中的性能变化
铜萃取-电积的操作过程及注意事项
铜萃取-电积的操作过程及注意事项 2010-9-1 14:07:31 浏览:1243 次我要评论 [导读]本文从两方面陈述了铜萃取-电积的操作过程及注意事项。 一、铜萃取过程 萃取设备一般采用多级逆流混合澄清器。萃取参数,如萃取级数、有机相中萃取剂的浓度、在混合室中两相接触时间,在澄清室的分相时间、两相的相比等均由试验选定。萃取效率决定于萃取体系的性质和设计的混合澄清器的级效率。在萃取体系一定时,主要看设备的设计水平高低和加工的质量状况。 铜萃取过程中两相的流向和过程可由图1来说明。 图1 铜萃取过程示意图 由图1可知,铜浸出液与有机相在混合澄清器中作逆向运动。铜浸出液自第1级的混合室底部进入,与第2级澄清室溢流而来的有机相混合,实现萃取;搅拌不仅使两相混合均匀,而且将混合液体排往澄清室,让两相静置分层。铜浸出液经第1级混合萃取,与有机相混合后被排往第1级澄清室分层,再由第1级澄清室底部进入第2级混合室,如此渐进,直到第4级的澄清室底部排出,成为萃余水相,返回作堆浸的溶浸液。贫(新)有机相从第4级混合室进入,与经过几
级萃取的铜浸出液逆流混合后,排往第4级澄清室静置分层,再溢流进入第3级混合室,如此渐进,直至第1级澄清室成为饱和有机相排出,经洗涤后再进行铜的反萃取。 反萃取的操作如同萃取;所不同的是在萃取中,铜浸出液作连续相,有机相作分散相,而在反萃取时,有机相作连续相,而水相(反萃液)作分散相。 在铜的萃取与反萃取操作中应该注意下列事项: (一)保持界面的稳定性。萃取过程的恶化,通常是界面的不正常反映在先。运行中如发现界面不稳,必须找出原因,调整萃取参数,努力维护界面的稳定性。 (二)为了防止产生第三相,铜浸出液中的含固量应小于2×10-5,一般应经检查过滤。 (三)贫有机相应定期纯化处理,及时清除贫有机相中积累的Si,Ca,Mg等杂质。 二、铜电积过程 铜电积工艺已十分成熟,可根据反萃取液(即电积原液)的性质,工厂已有的设备和技术条件来选定槽电压、电流密度、电积尾液中铜浓度和硫酸酸度等参数,制定规程。其操作过程较为简单,按预先设定的溶液流速,让电积原液进入电积槽进行电积,溶液中的Cu2+就逐步在始极片(阴极)上沉积。为了保证阴极铜质量,一般需注意下列事项:
萃取原理
液液萃取原理 液液萃取是指两个完全不互溶或部分互溶的液相接触后,一个液相中 的溶质经过物理或化学作用另一个液相,或在两相中重新分配的过程。如图所示。 萃取操作示意图 几个概念: 1 原溶液:欲分离的原料溶液,原溶液中欲萃取组份称为溶质 A ,其余称稀释剂B 2 溶剂S :为萃取A 而加入的溶剂,也称萃取剂 3 萃取相:原溶剂和稀释剂混合萃取后,分成两相,含溶剂S 较多 的一相; 4 萃余相:主含稀释剂的一相 5 萃取液:萃取相脱溶剂后的溶液 6 萃余液:萃余相脱溶剂后的溶液 萃取过程的条件: 1. 两个接触的液相完全不互溶或部分互溶; 2. 溶质组分和稀释剂在两相中分配比不同; 3. 两相接触混合和分相; 4. 溶剂S 对A 和B 的溶解能力不一样,溶剂具有选择性,即 B A B A x x y y 其中:y 表示萃取相内组分浓度;x 表示萃余相内组分浓度。
上式表明:萃取相中A/B的浓度比值应大于萃余相中A/B的浓度比值。 典型工业萃取过程 1以醋酸乙酯为溶剂萃取稀醋酸水溶液中的醋酸,制取无水醋酸。 由于萃取相中含有水,萃余相中含有醋酸乙酯,所以萃取后产品和溶剂均须通过精馏分离实现。 2.以醋酸丁酯为溶剂萃取青霉素产品。 3.以环砜为溶剂从石油轻馏分中提取环烃; 4.以轻油为溶剂从废水中脱酚; 5.以丙烷为溶剂从植物油中提取维生素。 萃取过程的经济性 1 混合物的相对挥发度下或形成恒沸物,用一般精馏方法不能分离或很不经济; 2.混合物浓度很稀,采用精馏方法必须将大量稀释剂B气化,能耗国道; 3 混合液含热敏性物质(如药物等),采用萃取方法精制可避免物料受 热破坏。 萃取过程对萃取剂要求: ①选择性好; ②萃取容量大; ③化学稳定性好; ④分相好; ⑤易于反萃取或精馏分离;
萃取精馏分离醋酸_水溶液溶剂研究进展及机理分析
修改稿日期:2005203224;作者简介:李新利(1978 -),女,硕研,助教,电邮nanjingli @1631com 。 萃取精馏分离醋酸/水溶液溶剂研究进展及机理分析3 李新利,唐聪明 (西华师范大学化学化工学院,南充 637002) 摘要:介绍了萃取精馏法分离醋酸水溶液萃取剂的研究进展,在此基础上初步分析了萃取剂与原溶剂组分间的相互作用,醋酸提供质子给萃取剂,与萃取剂分子之间产生松弛的化学作用,从而改变了醋酸在液相中的活度系数,即改变了水对醋酸的相对挥发度。针对几种分离效果较优的萃取剂,探讨了该萃取剂与醋酸发生质子化的可能位置。本文分析结果表明,对于醋酸水溶液的分离,酰胺和砜类是可能合适的萃取精馏溶剂。 关键词:醋酸;水;萃取精馏;质子化 中图分类号:TQ 42 文献标识码:A 文章编号:100129219(2005)06263204 0 前言 萃取精馏是一种特殊精馏方法。它是向共沸物 或不易分离的混合物中加入一种萃取溶剂,使难分离组分间的相对挥发度增大,从而达到设计的分离要求。醋酸水溶液是高度非理想物系,传统的普通精馏法不仅塔板数多,能耗大,而且难以分离彻底。以萃取精馏法分离醋酸水溶液的研究已有不少的文献报道[1212],但是前人的工作主要集中于萃取剂的选择和萃取精馏塔条件实验等方面。本文在对萃取剂进行综述的基础上,分析讨论了萃取剂与醋酸分子间质子化作用位置与形成的络合物结构。 1 萃取精馏法分离醋酸水溶液萃取剂 的研究进展 111 单一萃取剂的研究进展 人们很早就知道叔胺类物质对酸与非酸溶液具有很好的分离效果。因此,Von G arwin [2] 提出用二 甲基苯胺来分离醋酸水溶液。但是二甲基苯胺与水形成最低共沸物。 Wolgang Muller [3]提出以1,22吗啉乙烷(熔点72℃,沸点20418℃[01013MPa ])为萃取剂,对醋酸含量50%(质量分数,下同)的酸水溶液进行减压萃取精馏,塔顶水含酸仅0101%;虽然1,22吗啉乙烷分离效果很好,但存在因熔沸点过高引起的需保温 管路输 送、溶剂回收塔减压操作等问题。此外,吗啉乙烷不是很常见的溶剂也限制了它的应用。 Rudolf Sartorius [4]选用N 2甲基乙酰胺做萃取 剂,在处理含酸4515%的酸水溶液时,萃取精馏塔维持常压,塔顶水含酸0101%。溶剂回收塔减压操作,顶塔顶酸含量9918%。他还发现,在萃取剂循环使用过程中,加入5%的水对分离效果没有影响, 可以降低其熔点(降至15℃ ),便以输送。在德国专利[5]中,曾用N 2甲酰吗啉做萃取剂分离甲酸或乙酸水溶液。N 2甲酰吗啉熔点较低,但是同样也存在减压操作的问题。 N 2甲基吡硌烷酮常温下以液态形式存在,与 水、醋酸混溶,同时不形成共沸物、热稳定(分解温度 在425℃ )。Cohen [6]研究了这种环状酰胺对醋酸水溶液分离效果的改善。在萃取精馏塔顶含酸量低于011%。他认为N 2甲基吡咯烷酮与醋酸形成了一种 络合物,在精馏塔底部出来的是醋酸和这种络合物的混合物。适当调节溶剂回收塔温度和压力,这种络合物就会重新分解出醋酸和N 2甲基吡硌烷酮。 Lloyd Berg [729]研究了很多物质对水2醋酸相对 挥发度的改变,代表物质为N ,N 2二甲基甲酰胺和己二腈、二甲亚砜、环丁砜、庚酸、壬酸、新葵酸、异佛乐酮、苯乙酮等。 胡兴兰[10211]等综合研究了含氮类络合剂对水/醋酸体系气液平衡的影响,所选单一溶剂包括脂肪 族胺类,像N ,N 2二甲基甲酰胺(DMF )、N 2甲基乙酰胺(NMA )、N 2甲基吡硌烷酮(NMP )、己内酰胺,和
溶剂萃取法
1、萃取:当含有生化物质的溶液与互不相溶的第二相接触时,生化物质倾向于在两相之间进行分配,当条件选择得恰当时,所需提取的生化物质就会有选择性地发生转移,集中到一相中,而原来溶液中所混有的其它杂质(如中间代谢产物、杂蛋白等)分配在另一相中,这样就能达到某种程度的提纯和浓缩。 2、反萃取:溶质从萃取剂转移到反萃剂的过程。在完成萃取操作后,为进一步纯化目标产物或便于下一步分离操作的实施,将目标产物从有机相转入水相的操作就称为反萃取 3、物理萃取和化学萃取:物理萃取的理论基础是分配定律,而化学萃取服从相律及一般化学反应的平衡定律。 4、生物萃取与传统萃取相比的特殊性:①成分复杂②传质速率不同③相分离性能不同④产物的不稳定性 5、溶剂萃取法的特点:萃取过程有选择性;能与其它步聚相配合;通过相转移减少产品水解;适用于不同规模;传质快;周期短,便于连续操作;毒性与安全环境问题 6、分配定律:一定T、P下,溶质在两个互不相溶的溶剂中分配,平衡时,溶质在两相中浓度之比为常数。 7、在常温常压下K为常数;应用前提条件:①稀溶液②溶质对溶剂互溶没有影响③必须是同一分子类型,不发生缔合或离解 8、分配系数中CL和CH 必须是同一种分子类型,即不发生缔合或离解。对于弱电解质,在水中发生解离,则只有两相中的单分子化合物的浓度才符合分配定律。 9、为什么青霉素在酸性(pH≤2.5)条件下,而红霉素却要在碱性(pH≥9.8)条件下才能被萃取到丁酯中去呢?①根据表观分配系数公式可知,弱酸的表观分配系数:K=K0 /(1 +10 pH -pK )弱酸的表观分配系数:K=K0 /(1 +10 pK -pH )对于弱酸:pH< pK 时,分配系数大,对于弱碱:pH> pK 时,分配系数大;②不同pH条件影响弱电解质电离,从而影响分子的极性,根据相似相溶原则,在弱极性的丁酯中极性小的分子溶解度比水中大10、有机溶剂萃取的影响因素:①影响萃取操作的因素:pH、温度、盐析②有机溶剂的选择③带溶剂④乳化与去乳化 11、T↑,分子扩散速度↑,故萃取速度↑ 12、盐析:生化物质在水中溶解度↓;两相比重差↑两相互溶度↓ 13、常用于生化萃取的有机溶剂有丁醇、丁酯、乙酸乙酯、乙酸丁酯、乙酸戊酯等。 14、乳化:水或有机溶剂以微小液滴分散在有机相或水相中的现象。这样形成的分散体系称乳浊液。乳化带来的问题:有机相和水相分相困难,出现夹带,收率低,纯度低。 15、发酵液乳化的原因:蛋白质的存在,起到表面活性剂;固体粉末对界面的稳定作用 16、乳浊液稳定性和下列几个因素有关:①界面上保护膜是否形成;②液滴是否带电;③介质的粘度。 17、萃取过程:①混和②分离③溶剂回收 18、主要有两类萃取剂:①有机磷类萃取剂②胺类萃取剂 19、稀释剂:溶解萃取剂,改善萃取相的物理性质的有机溶剂,如煤油、己烷、辛烷、苯。稀释剂的选择:①分配系数:稀释剂能够影响分配系数,特别是通过萃取剂/溶剂复合物的溶剂化作用。②选择性:为萃取尽可能少的杂质,使用非极性稀释剂更好。③水溶性:低的水溶性,使溶剂的损失最少。④毒性:对食品和药品应低毒或无毒的溶剂,长链烷烃由于它们具有低毒和低水溶性,因此理应优先使用。⑤粘度和密度:低粘度和低密度的稀释剂会使分相更容易。⑥稳定性:烷烃比醇、酯和卤代烃更难降解⑦第三相的形成 20、超临界流体萃取:概念:利用超临界流体的特殊性质,使其在超临界状态下,与待分离的物料(液体或固体)接触,萃取出目的产物,然后通过降压或升温的方法,使萃取物得到分离。
知识总结:萃取的方法及注意事项
萃取的方法及注意事项 萃取是从溶液或固体混合物中,用溶剂把所需物质抽提出来的操作。它也可以用来洗去混合物中的少量杂质,因此萃取也是提纯物质的一种方法。 一、对溶液进行萃取 对溶液中的某一成分进行萃取时,萃取溶剂与溶液中原来的溶剂必须是不互溶的。所选用的溶剂还必须对所提取的物质溶解度大,而对其它杂质溶解度较小。萃取溶剂多数为有机溶剂,被萃取的溶液一般都是水溶液。 1.用分液漏斗进行萃取。 分液漏斗是实验室中最常用的萃取仪器。 操作方法: (1)选取大小合适的分液漏斗。所用分液漏斗的容积应为被萃取溶液与萃取溶剂二者体积总和的1.5倍。 给漏斗的活塞涂油,塞好。将分液漏斗安放在漏斗架或铁架台的铁圈上。 (2)将溶液与萃取溶剂从漏斗口注入,塞好漏斗口上的塞子(塞子不能涂油,塞好后应再旋紧一下,以防漏液)。 (3)取下分液漏斗,用右手手掌顶住塞子,手指可捉住漏斗口颈或本身,左手握住漏斗的活塞,使大拇指和食指捏住活塞柄,中指垫在塞座下边,做好旋转活塞的准备。振摇漏斗如图5-37所示。振摇 时,漏斗稍倾斜,漏斗口向下,振摇1~2分钟.可 打开活塞,将蒸汽放出。如此反复操作直至发生 的气体很微弱(即放出的气体压力很少)时,再 剧烈振摇2~3分钟,然后将漏斗放回漏斗架,静置。 (4)待漏斗内液体分成上下两层后,打开塞子,再慢慢旋开活塞将下层液体放出。这种将两种互不相溶的液体进行分离的操作叫分液。分液时,一定要尽可能分离干净。有时在两液界面之间会出现一些絮状物,也应将其放出。然后将上层液从漏斗口倒出。切不可从活塞处放出,以免被残留在漏斗颈上的第一种液体玷污。 (5)重复萃取操作3~5次,直至确定最后一次加入的萃取溶剂里已无所需萃取的物质时为止。
溶剂萃取原理
原理示意图 利用化合物在两种互不相溶(或微溶)的溶剂中溶解度或分配系数[1]的不同,使化合物从一种溶剂内转移到另外一种溶剂中。经过反复多次萃取,将绝大部分的化合物提取出来。 分配定律是萃取方法理论的主要依据,物质对不同的溶剂有着不同的溶解度。同时,在两种互不相溶的溶剂中,加入某种可溶性的物质时,它能分别溶解于两种溶剂中,实验证明,在一定温度下,该化合物与此两种溶剂不发生分解、电解、缔合和溶剂化等作用时,此化合物在两液层中之比是一个定值。不论所加物质的量是多少,都是如此。属于物理变化。用公式表示。 CA/CB=K
CA.CB分别表示一种化合物在两种互不相溶地溶剂中的量浓度。K是一个常数,称为“分配系数”。 有机化合物在有机溶剂中一般比在水中溶解度大。用有机溶剂提取溶解于水的化合物是萃取的典型实例。在萃取时,若在水溶液中加入一定量的电解质(如氯化钠),利用“盐析效应”以降低有机物和萃取溶剂在水溶液中的溶解度,常可提高萃取效果。 要把所需要的化合物从溶液中完全萃取出来,通常萃取一次是不够的,必须重复萃取数次。利用分配定律的关系,可以算出经过萃取后化合物的剩余量。 设:V为原溶液的体积 w0为萃取前化合物的总量 w1为萃取一次后化合物的剩余量 w2为萃取二次后化合物的剩余量 w3为萃取n次后化合物的剩余量 S为萃取溶液的体积 经一次萃取,原溶液中该化合物的浓度为w1/V;而萃取溶剂中该化合物的浓度为(w0-w1)/S;两者之比等于K,即: w1/V =K w1=w0 KV (w0-w1)/S KV+S 同理,经二次萃取后,则有 w2/V =K 即 (w1-w2)/S w2=w1 KV =w0 KV KV+S KV+S 因此,经n次提取后: wn=w0 ( KV ) KV+S 当用一定量溶剂时,希望在水中的剩余量越少越好。而上式KV/(KV+S)总是小于1,所以n越大,wn就越小。也就是说把溶剂分成数次作多次萃取比用全部量的溶剂作一次萃取为好。但应该注意,上面的公式适用于几乎和水不相溶地溶剂,例如苯,四氯化碳等。而与水有少量互溶地溶剂乙醚等,上面公式只是近似的。但还是可以定性地指出预期的结果。 仪器:分液漏斗
溶剂萃取
溶剂萃取 一、概述 溶剂萃取:是使互不相溶的两相接触,某些物质从一相转移到另一相的过程。或者说利用有机溶剂从与其不相混溶的液相中把某些物质提取出来的方法。用溶剂萃取分离提取富集物质,其过程包括萃取、洗涤、反萃三个阶段,工艺流程如下: 萃取:将含有被萃物的水溶液与有机相接触,使萃取剂与被萃物作用,生成萃合物进入有机相的过程叫萃取。萃取分层后的有机相叫萃取液(负载有机相)。萃取分层后的水相叫萃余液。
洗涤:用水溶液或水与负载有机相充分接触,使进入有机 相的杂质回到水相的过程叫洗涤。只洗去负载有机相中的杂质,而不使被萃物进入水相。 反萃:用反萃剂与经过洗涤后的负载有机相充分接触,使 被萃物重新由有机相进入水相的过程叫反萃。 相:体系中具有相同物理性质和化学组成的均匀部分,互 不相溶的相与相之间有界面。 相比:是萃取过程中有机相体积与水相体积的比 R = A O V V = 水 有机V V 分配系数:有机相中被萃物的浓度与水相中被萃物的浓度 的比值称为分配系数D ; D =水相 有机相 Me Me C C 分配系数D 越大,被萃物的可萃性越好, 二、萃取剂 萃取剂是一种能与被萃取物质发生作用生成一种不溶于水而易溶于有机相的化合物的有机试剂。 (一)、分类: (1)中性萃取剂:醇、醚、酯、酮等它们在水溶液中呈中性 (2)酸性萃取剂:一般为有机酸,在水溶液中能电离出H +,呈酸性,如羧酸、磺酸、有机磷酸。
(3)碱性萃取剂:一般为有机碱,在水溶液中能结合H+,呈碱性,如胺类化合物 (4)螯合萃取剂:至少具有二个以上的功能团,如羟肟类(二)、萃取剂的结构 由功能团、非极性基团组成。 功能团:直接与待萃取组分作用。如-OH、-SH等 非极性基团:烃基 (三)、对萃取剂的要求 (1)、化学稳定性好,毒性小 (2)、容易制备,价格便宜,来源丰富 (3)、有较大的萃取容量 (4)、选择性好 (5)、易反萃 (6)、比重小,粘度小,沸点高,挥发性小,闪点高,在水中溶解度小。 闪点(Flash point)是指可燃性液体挥发出的蒸汽在与空气形成可燃性混合物之后,遇火源時能够閃烁起火的最低溫度。在這溫度下燃燒無法持續,但如果溫度繼續攀升則可能引發大火。和着火點(Fire Point)不同的是,着火點是指可燃性混合物能夠持續燃燒的最低溫度,高於閃火點。 (四)、中性萃取剂 1、中性含氧萃取剂
常用溶剂除水
常用溶剂除水 常用有机试剂的纯化 1.丙酮 沸点56.2℃,折光率1.358 8,相对密度0.789 9。普通丙酮常含有少量的水及甲醇、乙醛等还原性杂质。其纯化方法有: ⑴.于250mL丙酮中加入2.5g高锰酸钾回流,若高锰酸钾紫色很快消失,再加入少量高锰酸钾继续回流,至紫色不褪为止。然后将丙酮蒸出,用无水碳酸钾或无水硫酸钙干燥,过滤后蒸馏,收集55~56.5℃的馏分。用此法纯化丙酮时,须注意丙酮中含还原性物质不能太多,否则会过多消耗高锰酸钾和丙酮,使处理时间增长。 ⑵.将100mL丙酮装入分液漏斗中,先加入4mL10%硝酸银溶液,再加入3.6mL1mol/L 氢氧化钠溶液,振摇10min,分出丙酮层,再加入无水硫酸钾或无水硫酸钙进行干燥。最后蒸馏收集55~56.5℃馏分。此法比方法⑴要快,但硝酸银较贵,只宜做小量纯化用。 2.二氧六环 沸点101.5℃,熔点12℃,折光率1.442 4,相对密度1.033 6。二氧六环能与水任意混合,常含有少量二乙醇缩醛与水,久贮的二氧六环可能含有过氧化物(鉴定和除去参阅乙醚)。二氧六环的纯化方法,在500mL二氧六环中加入8mL浓盐酸和50mL水的溶液,回流6~10h,在回流过程中,慢慢通入氮气以除去生成的乙醛。冷却后,加入固体氢氧化钾,直到不能再溶解为止,分去水层,再用固体氢氧化钾干燥24h。然后过滤,在金属钠存在下加热回流8~12h,最后在金属钠存在下蒸馏,压入饥丝密封保存。精制过的1,4-二氧环己烷应当避免与空气接触。 3.吡啶 沸点115.5℃,折光率1.509 5,相对密度0.981 9。分析纯的吡啶含有少量水分,可供一般实验用。如要制得无水吡啶,可将吡啶与粒氢氧化钾(钠)一同回流,然后隔绝潮气蒸出备用。干燥的吡啶吸水性很强,保存时应将容器口用石蜡封好。 4.石油醚 石油醚为轻质石油产品,是低相对分子质量烷烃类的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右。有30~60℃,60~90℃,90~120℃等沸程规格的石油醚。其中含有少量不饱和烃,沸点与烷烃相近,用蒸馏法无法分离。 石油醚的精制通常将石油醚用其体积的浓硫酸洗涤2~3次,再用10%硫酸加入高锰酸钾配成的饱和溶液洗涤,直至水层中的紫色不再消失为止。然后再用水洗,经无水氯化钙干燥后蒸馏。若需绝对干燥的石油醚,可加入钠丝(与纯化无水乙醚相同)。 5.甲醇 沸点64.96℃,折光率1.328 8,相对密度0.791 4。普通未精制的甲醇含有0.02%丙酮和0.1%水。而工业甲醇中这些杂质的含量达0.5%~1%。为了制得纯度达99.9%以上的甲醇,可将甲醇用分馏柱分馏。收集64℃的馏分,再用镁去水(与制备无水乙醇相同)。甲醇有毒,处理时应防止吸入其蒸气。 6.乙醇 沸点78.5℃,折光率1.361 6,相对密度0.789 3。制备无水乙醇的方法很多,根据对无水乙醇质量的要求不同而选择不同的方法。若要求98%~99%的乙醇,可采用下列方法: ⑴利用苯、水和乙醇形成低共沸混合物的性质,将苯加入乙醇中,进行分馏,在64.9℃时蒸出苯、水、乙醇的三元恒沸混合物,多余的苯在68.3与乙醇形成二元恒沸混合物被蒸出,最后蒸出乙醇。工业多采用此法。 ⑵用生石灰脱水。于100mL95%乙醇中加入新鲜的块状生石灰20g,回流3~5h,然后进
溶剂萃取分离法
溶剂萃取分离法 萃取分离法包括液相-液相、固相-液相和气相-液相等几种方法,但应用最广泛的为液-液萃取分离法(亦称溶剂萃取分离法)。该法常用一种与水不相溶的有机溶剂与试液一起混合振荡,然后搁置分层,这时便有一种或几种组分转入有机相中,而另一些组分则仍留在试液中,从而达到分离的目的。 溶剂萃取分离法既可用于常量元素的分离又适用于痕量元素的分离与富集,而且方法简单、快速。如果萃取的组分是有色化合物,便可直接进行比色测定,称为萃取比色法。这种方法具有较高的灵敏度和选择性。 一、萃取分离的基本原理 (一)萃取过程的本质 根据相似相溶规则,将物质由亲水性转化为疏水性。 极性化合物易溶于极性的溶剂中,而非极性化合物易溶于非极性的溶剂中,这一规律称为“相似相溶原则”。例如I2是一种非极性化合物、CCl4是非极性溶剂,水是极性溶剂,所以I2易溶于CCl4而难溶于水。当用等体积的CCl4从I2的水溶液中提取I2时,萃取百分率可达98.8%。又如用水可以从丙醇和溴丙烷的混合液,萃取极性的丙醇。常用的非极性溶剂有:酮类、醚类、苯、CCl4和CHCl3等。 无机化合物在水溶液中受水分子极性的作用,电离成为带电荷的亲水性离子,并进一步结合成为水合离子,而易溶于水中。如果要从水溶液中萃取水合离子,显然是比较困难的。为了从水溶液中萃取某种金属离子,就必须设法脱去水合离子周围的水分子,并中和所带的电荷,使之变成极性很弱的可溶于有机溶剂的化合物,就是说将亲水性的离子变成疏水性的化合物。为此,常加入某种试剂使之与被萃取的金属离子作用,生成一种不带电荷的易溶于有机溶剂的分子,然后用有机溶剂萃取。例如Ni2+在水溶液中是亲水性的,以水合离子Ni(H2O)62+的状态存在。如果在氨性溶液中,加人丁二酮肟试剂,生成疏水性的丁二酮肟镍螯合物分子,它不带电荷并由硫水基团取许代了水合离子中的水分子,成为亲有机溶剂的硫水性化合物,即可用CHCl3萃取。 (二)分配系数 设物质A在萃取过程中分配在不互溶的水相和有机相中: A有= A水
