不饱和醛酮选择性加氢

不饱和醛酮选择性加氢
第一部分背景介绍
不饱和醇应用于大量的工业生产中,药物合成、香料、聚合物、除草剂等。目前一种合成不饱和醇的方法是将不饱和醛酮进行催化加氢。但是由于C=C键比C=O键在加氢过程中在热力学中更加有利。所以研发新型催化剂对不饱和醛酮选择性加氢十分重要。
这里,介绍了五种新型催化剂催化不同的不饱和醛酮加氢,希望为今后的研究提供新的基础。
第二部分文献综述
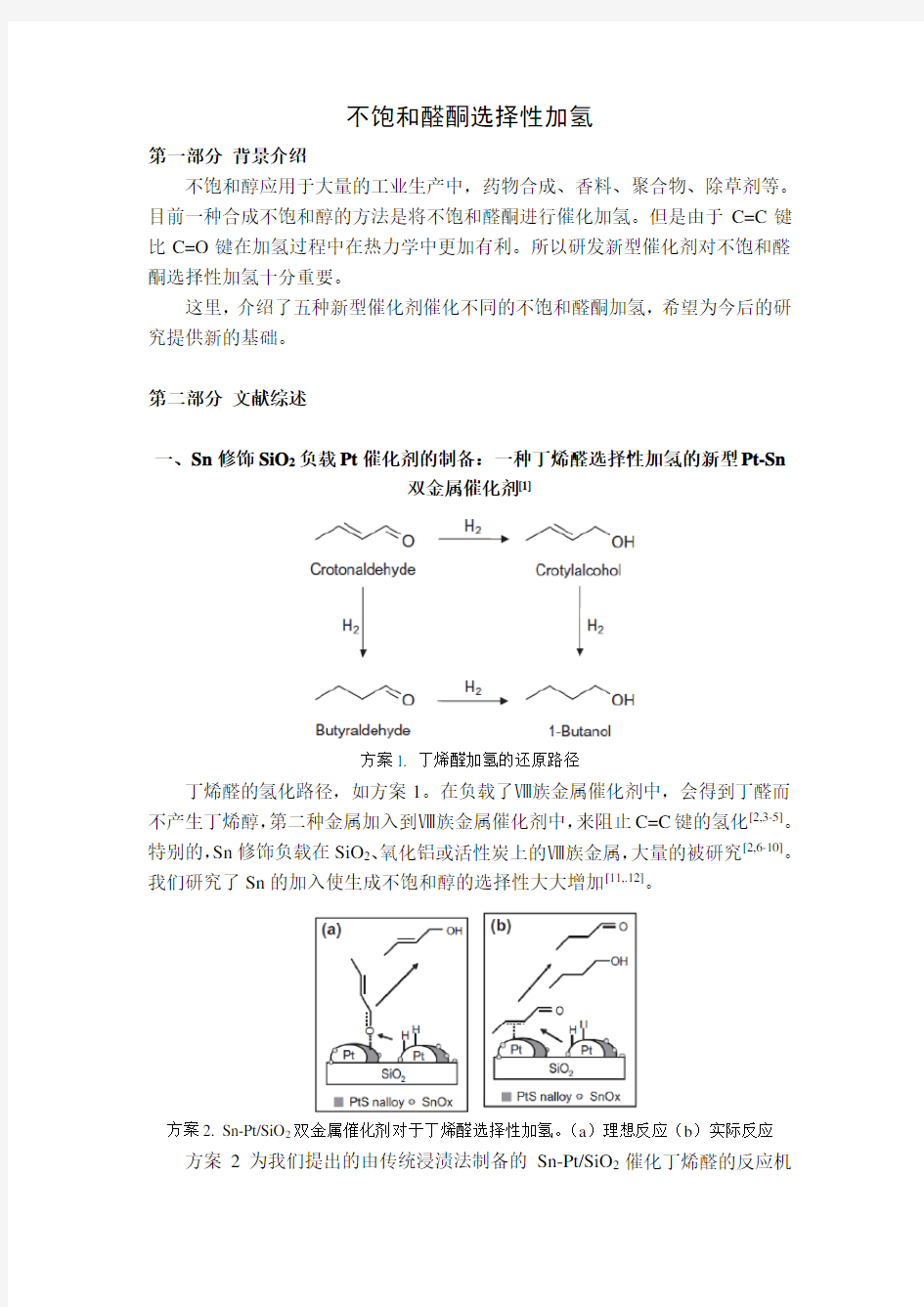
一、Sn修饰SiO2负载Pt催化剂的制备:一种丁烯醛选择性加氢的新型Pt-Sn
双金属催化剂[1]
方案1. 丁烯醛加氢的还原路径
丁烯醛的氢化路径,如方案1。在负载了Ⅷ族金属催化剂中,会得到丁醛而不产生丁烯醇,第二种金属加入到Ⅷ族金属催化剂中,来阻止C=C键的氢化[2,3-5]。特别的,Sn修饰负载在SiO2、氧化铝或活性炭上的Ⅷ族金属,大量的被研究[2,6-10]。我们研究了Sn的加入使生成不饱和醇的选择性大大增加[11,.12]。
方案2. Sn-Pt/SiO2双金属催化剂对于丁烯醛选择性加氢。(a)理想反应(b)实际反应方案2为我们提出的由传统浸渍法制备的Sn-Pt/SiO2催化丁烯醛的反应机
理。Sn n+例如SnO和SnO2提高了对C=O的活性,然而SnPt合金的形成或通过金属Sn进行Pt表面原子的稀释,会抑制C=C的氢化[13]。对于理想状态(方案2a),不饱和醛通过C=O基团的O原子,吸附在SnO x(例如SnO或SnO2)上。然后,活化的C=O基团被通过Pt表面活化的H攻击形成不饱和醇。由于C=C键会与Pt相互作用,所以C=C键的氢化不可避免。然而,如果Pt区域完全被Sn 覆盖,由于H分子不能被活化,则氢化反应不会发生。
为了不在活性明显下降的情况下,进一步提高对不饱和醇的选择性,需要两个条件。一个不饱和醛的是C=C键不直接与Pt表面接触,来抑制C=C氢化。另一个是H分子在Pt表面上被活化。有两个策略来避免Pt区域和不饱和醛的直接接触。一个是形成足够均匀的SnPt合金。正如之前提到的,金属Sn形成SnPt 可以抑制C=C键和Pt的相互作用。因此,为了制备足够均匀的SnPt合金,C=C 键的氢化被抑制。另一个是通过SnO2层来避免Pt和C=C键的相互作用,活化C=O基团的SnO x存在在Pt金属附近,尽管SnO x通过SiO2层与Pt完全分离。
根据前面的方案,我们尝试制备SiO2包裹在SnPt内部的纳米粒子[14]。这种纳米粒子(摩尔比Sn/Pt=1.0)用多元醇工艺来制备。在这种方法,形成均一的SnPt合金纳米粒子。这些催化剂具有高选择性(66.7%,转化率为41.1%),由于SnPt合金中心和反应物方向的控制的协同效应。
方案3. Sn/SP催化丁烯醛加氢
对于后者策略,这种催化剂是Pt纳米粒子覆盖到多孔的SiO2层,Sn在SiO2层的外表面。目前,包裹在SiO2壳内部的金属或金属氧化物纳米粒子,在很多领域进行了研究[15-23]。很多研究报道了Ni[16,17],Pt[18,19],FePt[20]和Rh[21-23]纳米粒子包裹到介孔SiO2壳中。报道了SP催化剂通过金属醇盐在反相胶束溶液中水解作用来合成,SiO2层是微孔和介孔。把Sn加入到SP催化剂中,控制孔的尺寸使H2可以进入Pt孔,然而不饱和醛不能进入Pt孔,我们提出了新的概念如方案3。由于不饱和醛不能进入Pt纳米粒子孔,C=C键的氢化被抑制,在SiO2外表面Sn位点的C=O键被活化。由中心Pt粒子活化的溢流氢通过Sn的吸附攻
击C=O键形成不饱和醇。
目前,SiO2负载Pt催化剂用微乳液制备,SP催化剂用浸渍法和Sn制备Sn 修饰SiO2负载Pt(Sn/SP)催化剂。为了证实Pt和Sn的分离,SP和Sn/SP催化剂的形态和物理性能通过TEM,EXAFS,H2和CO的化学吸附。Sn/SP的氢化丁烯醛的性能与传统的催化剂作对比。除此之外,我们提出了新的概念在Sn/SP 催化剂上选择性加氢。
2.实验
2.1.催化剂的制备
2.1.1 SiO2负载Pt(SP)
SiO2负载Pt纳米粒子根据文献用油包水微乳液制备[19]。为了形成微乳液,十六烷基聚乙二醇(15),一种非离子型表面活性剂,环己烷作为溶剂。表面活性剂在溶剂中的浓度是0.5mol/L。H2PtCl6的水溶液在323K注射入溶液中。为了稳定Pt纳米粒子,包含CTABr和1-己醇的溶液加入到微乳液中,CTABr在1-己醇中的浓度是0.3mol/L。TEOS(0.86mol/L),作为SiO2的来源加入到微乳液中,然后加入稀释的氨水溶液(28%)。TEOS的水解反应在323K下进行1h。为了终止水解作用,通过加入2-丙醇来破坏SiO2覆盖Pt纳米粒子溶液的胶束结构。溶液离心来与沉淀分离,然后得到的沉淀用2-丙醇完全洗涤,在353K下过夜干燥,在623-823K的空气流中煅烧2h来移除表面活性剂。在空气中煅烧后,样品浸入王水溶液24h来移除未覆盖在SiO2上的Pt纳米粒子。最后,样品在393K 下干燥过夜,在相同的温度下煅烧2h,在573K的H2流下还原2h。通过XRF 分析,Pt的负载量约4%。
2.1.2 Sn修饰SiO2负载Pt(Sn/SP)
Sn修饰SiO2负载Pt催化剂通过浸渍法SP和SnCl2?2H2O的乙醇溶液来制备,用王水处理并干燥。Sn/Pt的摩尔比一致。浸渍后,样品在393K下干燥过夜并在相同的温度下在空气流中煅烧2h,来除去表面活性剂。最后,在573-773K的H2气流下还原2h得到样品。
2.1.3 负载型Pt或Sn单金属催化剂
这里使用的SiO2载体在制备催化剂之前在773K空气下煅烧5h。Pt/SiO2和Sn/SiO2通过将SiO2载体和H2PtCl6的水溶液或SnCl2?2H2O(15mL)的乙醇溶液来制备。Pt和Sn在载体上的负载量是4wt%和2.5-5.1wt%。然后,样品在393K 下干燥过夜,在823K的空气流中煅烧2h。然后,Pt/SiO2在573K的H2下还原2h。在Sn/SiO2情况下,为了XRD测试,样品在573-773K下还原2h。
2.1.4 负载Sn/Pt双金属催化剂
负载Sn/Pt双金属催化剂继续用浸渍法来制备。煅烧后的Pt/SiO2,在SnCl2?2H2O的乙醇溶液中浸渍,393K下干燥过夜,在823K的空气中煅烧2h,
573K的H2下还原2h。Sn/Pt的摩尔比为1.0-1.5。
3. 结果与讨论
3.1 SP和Sn/SP催化剂的形态和物理性能
图1. (a)SP (b)Sn/SP催化剂XRD图。823K空气焙烧并且573K氢气还原图1为SP和Sn/SP催化剂的XRD图,823K空气下煅烧、573K氢气下还原。在两个催化剂中,观察到2θ=39°和47°有明显的衍射线,分别表示Pt(111)和(200)的衍射峰[24]。证实了SP和Sn/SP催化剂上的Pt的存在。对于Sn/SP 催化剂,出现了27°、34°和52°的2θ峰,是SnO2的存在[25]。
图2. (a)SP和(b)Sn/SP催化剂TEM图。823K空气焙烧并且573K氢气还原图2为SP和Sn/SP的催化剂的TEM图,823K空气下煅烧、573K氢气下还原。在SP中(图2a),发现Pt粒子负载在球形SiO2粒子的中心,Pt和SiO2粒子的尺寸均一。Pt在SP催化剂的负载量通过XRF测试为3.9wt%。Pt粒子和整个SiO2负载Pt的尺寸约为5nm和50nm。SiO2层厚度为20-25nm。在Sn/SP 中(图2b),Sn氧化物粒子继续通过浸渍出现在SiO2的外表面。此外,在Sn/SP 中,没有观察到SP催化剂的核壳结构的坍塌。表明了核壳结构在Sn的浸渍过程中稳定存在。
图3. k3-加权Sn K-吸收边EXAFS傅里叶变换图。
(a)SnO2,(b)Sn/SiO2,(c)Sn/SP,(d)Sn/Pt/SiO2(Sn/Pt=1.5)
EXAFS数据如图3。SnO2作为参考,1.6?的峰是氧原子(Sn-O)配位层位于距离Sn2.06 ?。2.9和3.5?的峰分别是位于距离3.18?和3.72?的第一和第二近的Sn的贡献[26,27]。
对于Sn/Pt/SiO2催化剂,图3d中观察到2.5?的峰。这在SnO2和Sn/SiO2中未观察到。此外,由于次最近Sn(Sn-O-Sn)的贡献3.5?的峰没有在Sn/Pt/SiO2(Sn/Pt=1.5)中观察到。因此,2.5?的峰是与Pt配位的Sn原子。在Sn-Pt双金属催化剂中,例如,Sn/Pt/SiO2通过继续浸渍法制备,Sn前躯体可以容易的吸附在Pt表面,并发生Sn和Pt的相互作用,形成SnPt合金[28,29]。此外,Sn-Pt距离为2.72?符合文献的报道(2.5-2.8?)[30,31]。因此,Sn-Pt这个峰存在与SnPt合金中。
Sn/SP在823K煅烧和在573K氢气还原,显示了与SnO2和Sn/SiO2相同的结构函数,如图3c。在这种情况下,没有观察到Sn-Pt在2.5?处的峰,表明Sn 和Pt没有相互作用。这一结果表明了Sn和Pt在一个催化剂粒子上达到完全分离。
表1. Sn K-吸收边EXAFS振荡曲线分析数据
为了评价Sn在每个样品的结构参数,进行了EXAFS振荡拟合曲线,具体参数如表1。在Sn/SiO2和Sn/SP中,Sn-O和Sn-Sn的配位数和原子间距离与标
准样品SnO2基本一致。结果也表明了Sn元素作为SnO2存在于Sn/SiO2和Sn/SP 催化剂中。对于Sn/Pt/SiO2催化剂,配位数比SnO2小。这一结果表明一部分Sn 与Pt之间无相互作用,它们在Sn/Pt/SiO2中形成SnO2小颗粒。
图4. H2和CO在SP和Sn/SP的化学吸附能力
H2和CO在SP和Sn/SP的化学吸附能力如图4。H2和CO的不可逆吸附可以在所有情况下观察到。在这些催化剂中,H2和CO的化学吸附只发生在Pt上,这一结果证明了H2和CO通过带孔的SiO2层到达Pt纳米粒子。
在SP催化剂中,H2化学吸附的数量在任何煅烧温度下均保持一致。另一方面,CO的化学吸附具有不同的倾向。CO化学吸附的数量随着煅烧温度直到823K 增加而减小,CO在823K几乎不在SP吸附。这可能是因为CO与Pt中心的相互作用通过SiO2层来阻止。这些结果表明了,由于不饱和醛比CO分子大很多,SiO2层阻止不饱和醛与Pt的相互作用。
823K时的H2和CO对于SP和Sn/SP吸附作用几乎没有观察到不同。在Sn-Rh 和Sn-Pt[32,33]双金属催化剂中,相对于CO,H2不可逆的化学吸附量随着Sn负载量的增加而大大减少。CO吸附量随着Sn增加缓慢降低,但未降低到零。这一结果归因于H2分子需要至少与Rh相邻的两个分子来吸附解离。因此,H2分子的解离吸附随着Sn的增加而强烈被抑制。在Sn/SP催化剂中,如果Sn前体到达中心Pt纳米粒子,Pt吸附H2解离就会减少,因此H2的吸附量相对于CO来说大大降低。然而在Sn/SP中,没有观察到H2吸附量的减少。这一结果表明Sn前体浸渍SP没有到达中心Pt纳米粒子,Sn和Pt没有相互作用的发生。
3.2 中心Pt的氢溢流到达SiO2外表面的Sn氧化物
图5 Sn/SiO2和Sn/SP在823K煅烧后和不同温度下H2还原的XRD图图5为Sn/SiO2和Sn/SP在823K煅烧后和不同温度下H2还原的XRD图。2θ为30°、32°、44°和45°的峰是Sn金属。
在Sn/SiO2催化剂中,SnO2的峰完全消失而Sn的峰出现在773K的还原温度下。相对来说,Sn/SP中Sn元素在673K下从SnO2还原到Sn。在Sn/SP中,SnO2完全还原为Sn的还原温度下降,是由于中心Pt粒子形成的氢溢流。因此,这表明氢溢流在氢化反应时通过SiO2层的孔,可以达到SiO2外表面的SnO2。3.3 丁烯醛的选择性氢化
表2. 每种催化剂对于丁烯醛选择性加氢
表2表示所有催化剂对于丁烯醛的氢化情况。用于此反应的催化剂在823K 空气下煅烧,573K氢气下还原,由XRD和EXAFS,Sn元素作为SnO2出现在Sn/SiO2和Sn/SP催化剂中。在传统的Pt/SiO2催化剂中,丁醛是主要产物,生成丁烯醇的选择性为2.4%。在加入Sn后,选择性增加到10.0%。表明了Sn 的加入可以活化C=O基团。对于Sn/SiO2,由于缺乏氢的活化位点,反应不发生。
在核壳催化剂中,SP和Sn/SP催化剂,相比于负载单金属和双金属催化剂,丁烯醛的转化率降低。SP催化剂823K煅烧和573K还原,丁烯醛几乎不发生氢化,丁醛和1-丁醇少量产生。
在Sn/SP中,得到了对于丁烯醇的高选择性(100%)和4.1%的产率。基于TEM、EXAFS、H2和CO化学吸附结果,SnO2负载在了SP粒子的外表面,中心Pt纳米粒子和SnO2无相互作用。从化学吸附结果来看,证实了SP催化剂的SiO2层的多孔结构并且表明了丁烯醛比CO分子大而不能到达SiO2层的孔中。此外,由H2的化学吸附量表明,氢气活性位点在Pt/SiO2和Sn/SP催化剂中几乎相同。然而,氢化率大大的提高。这一结果表明了C=C键被抑制,不是由于Sn
将Pt表面稀释,而是由于在SiO2层中可利用的Pt纳米粒子量的减少。这些结果表明了丁烯醛的羰基基团的氧原子,通过SP粒子外表面的SnO2来活化,而丁烯醛和中心Pt无相互作用。此外,C=C键的氢化由于立体位阻完全被抑制,也就是SiO2层。更多的是,氢溢流可以到达SP粒子外表面的SnO2,C=O键可以被氢化。
4.结论
1、Sn/SP在823K下煅烧并在573K下还原,Sn和Pt在一个催化剂粒子上完全分离通过TEM、EXAFS和H2和CO的化学吸附来证实。在Sn/SP催化剂中,Sn的作用是活化C=O键,Pt来活化氢。通过Pt中心形成的氢溢流会到达SiO2层的Sn上,来得到不饱和醇。
2、H2和CO化学吸附的结构,带有多孔的SiO2层,表明这些孔不能使丁烯醛通过,而H2分子可以到达Pt中心。
3、对于生成丁烯醇的选择性达到100%,转化率为4.1%。
二、Au负载在铁的氧化物上,进行α,β-不饱和醛的液相加氢[34]
在过去几年里,Au催化剂常用于α,β-不饱和醛的加氢,在一些情况下对于不饱和醇得到高选择性[35-42]。总的来说,对于Au催化剂的载体的选择是可还原的氧化物,例如氧化铁[37,38]、TiO2[39]、CeO2[40,41]和ZrO2[36,42-44]。
在苯亚甲基丙酮的液相氢化中,Milone报道了用Au负载在氧化铁作催化剂的不饱和酮的选择性为60%(转化率90%)[37,38]。这在这种情况下是其他催化剂所不能达到的。作者表明这种高选择性是由于Au和氧化铁的协同作用,电子从还原的氧化铁转移到金属。在Au/TiO2和Au/ZrO2也有相同的报道[43]。
一个有争议的方面是Au粒子尺寸对于反应的选择性。Zanella报道Au粒子尺寸在1.7-8.7nm范围内,Au/TiO2催化丁烯醛的氢化反应是结构不敏感[39]。另一方面,Claus认为丙烯醛的氢化在Au/ZrO2催化中是结构敏感型反应[35,43]。然而,在Claus后续工作中强调,Au催化剂的结构对于选择性的影响,粒子尺寸是第二考虑的因素。Bailey和Hutching研究了丁烯醛氢化的一系列Au/ZnO2催化剂,他们认为小尺寸(直径<2nm)对于这个反应没有选择性,而选择性氢化的活性位点与大的Au晶体的存在相关[36]。根据Bus[45],小的Au团聚体对于Au/γ-Al2O3催化肉桂醛具有高活性和选择性是必要的。在以前的工作中,我们认为在Au/CeO2催化生成丁烯醇中,大尺寸Au粒子(11nm)比小尺寸Au粒子(4nm)的选择性显著降低。
现在的工作关注于两种α,β-不饱和醛(丁烯醛和肉桂醛),以Au负载在针铁矿(α-FeOOH)、赤铁矿(α-Fe2O3)和铁高分散在γ-Al2O3上作为催化剂研究。可以预测,Fe可以在抑制C=C键的同时增加C=O键的活性。
2. 实验
2.1 材料
针铁矿(α-FeOOH)、赤铁矿(α-Fe2O3)、氧化铝(γ-Al2O3)和Fe修饰氧化铝作为载体。
针铁矿和赤铁矿通过水热法合成[46]。针铁矿用浓度为0.53M的Fe(Ⅲ)硝酸盐溶液制备。2M的NaOH加入溶液中得到水铁矿沉淀。固体用蒸馏水洗涤并过滤。水铁矿在含有0.3M的NaOH溶液的PE容器中,在60℃下晶化15天。最后,样品在40℃干燥,在180℃煅烧。
赤铁矿用Fe(Ⅲ)硝酸盐和KOH溶液在90℃下得到。NaHCO3加入到溶液中,悬浮液在90℃、pH=8-9下,在PE容器中晶化2天。
氧化铁负载在氧化铝的3个样品的制备。γ-Al2O3(77m2/g)浸渍在Fe(AcAc)3溶于甲苯中,相应Fe在固体的负载量为5,10,20wt%。48h浸渍后,固体过滤并用溶剂洗涤。固体在450℃下煅烧4h。三个样品命名为5FeAl,10FeAl和20FeAl。
Au用直接阴离子交换法(DAE)负载在赤铁矿上[47]。HAuCl4(1*10-3M)在60℃加入到固体中。目标Au浓度为1%。悬浮液在恒定pH=4下搅拌2h。然后,加入稀释的氨水溶液来除去氯元素,这对在煅烧中Au颗粒的生长有影响[48]。固体过滤并蒸馏水洗涤数次。然后,样品在色谱纯的空气中300℃下煅烧3h。样品命名为Au/HDAE。相同的过程来制备Au负载在5FeAl,10FeAl和20FeAl。命名为Au/5FeAl、Au/10FeAl和Au/15FeAl。在针铁矿中,相同的步骤来制备相应的催化剂(Au/G),但煅烧温度在120℃以避免氢氧化物的分解。
另外的Au/HDP催化剂,用赤铁矿作为载体,用沉淀法来制备。
3. 结果与讨论
3.1 催化剂的合成
赤铁矿和针铁矿载体的XRD分析证实了水热法合成了相应的α-FeOOH和α-Fe2O3。FeAl(氧化铁负载在γ-Al2O3)样品,XRD图与γ-Al2O3对应,但由于Fe在氧化铝表面的高分散,未观察到氧化铁的信号。
表3. 载体和相应催化剂的性能
根据DAE的制备方法,不同载体与HAuCl4溶液接触。pH=4下,Au最稳定的形式是阴离子[AuCl2(OH)2]-[46]。由于载体的IEP为7-9(表3),所有固体表面带有正电荷。因此,Au阴离子化合物被载体表面攻击,并通过交换氧化物表面的一个或两个OH基团形成稳定的固体[48]。赤铁矿和针铁矿负载1%Au表明,所有的铁的氧化物具有高的OH浓度,可以与Au化合物交换。在裸露的氧化铝和FeAl中,HAuCl4的浓度应该增加来得到与赤铁矿相应的Au负载量。这一现象表明尽管有大的表面积,这些载体中一小部分的OH具有活性来与Au化合物稳定。
3.2 表征
Au在不同催化剂中平均粒子直径用TEM测试,如表3。
图6. Au/GDAE的TEM图
Au晶体的最大尺寸在针铁矿载体中,平均粒子直径为15nm。如图6,可以观察到大的Au颗粒。尺寸为9.1nm的粒子箭头所示;可以观察到粒子的球形形态,表明载体-金属间低的相互作用。
对于Au/Al,由于载体和金属离子间低对比度,没有用TEM测试Au粒子尺寸。XRD数据表明Au晶体尺寸在4nm以下[48]。
图7. Au/HDAE的TEM图
用DAE法制备的赤铁矿样品平均尺寸为6.7nm。如图7。由赤铁矿制备的其
他催化剂Au/DP的平均尺寸为8.7nm。
通过DAE法将Au负载到氧化铁载体上取决于Au的本质。在针铁矿中,小尺寸Au晶体由于这种氢氧化物高的IEP而不能成功负载。氧化物的IEP应接近6-7来得到小的Au晶体[47,49]。赤铁矿比相应的针铁矿的IEP低。所以负载在赤铁矿上的Au粒子尺寸明显比针铁矿的小。铁负载在γ-Al2O3(FeAl系列)的IEP 值在两种氧化物之间。所以FeAl上的Au晶体尺寸比裸露的赤铁矿和针铁矿要低。
图8. Au/5FeAl的(a)Fe K-, (b) Au L M边XANES图
图8证实了Fe在催化剂中三价态存在,而Au负载在FeAl以金属价态存在。
Hutching对于Au/Fe2O3进行大量的表征[50]。认为在5% Au/Fe2O3中,Au以阳离子存在。其他研究也测试出相同的结果[51]。我们从XANES得到的结果与其他人并不一致。由于样品热处理大大影响Au在氧化铁上的性质[50],不同的煅烧预处理温度造成这种结果。
在载体和Au催化剂上进行的TPR测试,说明引入贵金属后还原能力的变化。
图9. 载体和Au催化剂的TPR图(a)α-Fe2O3; (b) α-FeOOH; (c)Au/G; (d)Au/HDAE;
(e)Au/HDP; (f)Fe5Al; (g)Au/Fe5Al
对于裸露的载体,赤铁矿和针铁矿(图9,a和b),观察到相似的图形。在450℃出现尖峰。并检测到了第二个消耗峰(在实验条件下未完全的观察到)。H2第一个峰消耗量如表3。可以计算出,第一个消耗量是Fe2O3还原为Fe3O4。第二个消耗量是Fe3O4还原到FeO。
5FeAl的TPR测量如图9,曲线f。观察到低温下280℃的肩峰。Fe的还原比相应的赤铁矿温度更低,是由于氧化铁负载在氧化铝上降低了还原能力。然而,H2的消耗量与赤铁矿相似(表3)。10FeAl和20FeAl和5FeAl有相同的趋势。
将Au引入赤铁矿和针铁矿载体后,相应的TPR曲线发生变化。赤铁矿和针铁矿前一个450℃的峰移动到更低的温度。此外,在Au/HDP和Au/HDAE中观察到在300℃以下有更大的H2消耗量。在针铁矿中,观察到400℃的峰。TPR中观察到相应的峰为赤铁矿还原为磁铁矿。因此,Au元素没有参与还原过程。
对于Au/5FeAl,消耗峰移动到更低的温度100℃。Fe元素的在更低温度下就被还原。由于没有Au阳离子存在,Au元素对于这个低温还原过程没有贡献。尽管Fe负载在氧化铝上的高还原能力,H2参与还原的数量与在赤铁矿中观察到的类似。Au/10FeAl和Au/20FeAl有相似的结果。
根据TPR结果,由于Fe元素在温度低于450℃的还原,针铁矿、赤铁矿和铁负载在氧化铝上被认为是可还原的氧化物。由于Au纳米粒子的存在,它们的还原能力提高。由于贵金属的存在,载体的还原温度的降低,也在其他不同氧化物负载Au中观察到:CeO2[52],赤铁矿[38,53,54]和针铁矿[53]。在Au表面发生的氢的解离[51,55],是还原能力增加的原因。
此外,也观察到Au粒子尺寸对于载体还原能力的影响。粒子尺寸小,Fe 的还原能力增加。观察到,最小的Au晶体在5FeAl上,它的还原在最低温度(100℃)下就开始。另一方面,针铁矿具有最大的Au粒子尺寸,它的还原温度最高。这一结果与随着粒子尺寸减小到1-10nm,顶点、棱长、Au表面缺陷数量的增加的一致[56]。因此,可以得出结论,氢的还原能力在具有最小颗粒尺寸的Au/5FeAl最高。
3.3 丁烯醛和肉桂醛的氢化
图10. Au/Al(?).Au/Fe10Al(◆).Au/G(*)和Au/HDAE(■)催化丁烯醛的转化率(—)和选择性(---)
图11. Au/Al(?).Au/Fe10Al(◆)和Au/HDAE(■)催化肉桂醛的转化率(—)和选择性(---)
在每种催化剂下的反应过程如图10,图11。
表4. 反应3h的Au负载催化剂催化丁烯醛和肉桂醛性能
为得到催化剂在反应3h内的活性,研究了每摩尔醛(丁烯醛和肉桂醛)在每克Au下每秒的转化率。产物的选择性如表4。
在丁烯醛的氢化过程中,没有其他的产物非氢化产物产生。相对于肉桂醛,观察到了苯乙烯,表明这种醛发生了脱羰作用。对于催化剂的效能,这种产物在表4和图11中没有被计算在内。
丁烯醛在反应3h时Au/Al催化的转化率为30%,对于丁烯醇的选择性为18%。在图10中,可以看出希望的选择性随着时间而下降。是由于产物丁醇的增加。在肉桂醛的氢化中,选择性比丁烯醛要高。这是由于双键的位阻保护作用。在Au/Al中,Au纳米粒子负载在惰性的载体上。因此,选择性主要是由Au的内在的催化性能决定,与载体无关。
Au/HDAE的转化水平比相应的Au/Al要高(图10,图11)。在Au/HDP也观察到相同的趋势。此外,负载在α-Fe2O3、Au/HDP、Au/HDAE的催化活性,比负载在氧化铝的样品要稍高一些。这是由于负载在前者载体的Au粒子尺寸比较大。因此,可以认为氧化铁增加了Au的内在活性。
图10中观察到,Au负载在α-Fe2O3的对于丁烯醇的选择性比Au/Al要高。肉桂醛中也观察到相同的趋势(图11,表4)。这是由于氧化铁对于Au的促进作用,增加了C=O的氢化而抑制C=C。
Au/HDAE和Au/HDP作对比,催化选择性几乎没有不同,而Au粒子的平
均尺寸不同。可以得出,负载在赤铁矿上的Au粒子尺寸对于催化性能没有影响。Bus提出这些样品和Au/Al2O3具有不同的催化行为,观察到粒子尺寸对选择性有影响[45]。这一现象是由于相对于C=C键,C=O键氢化速率强烈依赖于团聚体的尺寸,但Au粒子(1nm)的尺寸比这些负载在赤铁矿上的粒子(7.7,5.7nm)更小。
对于Au/G,在3h反应时间下,丁烯醇和肉桂醛的选择性为15%和23%。都没有负载在惰性的氧化铝上高。为了对比在相同转化水平下的选择性,另一个附加实验在6h下进行。在这个反应时间下,转化率为29%,丁烯醇的选择性与Au/Al相似,表明了当针铁矿作为载体时,Fe没有促进作用。可能是大的粒子尺寸使得载体和Au低的相互作用,是Au/G低选择性的原因。
Au/FeAl系列的选择性和活性比Au/Al要高(表4)。再一次观察到Fe对于Au的有利影响。值得注意的是,根据XANES结果,在Au/5FeAl中,只存在金属的Au,Au0是这个样品的活性和高选择性的原因。在我们先前的工作中,Au/CeO2催化丁烯醛氢化中[40],XPS测试表明只有金属Au存在与高选择性的催化剂中。
观察到Au/20FeAl的粒子尺寸与Au/HDAE相似,但是选择性却完全不同。此外,根据TPR结果,Au/FeAl的还原能力比Au/H高很多。在Au/FeAl中Fe2+的存在,使Fe负载在氧化铝的还原温度为100℃(图9)。因此,负载在赤铁矿上的高选择性与负载在Fe/Al的相违背,这与载体的还原能力无关。
氢化反应是结构敏感型,在Au/Mg(OH)2上的CO氧化[57]、在Au/TiO2和Au/ZrO2上丙烯醛的氢化[44]。很多因素影响C=O的选择性,例如(111)晶面密堆积结构[58,59]和表面活性位点[42,60]。
4. 结论
1、Au负载在氧化铁上比负载在其他惰性氧化物上,对于氢化反应具有更高的选择性。
2、Au负载在氧化铁上的高选择性与载体的还原能力无关。
3、Au粒子的尺寸对于C=O键的选择性没有很大影响。
4、Au粒子的形态影响选择性。
三、负载金催化剂对于4-硝基苯甲醛的气相加氢的选择性[61]
胺和醇可以通过硝基化合物和醛催化加氢得到[62,63]。在存在其他活性官能团(例如,C≡N,C=C,COOH)时,选择性对于-NO2和C=O的靶向还原还是个挑战[64,65]。在这里,我们研究了4-硝基苯甲醛选择性加氢的可行性。-NO2比C=O 的还原所需条件更加温和,所以更倾向生成胺[66]。4-硝基苯甲醛转化路径如图12。4-氨基苯甲醛(步骤Ⅰ)和4-硝基苯甲醇(步骤Ⅱ)是商用的重要化合物[67,68]。这个反应在液相中(P=1-50bar,T=303-423K)通过可溶性金属(Pd[69,70],Ru[67]和Co[71])化合物和固体过渡金属(Au,Ru,Ni,Pd,Pt[65,67,68,72-74]和PtO2-H2O[75])
化合物催化剂进行了研究。在气相应用中,只有对于3-硝基苯甲醛在MgO上进行了研究[76]。在PtO2-H2O[75]、溶胶-凝胶包裹Pd[77]、MgO[76]和Ru/Al2O3[67]中,硝基和羰基官能团的还原都会生成4-氨基苯甲醇(步骤Ⅲ和Ⅳ)。此外,由于直接攻击C=O(步骤Ⅴ)或4-硝基苯甲醇的进一步转化(步骤Ⅵ),在Au/Fe2O3和Fe(OH)x中[72],会生成4-硝基甲苯。4-氨基甲苯可以通过步骤Ⅶ、Ⅷ、Ⅸ生成。可以确定的是[65,68,70,75],随着有毒的氧化偶氮化合物的生成,4-氨基苯甲醛和4-氨基苯甲醇在加氢时会发生聚合。后者在传统的反应堆中,随着更长的接触时间更容易发生[70],而这在连续操作中应该避免。文献中,4-氨基苯甲醛是在选择性上升到99%的主要产物[65,68,69,71,72]。在涉及Ru化合物催化剂时,4-硝基苯甲醇是主要产物[67]。
图12. 4-硝基苯甲醛的加氢路径
至今的研究都关注于液相反应过程,提高均相催化剂的选择性需要碱(KOH)[69,71]的加入,并且在逆流的条件下操作[71]。转变到多相催化提供了有利的条件,产物/催化剂分离,当有利于连续生产高产量的规模经济效益。Au催化剂应用于4-硝基苯甲醛转化为4-氨基苯甲醛的液相过程中是很有前景的,尽管观察到了聚合[65,68,73]。在存在其他活性官能团,例如C≡N[78],C=C[68],Br[79],Cl[80],负载Au对于-NO2还原为-NH2具有化学选择性。Bailie和Hutchings[81]认为C=O在Au/ZrO2上具有活性,导致生成醇的选择性提高。我们用Au/ZrO2作为出发点,研究了载体和Au尺寸对于4-硝基苯甲醛氢化活性和选择性的作用,并且考虑温度的影响。
2. 实验
2.1 催化剂制备
ZrO2通过ZrOCl2?8H2O和35%NH3沉淀法进行制备。ZrOCl2溶液(0.1M)
在搅拌下滴加入氨水溶液(2.5M)。生成的水凝胶用蒸馏水洗涤直到不存在Cl,373K下干燥24h,在空气(20cm3min-1g-1)中,1K min-1升温至673K焙烧5h。Au(1% w/w)负载在ZrO2、TiO2和Al2O2上,通过沉积-沉淀法制备。HAuCl4(173mg)的悬浮液(300cm3),尿素水溶液(100cm3,2.8mol dm-3)和载体(5g),在搅拌下(300rpm)加热到353K(1K min-2),保持约200min。合成过程应在暗处进行,以避免Au(Ⅲ)的光还原在溶液中形成金属溶胶[82]。由于高残留Cl 含量(>300ppm),形成了较大(>20nm)的Au颗粒[83]并使催化剂活性位点中毒[84],将催化剂前体重复洗涤。通过DP法制备的Au负载在氧化铝上为Au-Al
O3-1。
2
氧化铝负载Au也用浸渍法来制备,氧化铝浸渍在HAuCl4溶液(7.3*10-3M,39cm3),悬浮液2K min-1加热到353K,在He气流下摇动(600rpm);命名为Au-Al2O3-2。催化剂前体在383K的He(10cm3 min-1 g-1)干燥3h,通过平均直径为75μm的筛子。样品放置在He中,277K,暗处,防止Au的凝聚[85]。
3. 结果与讨论
由于Au/ZrO2,Au/TiO2作催化剂时,反应选择性生成4-氨基苯甲醛,这里不作讨论。
3.1 Au/Al2O3表征
表5. 每种催化剂的结构特征
BET比表面和孔体积如表5,与以前的报道一致[79,86]。通过DP法制备的催化剂(Au/Al2O3-1,如图13a)的TPR与Au/ZrO2具有相同的T max峰,H2消耗量与前体还原至零价的Au一致。氢的解吸超过Au/ZrO2和Au/TiO2是由于Al2O3的氢溢流现象[87]。XRD的五个信号在2θ=32-67°(图13b)对应立方γ-Al2O3的(220),(311),(222),(400)和(440)晶面。没有检测到Au的信号表明Au的高分散,由TEM分析证实(图13c)。孤立的Au原子的衍射图如图13d,面间距d=0.23对应金属Au的(111)晶面。Au粒子尺寸分布图(图13e)表明平均直径(=4.3nm)与Au/TiO2接近。用浸渍法得到的相同负载量的Au/Al2O3-2具有较大的平均尺寸(7.8nm,表5)。通过浸渍法合成的催化剂前躯体和载体间相互作用弱,导致生成较大的Au粒子[88,89]。
图13. (a)Au/Al2O3-1的TPR图; (b)XRD图。▲标识Al2O3; (c)和(d)孤立的Au原子衍射图;
(e)Au粒子尺寸分布图
3.2 Au/Al2O3催化性能
表6. 四种催化剂的反应速率常数、TOF、选择性
图14. (a)Au/Al2O2催化(▲)4-氨基苯甲醛和(△)4-硝基苯甲醇选择性和转化率;(b) (▲)4-氨基苯甲醛和(△)4-硝基苯甲醇的产率时间函数;(c)动力学曲线
与Au/ZrO2,Au/TiO2相反,4-硝基苯甲醛在Au/Al2O3-1作催化剂时,除了4-氨基苯甲醛为主产物,还生成了4-硝基苯甲醇(表6)。Liu[72]报道了4-硝基苯甲醛中的C=O基团可以通过Au负载Fe2O3被活化,但是也生成了4-硝基甲苯和4-氨基甲苯。还有一种方法是使用CH2CH2CH2Net3+官能化MCM-41-负载[H3Ru(CO)12]-,在液相中(P H2=50bar)操作[67]。如图14a,选择性和转化率无关。选择性生成醇是取决于Al2O3的贡献。我们以前报道了通过Au/Al2O3将苯甲醛转化为苯甲醇[90]。羰基的还原是通过亲核机理[91],C=O极化使得氧原子易于攻击氢,转化生成醇[92]。苯甲醛与载体的相互作用可以是离子型(Mn3O4)或共价型(Al2O3),后者形成表面苯酸盐,为形成醇的中间体。FTIR测试表明,苯酸盐源于苯甲醛在Al3+位点的吸附[93]。Lewis酸度是个重要因素,通过用吡啶作为探针进行FTIR分析[94]。当吡啶与金属氧化物位点成键,环呼吸振动频率(vCCN)增加。硝基孤对电子和氧化物Lewis酸位点的相互作用,为在1600-1633cm-1和1445-1460cm-1的v8a和v19b,而更高的v8a频率对应更强的酸性[94]。vCCN如图15,波位置和酸位浓度如表7。
图15. (a)Al2O3; (b)Au/Al2O3-1; (c) Au/Al2O3-2; (d)ZrO2; (e)Au/ZrO2; (f)TiO2; (g)Au/TiO2的吡啶
吸附FTIR光谱图
表7. 不同催化剂的v8a和酸位浓度
ZrO2和TiO2载体峰在1608cm-1,表明相当于Lewis酸强度。相对来说,Al2O3主要峰在1617cm-1和更高频率(1623cm-1)的肩峰,分别是对称的八面体和四面体Al3+位点[94]。Al2O3更高v8a频率的出现表明Lewis酸度比ZrO2和TiO2更强,这是由于Al离子半径小[95]。酸位浓度的增加为:TiO2> ZrO2> Al2O3。在氧化物载体的酸位数量取决于合成方法。Au的引入不影响酸强度或浓度。Au/Al2O3-1催化中,强的表面Lewis酸度形成表面苯酸盐,通过Au位点提供的氢来还原。Au/Al2O3-1下的产率如图14b。4-氨基苯甲醛的产率随着时间下降,而4-硝基苯甲醛的产率上升而达到稳定。4-硝基苯甲醛的消耗与TOF(表6)线性相关(图14c),与Au/TiO2相似,明显的比Au/ZrO2高。这种反应与活性依赖于Au粒子尺寸一致,小的Au粒子(<5nm)具有更高的活性。反应温度(423-473K)对于活性/选择性如图16。Au/TiO2选择性生成4-氨基苯甲醛随着温度的增加不变。相反,Au/Al2O3-1在低温下利与生成4-硝基苯甲醇。
图16. (a)Au/TiO2; (b)Au/Al2O3-1催化的反应速率常数和选择性423-473K下4-硝基苯甲醛在Au/Al2O3-2的氢化如图17a。相比于Au/Al2O3-1,Au/Al2O3-2对于生成4-硝基苯甲醇有100%的选择性。醇的产率一开始下降直到7h保持稳定(图17b)。在FTIR测试中(图15),Au/Al2O3-2的Lewis酸强度与Au/Al2O3-1相等。在Au/Al2O3-2中酸位数量的增加(表7)是由于残留的Cl[96],这是浸渍法用HAuCl4作为前体,而与DP法不同[97]。Au/Al2O3-2只生成4-硝基苯甲醇是由于表面酸性导致苯甲酸的行成以及大尺寸的Au。在丙烯醛的氢化中[98,99],随着Au尺寸的增加(4-8nm),生成丙烯醇的选择性增加。随着Au分散度的降低,低配位Au位点数量的减小[100],限制了-NO2的还原。与在Au/Al2O3-1中一样,在Au/Al2O3-2中,随着温度的增加,更有利于生成氨基苯甲醛(图17a)。Au/Al2O3-2中大尺寸的Au比Au/Al2O3-1明显的TOF下降(表6)。Au/Al2O3-2和Au/ZrO2反应选择性的测试,它们具有相似的Au尺寸但表面酸度不同。苯甲醛和硝基苯的氢化生成苯甲醇和苯胺,是唯一的产物。反应为放热反应,ΔH443K=-67kJ mol-1(苯甲醛)和-469kJ mol-1(硝基苯),硝基苯转化成苯胺(ΔG443K=-442kJ mol-1)比硝基苯转化成苯甲醇(ΔG443K=-18kJ mol-1)在热动力学更有利。
图17. (a) Au/Al2O3-2催化的速率常数和选择性; (b)4-硝基苯甲醇产率时间函数
在Au/Al2O3-2中选择性生成4-硝基苯甲醇,符合苯甲醇比苯胺更高的生成速率(表4)。这是由于Lewis酸性活化了C=O。
表8. Au/ZrO2和Au/Al2O3-2对于4-硝基苯甲醛、苯甲醛和硝基苯的速率常数
4. 结论
我们研究了气相Au催化氢化4-硝基苯甲醛,Au粒子尺寸、载体性能和Lewis 酸度的影响。在Au/ZrO2,Au/TiO2作催化剂时,反应选择性生成4-氨基苯甲醛,。而在Au/Al2O3中,由于表面的Lewis酸度,会选择性生成4-硝基苯甲醇,这种情况下有利于生成中间体苯酸盐并被还原成醇。随着Au平均尺寸的增加,酸位数量的增加和温度的降低,生成醇的选择性会增加。
四、以CeO2-ZrO2负载Pt作催化剂,肉桂醛的分子内选择性加氢[101]
CeO2是可还原的氧化物。它促进Pt的分散并且提供良好的载体-金属相互作用。CeO2-ZrO2固态溶液具有热稳定性并且阻止负载金属的烧结。ZrO2的存在提高了CeO2的储存氧的能力。CeO2-ZrO2所有的这些优越的特征在加氢反应中有更高的活性和选择性。在这里,我们发现载体、金属的电子结构和碱性离子的加入可以影响转化率和选择性。肉桂醇是主要产物。其他的Pt催化的结果作了对比[102]。活性/选择性的不同是由于催化剂电子和还原性能不同。
2.实验
2.1.1 CeO2-ZrO2
CeO2-ZrO2化合物(Ce/Zr=1:1)通过共沉淀法制备[103]。Ce(NO3)3?6H2O(7.35g)和ZrO(NO3)2?xH2O(2.8g)分别溶解在蒸馏水中(168、120ml)。在2L圆底烧瓶中,溶液混合并且搅拌滴加0.1M(1L)NaOH溶液,放置在油浴中。搅拌持
醛和酮 亲核加成反应附加答案
醛和酮 亲核加成反应 一、基本要求 1.掌握醛酮的命名、结构、性质;醛酮的鉴别反应;不饱和醛酮的性质 2.熟悉亲核加成反应历程及其反应活性规律;醛酮的制备 二、知识要点 (一)醛酮的分类和命名 (二)醛酮的结构: 醛酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。 C=O 双键中氧原子的电负性比碳原子大,所以π电子云的分布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳原子上带部分正电荷。 (三)醛酮的化学性质 醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。氧原子可以形成比较稳定的氧负离子,它较带正电荷的碳原子要稳定得多,因此反应中心是羰基中带正电荷的碳。所以羰基易与亲核试剂进行加成反应(亲核加成反应)。 此外,受羰基的影响,与羰基直接相连的α-碳原子上的氢原子(α-H )较活泼,能发生一系列反应。 亲核加成反应和α-H 的反应是醛、酮的两类主要化学性质。 1.羰基上的亲核加成反应 醛,酮亲核加成反应的影响因素:羰基碳上正电性的多少有关,羰基碳上所连的烃基结构有关,亲核试剂的亲核性大小有关。 (1)与含碳的亲核试剂的加成 ○ 1氰氢酸: ○2 炔化物 C O C O H C H O 121.8116.5。。sp 2 杂化键 键近平面三角形结构πσC C R O H H ( )δδ 酸和亲电试剂进攻富电子的氧碱和亲核试剂进攻缺电子的碳 涉及醛的反应 氧化反应( ) αH 的反应羟醛缩合反应卤代反应C O C OH + HCN CN 羟基睛 α
○3 有机金属化合物: (2)与含氮的亲核试剂的加成 ○ 11o 胺 ○ 2 2o 胺 ○ 3氨的多种衍生物: (3)与含硫的亲核试剂的加成-------亚硫酸氢钠 产物α-羟基磺酸盐为白色结晶,不溶于饱和的亚硫酸氢钠溶液中,容易分离出来;与酸或碱共热,又可得原来的醛、酮。故此反应可用以提纯醛、酮。 反应范围: 醛、甲基酮、八元环以下的脂环酮。 反应的应用:鉴别化合物,分离和提纯醛、酮。 (4)与含氧的亲核试剂的加成 ○1水 ○ 2醇 醛较易形成缩醛,酮在一般条件下形成缩酮较困难,用12二醇或13-二醇则易生成缩酮。有机合成中用来保护羰基。 2.α-H 的反应(羟醛缩合、交叉缩合、卤仿反应) 醛、酮分子中由于羰基的影响,α-H 变得活泼,具有酸性,所以带有α-H 的醛、酮具有如下的性质: (1)羟醛缩合 有α-H 的醛在稀碱(10%NaOH )溶液中能和另一分子醛相互作用,生成β-羟基醛 ,故称为羟醛缩合反应。 (2)交叉缩合 C O δδ+ R MgX δδC OMgX R H 2O R C OH +HOMgX 无水乙醚C O NaO-S-OH C OH SO 3Na C ONa SO 3H +O 醇钠 强酸强酸盐 白( )R C H ( R' )R C OH H O ( R' ) O +R'' R''OH R C O H O ( R' ) R''OH R''R'' HCl HCl 无水干+H 2O 半缩醛 酮不稳定 一般不能分离出来缩醛 酮 ,双醚结构。 对碱、氧化剂、还原剂稳定,可分离出来。酸性条件下易水解 ( ) ( )NH 2-OH NH 2-NH 2NH 2-NH NH 2-NH-C-NH 2O NH 2-NH O 2N NO 2羟氨 肼苯肼二硝基苯肼氨基脲2,4
醛和酮的氧化反应与还原反应的教学设计
《醛和酮的氧化反应与还原反应》的教学设计 戴福枢 2007.6 [教学目标]: 1、知识与技能:了解醛和酮的结构特点, 掌握醛的氧化反应和还原反应 学会醛与常见弱氧化剂反应的实验操作技能。 2、过程与方法:通过设计实验方案培养学生比较、分析、推理的逻辑思维能力。 通过设计与实验相结合的方法培养学生研究物质性质的科学探究方 法和严谨的治学态度。 3、情感态度与价值观:课的导入以镜子的自省作用开头,以青少年为什么不能酗酒结尾, 注意对学生进行人生观以用良好行为的养成教育。 [教学重点]: 醛的强还原性;醛酮鉴别实验方案的设计 [教学难点]: 醛的强还原性——银镜反应;醛酮鉴别实验方案设计中的思维探究 [教学方式]: 思维引导与活动探究相结合 [创设情境]→[思维引导]→[探究讨论]→[实验验证] →[归纳小结] [教学用具]: 自拍演示实验短片,学生分组实验,多媒体课件
[教学设计思想]: 本节课的重点在于醛的氧化反应和醛与酮的鉴别,新教材除了强调原有教材中要求掌握醛的强还原性外,新增了“活动探究——醛和酮的鉴别”,这不再是让学生简单的重复经典实验,而是意在培养学生的思维能力,怎样才能通过设计实验方案既不使探究流于形式又能符合我们学生现有的认知水平? 通过几个关键环节的导引设计,思维培养与实验探究并用,借助综合已学知识的支持,不但培养了学生设计实验动手实践的能力,更重要的是培养了学生知识迁移和理论分析的能力,使学生的思维得到了培养,如何整合所学,应用所学去分析问题和解决问题作为这节课培养目标中的另一个重点。 另外,通过发现自然科学在生活当中的重要应用,对学生进行情感教育的渗透也是本节课的另一个设计要素。 [教学设计]: 通过古语“以铜为镜可以正衣冠,以史为镜可以见兴衰,以人为镜可以知得失”这句话和学生主动上台讲述的一段关于镜子的发展史引出本节课的重点内容——银镜反应。不仅激发了学生兴趣,导入了主题(银镜反应),而且渗透了情感教育。 1、醛和酮的氧化反应 展示预先做好的银镜,并播放自拍的银镜反应的演示实验短片。 学生对银镜反应非常陌生,直接介绍操作步骤比较抽象与枯燥,通过自拍短片这种形式先引起学生的观看兴趣,还能保证每个同学都能看清实验现象,再通过短片的观看与操作步骤中关键点的强调,让学生思维顺畅起来,先得到感性上的认识。 请学生复述银镜反应的实验操作步骤,完成“活动探究表”中相关内容的填写,使学生对整个实验过程实现由感性到理性的升华。 并通过进一步的追问“你将如何确保实验成功?”,引发学生思考,引起学生对关键点的重视,介绍该反应中需要注意的六点问题。 [过渡]:明确了实验操作步骤,具体发生了怎样的反应? 此处通过一系列形成一定梯度的问题,步步深入,引导学生认识醛与弱氧化剂的反应,醛表现了还原性 [问题1]:光亮的金属银由哪种反应物得来?
(完整word版)醛和酮
第十一章醛和酮 课时:8课时 教学目的要求:掌握醛酮与亲核试剂的加成反应及其历程,醛酮的氧化-还原反应,各类醛酮的鉴别,醛酮制法,α,β-不饱和醛酮的性质。 含羰基。 第一节醛、酮的分类,同分异构和命名 一、分类 烃基的类别:脂肪族醛、酮;芳香族醛、酮。 羰基的数目:一元醛、酮;二元醛、酮。 二、同分异构现象 醛:碳链异构。 酮:碳链异构和羰基位置异构。 三、命名 1 系统命名法 选择含羰基的最长链。 编号从靠近羰基的一端开始。 CH3CHCHO CH3C6H5CHCHO CH3 HC CCH2CH2CHCH2CHO CH3 2-甲丙醛2-苯丙醛3-甲基-6-庚炔醛 CH3CO(CH2)3CH3 COCH3COCH2CH3 2-己酮1-苯-1-乙酮1-环己基-1-丙酮 碳原子的位置有时也用希腊字母表示: 2酮的取代基命名法 CH3CCH2CH3 O COCH3 甲基乙基酮甲基苯基酮 CHO OH CHO CHO 3-羟基苯甲醛1,2-萘二甲醛 111
CHO 2COOH CHO O 4-甲酰苯基乙酸2,3-环氧苯甲醛 COCH2CH2CH3CH 2COCH3 1-( -萘基)-1-丁酮1-苯基-2-丙酮 萘基丙基酮苄基甲基酮 第二节醛、酮的结构、物理性质和光谱性质 一、醛和酮的结构 羰基碳原子sp2杂化。氧原子上带部分负电荷,碳原子上带部分正电荷。羰基是极化的,分子有偶极矩。 二、物理性质 沸点比相应的烷烃和醚高(极化度大),低于相应的醇(不能形成分子间氢键)。低级的醛、酮可溶于水(与水形成氢键),中级醛(九到十个碳)具果香味液体,用于香料工业,低级酮是液体,具有令人愉快的气味。 三、光谱性质 红外光谱:碳氧双键的伸缩振动,醛在1730cm-1, 酮在1715cm-1, 形成共轭体系时,吸收的波数减小。醛在2750cm-1处有醛氢与羰基碳之间的碳氢伸缩振动峰。 核磁共振谱:醛氢的化学位移为9-10, 与羰基相连的甲基或亚甲基的化学位移在2-2.5, 紫外光谱:非共轭醛、酮在200 nm以上无强烈吸收,共轭的醛、酮则有强烈吸收。 乙醛和苯乙酮的IR图见P316图11-2,NMR图见P317图11-3 问题:用光谱法区别下列各组化合物: (1)CH3CHO, CH3COCH2CH3 (2)CH3CH2CH2COCH3, CH3CH2CH=CHCOCH3 112
醛和酮的氧化和还原(A)
教学目标:1.熟悉芳醛和脂肪醛氧化反应的异同和羰基的还原方法。 2.掌握醛的化学鉴别方法。 3.了解酮的H2O2氧化制备酯及α-羟基酮特殊氧化。 4.掌握cannizaro反应的原理。 教学重点: 1.醛的氧化。 2.羰基的负氢还原和彻底还原。 教学安排:J >J9;30min 1— 一、醛的氧化 1.空气氧化 醛容易被氧化为羧酸。所以,久置的醛在使用前应重新蒸馏。这反映出醛基的不稳定性和化学活泼性。 在空气中,醛可被O2按自由基反应机理氧化成酸,芳醛较脂肪醛易被氧化;因为芳醛的羰基较易形成自由基。 2.氧化剂氧化 醛可被多种氧化剂氧化成羧酸。如HNO3、KmnO4、Ma2Cr2O7、CrO3、H2O2、H2O2、Br2、NaOX、活性Ag2O、新生MnO2等等。一般属离子型氧化反应,脂肪族醛易于被氧化。 较弱的氧化剂,如氢氧化银的氨溶液(称Tollens试剂)可将芳醛或脂肪醛氧化成相应的羧酸,析出的还原性银可附在清洁的器壁上呈现光亮的银镜,常称"银镜反应",可用这个反应来鉴别醛,工业上用此反应原理来制镜。 裴林试剂是硫酸铜与酒石酸钾钠的碱性混合液,二价的铜离子具有较弱的氧化性,它可氧化脂肪醛为脂肪酸,而芳香醛一般不被氧化。在反应中析出的砖红色氧化亚铜,现象明显,可用于脂肪醛的鉴别: 氧化银是一个温和的氧化剂,它可把醛氧化成酸,但不氧化C=C、-OH、C=N等官能团。例如: 二、酮的氧化 与醛相比,酮不容易被氧化;强烈的氧化条件下,酮被氧化成小分子的羧酸,这是没有制备意义的。 环酮氧化可生成二元酸,有应用价值。在工业上,由苯加氢得到的环已烷经催化空气氧化可以得到环已醇及环已酮,环已酮继续被氧化则得到已二酸,后者是合成纤维尼龙-66的原料。 芳酮比芳醛更难于氧化,在强氧化剂作用下,芳酮在羰基处发生C-C键断裂。如:苯乙酮用冷的KmnO4水溶液氧化时先是生成的苯甲酰甲酸,进一步受热氧化则生成苯甲酸。
选修五 2.3.1 常见的醛、酮(附解析)
第3节 醛和酮 糖类 第1课时 常见的醛、酮 [学习目标定位] 1.熟知醛、酮的分子结构特点,会写简单醛、酮的结构简式。2.知道醛、酮的分类、命名及常见醛、酮的物理性质。 1.写出下列有机物具有的官能团的名称 答案 醛基、羰基、羟基、羧基、碳碳双键 2.写出下列反应的化学方程式 (1)乙醇与浓硫酸共热170 ℃:_________________。 答案 CH 3CH 2OH ――→浓H 2SO 4 170 ℃ CH 2===CH 2↑+H 2O (2)乙醇催化氧化:____________________________。 答案 2CH 3CH 2OH +O 2――→催化剂 △2CH 3CHO +2H 2O (3)乙二醇催化氧化:___________________。 答案 探究点一 醛、酮的结构 1.分子式为C 3H 8O 的有机物,有两种醇类同分异构体,写出它们的结构简式。 (1)写出上述两种醇发生催化氧化反应的化学方程式。 答案 ①2CH 3CH 2CH 2OH +O 2――→△ 催化剂 2CH 3CH 2CHO +2H 2O (2)上述两反应中有机产物分子结构上的相同点是什么?它们有什么共同的性质?
答案都含有碳氧双键,因此它们都能与H2发生加成反应生成醇。 (3)上述两反应中有机产物分子结构上的不同点是什么? 答案产物为醛类,分子中与羰基相连的分别是烃基和氢原子; 产物为酮类,分子中与羰基相连的为两个烃基。 (4)两种有机产物的关系是互为同分异构体。 2.相同碳原子数的醛和酮(碳原子数大于3),因官能团类型不同,互为同分异构体,同时还存在官能团位置异构及碳链异构等同分异构现象。试写出分子式为C5H10O的有机物的同分异构体(只写属于醛类或酮类的)。 (1)属于醛类的: (3)结合醇的系统命名知识对上述醛、酮进行命名。 醛:①戊醛__②3-甲基丁醛__③2-甲基丁醛__④2,2-二甲基丙醛。 酮:①2-戊酮__②3-甲基-2-丁酮__③3-戊酮。 [归纳总结] (1)醛、酮在自然界中存在广泛。醛和酮具有相同的官能团羰基,区别是醛中羰基上连有氢原子,所以醛的官能团为醛基,结构简式写为—CHO而不能写成—COH。相同碳原子数的醛和酮互为同分异构体。 (2)醛、酮命名与醇的命名类似,选主链应选含官能团的最长碳链作主链,编号也是从距官能团最近端开始编号,除写出取代基外,也应写出官能团的位置。 [活学活用] 1.下列说法正确的是() A.醛和酮都含有相同的官能团羰基,因此它们性质相同
醛酮反应机理二
醛酮反应机理二(附答案) 1.酸性条件下手性醛酮的消旋化 R R 12 C R R 1 H R 2 *H + (±)or (+)(-) 2. 酸催化卤代 碱催化卤代 X , X = Cl, Br, I 3. 卤仿反应机理(碱催化卤代) 3 C C X 3 C R C H X 3 C R + OH X = Cl, Br, I
4.羟醛缩合机理 羟醛缩合产物的分解机理(羟醛缩合的逆反应) 5.酸催化下的羟醛缩合机理: CH3CH3 O 2 H3 H3 CH CH3 + 2 Al[O(CH3)3] 3 O O OH O Cl HCl (Lewis 酸催化) 6. Mannich反应(胺甲基化反应) CH 2 R' +CH2O H +CH R' 2N H
1酸催化过氧酸氧化 —— 生成酯 ( Baeyer-Villiger 反应)(“O ”如何插入C -C 键)“O ”插入取代基多的基团一边(取代基多的基团易迁移) R 1 R 2 R 1 R 2R 1 2 2.Wolff-Kishner 还原酮羰基至亚甲基机理 R R' O R CH 2 R'NH -NH , Na N 2 + 3. Meerwein-Ponndorf 还原反应 (i-PrO)Al CH 3CHOHCH 3(过量) O R'(H) R OH R'(H) 4. 醛酮被金属还原至醇或二醇 Na or Li R R'(H) R C OH R' R C OH R' R R' O 2Mg (Hg) 5.Cannizzaro 反应(歧化反应)
R 浓 OH R R CH 2 OH +H + R COOH + R CH Ph H O O OH Ph C O 7. Benzoin 缩合反应(安息香缩合反应) 8.Wittig 反应: Ph 32 +R 2+Ph 32
醛酮化学性质教案
醛酮化学性质教案 【课堂引入】 装修引起的室内污染已经越来越受到人们的重视,其中的一种重要的污染源就是——(学生回答:甲醛);这两幅图片是形像逼真的生物标本,同学们知道它们是浸泡在什么中吗,(学生回答:福尔马林溶液)福尔马林溶液就是——甲醛的水溶液。同学们想知道为什么甲醛具有这样的性质吗,(学生回答:)本节课我们就共同来探讨“醛酮的化学性质”,学习完“醛酮的化学性质”,你就会了解甲醛为什么具有这样的性质。 (板书:二、醛酮的化学性质) 【师】:首先,我们来完成导学案上的“复习回顾”,给同学们1—2分钟的时间,小组内交流你的答案,整理出正确答案。(实物展台:展示2个小组的4题的答案,让其他组的同学找错)。【复习回顾】中的四道题 1、研究有机物化学性质的一般程序是什么, 2、有哪些类别的物质能发生加成反应, 3、醛和酮的结构中含有什么官能团,官能团中的碳原子是否饱和, 4、试着注明以下物质的带“—”C原子的氧化数。 CHCHOH CHCHO CHCOOH 3233 【师】:评价:同学们的掌握情况不错。 【过渡】:下面我们就开始学习“醛酮的化学性质”。 【师】:小组讨论:
要求:每个小组讨论出方案,并作出记录,然后班内交流。 (我的想法:让学生能讨论出两点:?因为存在C=O,所以醛酮能发生加成反应。?因为羰基中C原子的氧化数分别为+1和+2,所以可以发生氧化反应和还原反应) 【师】:总结并展示课件 【师】我们首先来学习第一种反应类型:加成反应。加成反应的原理,我们在第一节已经学习了,下面请同学们用2-3分钟时间把导学案上关于“乙醛和丙酮与一些极性试剂发生加成反应的方程式”交流讨论,并整理出正确答案。 (实物展台:展示2个小组答案,让其他组的同学找错)。 【师】总结,并展示大屏幕:醛酮加成反应的规律动画。 【师】:思考:醛酮与氢气的加成反应还可以归为那种反应类型, (学生回答:还原反应,加氢的反应就是还原反应) 【师】甲醛为什么有毒,实际上就是和蛋白质发生了加成反应,并进一步转化,从而使蛋白质失去了活性,甲醛能防腐也是基于这个原因,有兴趣的同学请课后阅读课本P72页的“身边的化学”。【师】:下面我们接着看醛酮的氧化反应。醛和酮都能发生氧化反应。请同学们思考:醛和酮都能被哪些氧化剂给氧化呢?(学生回答:氧气、酸性高锰酸钾溶液、新制的氢氧化铜悬浊液等。引导学生:我们在第一节氧化反应部分学到常见的氧化剂有哪些,)
高中化学 醛和酮 糖类(第1课时)常见的醛酮 醛酮的化学性质教案 鲁科版
第二章第3节醛和酮糖类 第一课时常见的醛、酮醛酮的化学性质(1) 教材分析: 醛和酮是含有羰基的两类重要化合物,在官能团的转化和有机合成中占有核心地位,是有机合成的“中转站”。学生已对有机物结构与性质的关系有所了解,故要应用结构推测性质的思想方法研究醛和酮的化学性质。本节教材选取的反应依据两个方面:一与生产、生活相关;二与有机化合物的相互转化有关。糖类与生命现象、人类生活相关,而结构与醛、酮相关,故放在本节中介绍,这样可以使学生更深刻地认识糖,也加深对羰基的认识。 学情分析: 学生通过学习,掌握了烃、醇的命名方法,认识到有机化合物结构与性质的密切联系,并初步建立了分类观。第二章第1节引导学生多角度的认识有机化学反应,学生通过自我构建的有机化学理论预测醇可能发生的化学反应类型。常见醛、酮的重要性质及其在生产生活中的广泛应用是本节课学习的基本要点,根据醛、酮的结构准确预测其性质是学生的提高点。 教学目标: 一、知识与能力: 1.了解醛、酮在自然界的存在,能列举几种简单的醛、酮,并能写出其结构简式,了解其在实际生产和生活中的应用。 2.能够用系统命名法对简单的醛、酮命名。 3.了解醛、酮的结构特点,比较官能团的相似和不同,能预测醛、酮可能发生的化学反应。 二、过程与方法: 通过交流研讨,培养比较、分析、演绎等思维能力及参与交流研讨活动的能力。 三、情感、态度与价值观: 了解醛、酮对环境和健康可能产生的影响,增强环境意识,关注有机物的安全使用。 重点难点: 重点:醛、酮在生产、生活的应用; 难点:醛、酮的物理性质及其结构特点。 教学方法:合作探究,讲练结合,训练建构 教学手段:多媒体课件辅助教学 设计思路: 【教学过程】
2.3.1 常见的醛和酮 学案(含答案)
2.3.1 常见的醛和酮学案(含答案) 第第3节节醛和酮醛和酮糖类糖类 第第1课时课时常见的醛和酮常见的醛和酮核心素养发展目标 1.宏观辨识与微观探析,通过醛基.酮羰基的官能团的不同,知道醛和酮结构的差异.命名,理解醛.酮的物理性质。 2.科学态度与社会责任了解甲醛对环境和健康的影响,知道常见醛.酮的物理性质,关注有机化合物安全使用的问题。 一.醛.酮的结构和命名1醛.酮的组成与结构醛酮结构特点羰基碳原子分别与氢原子和烃基或氢原子相连羰基的碳原子与两个烃基相连官能团名称醛基酮羰基官能团结构简式或CHO组成通式饱和一元醛CnH2nOn1饱和一元酮CnH2nOn3 2.醛.酮的命名1系统命名选主链选含醛基或羰基且最长的碳链做主链。 编位号从靠近醛基或羰基的一端开始编号_________。 写名称醛基碳是一号碳,支链以取代基的形式标明,位号写在名称前面。酮分子中的羰基碳必须标明其位号。 例如命名为3-甲基丁醛。 命名为2-戊酮。 2习惯命名命名为甲醛,命名为苯甲醛。
3醛.酮的同分异构体1官能团类型异构饱和一元醛.酮的通式都是CnH2nO,即含相同数目碳原子的饱和一元醛与饱和一元酮互为同分异构体,如CH3CH2CHO和。 饱和一元醛和等碳原子数的一元烯醇互为同分异构体,如 CH3CH2CHO和烯醇CH2CHCH2OH羟基不能连接碳碳双键。 饱和一元醛还与同碳数环状化合物互为同分异构体,如 CH3CH2CHO与.和。 2官能团位置异构醛基一定在1号位上,故醛不存在此类异构。 酮存在官能团位置异构,如与。 3碳骨架异构分子中碳原子数较多时,醛和酮均存在碳骨架异构,如CH3CH2CH2CHO和。 甲醛结构的特殊性1甲醛分子中连接两个氢原子,没有烃基,结构式为,1molHCHO相当于含2molCHO。 2由于羰基中的碳原子与氧原子之间以双键连接,所以甲醛分子中所有原子共面。 例1下列关于醛的说法正确的是A甲醛是甲基跟醛基相连而构成的醛B醛的官能团是COHC饱和一元醛的分子式符合CnH2nO 的通式D甲醛.乙醛.丙醛均无同分异构体 【考点】 醛的组成与结构 【题点】
第十三章不饱和醛酮及取代醛酮
第十三章 不饱和醛酮及取代醛酮 (Unsaturated Aldehydes and Ketones) (Substituted Aldehydes and Ketones) 一 α, β– 不饱和醛酮 (α,β- Unsaturated Aldehydes 、Ketones) 分类: 双键与羰基共轭 α,β—不饱和醛酮 双键与羰基相隔较远 n 双键与羰基相连烯 酮 C C C O C C C C O n ≥1 C C C O 制备: CH 3CHO CH 3CHO 32CH 3CH CHCHO -H 2O △+取代醛 α,β—不饱和醛OH OH O CH CHC CHO O C CH 3 + α,β— 不饱和酮 OH 反应: C C 1.CH CH C O 2. 亲电加成 共轭加成 (1, 4–加成) 2 1 3 4 1 加HCN CH CH C δ δ δδO α,β-不饱和酮主要发生1 , 4-加成 α,β-不饱和醛发生1 , 2 -加成 R , CH CH C O R HCN R , C O RCH CH H , RCH
例: HX R , C O RCH CH X R , CH CH C O R R H(R ,) CH CH C O H 2NOH 3 H(R , ) CH CH C O R H(R ,) CH CH C O R N H R H(R ,) CH CH 2C O NHOH R H(R ,) CH CH 2C O SO 3Na R H(R ,) CH CH 2C O N 例: O C 6H 5CH CHC 25C 6H 5 C O CN CH 2C 6H 5CH 93~96% C 6H 5 KCN , CH 3COOH 例: O HCN (C H )Al O + 85% 2 加RMgX 格氏试剂与α, β– 不饱和醛、酮发生反应,1 , 2 -加成,1 , 4-加成产物均有,哪种产物为主,取决于α, β– 不饱和醛、酮的结构。 CH O CH 3C 6H 5CH C CH CH 3C 2H 5OH C 6H 5CH C O CH 3 C 2H 5 C 6H 5CH C CH 2252. H 3O 1,2—加成 40%1,4—加成 60% + CH O H CH H OH C 6H 5 C 6H 5CH C 6H 5MgX 2C 6H 5CH C CH CH 3O C 6H 5CH C CH CH 3 OH C 6H 5 C 6H 5CH C C 6H 5MgX 2+ 1. Et 2O 1,2—加成 100% + 21,2—加成 88%
不饱和醛酮选择性加氢汇编
不饱和醛酮选择性加氢 第一部分背景介绍 不饱和醇应用于大量的工业生产中,药物合成、香料、聚合物、除草剂等。目前一种合成不饱和醇的方法是将不饱和醛酮进行催化加氢。但是由于C=C键比C=O键在加氢过程中在热力学中更加有利。所以研发新型催化剂对不饱和醛酮选择性加氢十分重要。 这里,介绍了五种新型催化剂催化不同的不饱和醛酮加氢,希望为今后的研究提供新的基础。 第二部分文献综述 一、Sn修饰SiO2负载Pt催化剂的制备:一种丁烯醛选择性加氢的新型Pt-Sn 双金属催化剂[1] 方案1. 丁烯醛加氢的还原路径 丁烯醛的氢化路径,如方案1。在负载了Ⅷ族金属催化剂中,会得到丁醛而不产生丁烯醇,第二种金属加入到Ⅷ族金属催化剂中,来阻止C=C键的氢化[2,3-5]。特别的,Sn修饰负载在SiO2、氧化铝或活性炭上的Ⅷ族金属,大量的被研究[2,6-10]。我们研究了Sn的加入使生成不饱和醇的选择性大大增加[11,.12]。 方案2. Sn-Pt/SiO2双金属催化剂对于丁烯醛选择性加氢。(a)理想反应(b)实际反应方案2为我们提出的由传统浸渍法制备的Sn-Pt/SiO2催化丁烯醛的反应机
理。Sn n+例如SnO和SnO2提高了对C=O的活性,然而SnPt合金的形成或通过金属Sn进行Pt表面原子的稀释,会抑制C=C的氢化[13]。对于理想状态(方案2a),不饱和醛通过C=O基团的O原子,吸附在SnO x(例如SnO或SnO2)上。然后,活化的C=O基团被通过Pt表面活化的H攻击形成不饱和醇。由于C=C键会与Pt相互作用,所以C=C键的氢化不可避免。然而,如果Pt区域完全被Sn 覆盖,由于H分子不能被活化,则氢化反应不会发生。 为了不在活性明显下降的情况下,进一步提高对不饱和醇的选择性,需要两个条件。一个不饱和醛的是C=C键不直接与Pt表面接触,来抑制C=C氢化。另一个是H分子在Pt表面上被活化。有两个策略来避免Pt区域和不饱和醛的直接接触。一个是形成足够均匀的SnPt合金。正如之前提到的,金属Sn形成SnPt 可以抑制C=C键和Pt的相互作用。因此,为了制备足够均匀的SnPt合金,C=C 键的氢化被抑制。另一个是通过SnO2层来避免Pt和C=C键的相互作用,活化C=O基团的SnO x存在在Pt金属附近,尽管SnO x通过SiO2层与Pt完全分离。 根据前面的方案,我们尝试制备SiO2包裹在SnPt内部的纳米粒子[14]。这种纳米粒子(摩尔比Sn/Pt=1.0)用多元醇工艺来制备。在这种方法,形成均一的SnPt合金纳米粒子。这些催化剂具有高选择性(66.7%,转化率为41.1%),由于SnPt合金中心和反应物方向的控制的协同效应。 方案3. Sn/SP催化丁烯醛加氢 对于后者策略,这种催化剂是Pt纳米粒子覆盖到多孔的SiO2层,Sn在SiO2层的外表面。目前,包裹在SiO2壳内部的金属或金属氧化物纳米粒子,在很多领域进行了研究[15-23]。很多研究报道了Ni[16,17],Pt[18,19],FePt[20]和Rh[21-23]纳米粒子包裹到介孔SiO2壳中。报道了SP催化剂通过金属醇盐在反相胶束溶液中水解作用来合成,SiO2层是微孔和介孔。把Sn加入到SP催化剂中,控制孔的尺寸使H2可以进入Pt孔,然而不饱和醛不能进入Pt孔,我们提出了新的概念如方案3。由于不饱和醛不能进入Pt纳米粒子孔,C=C键的氢化被抑制,在SiO2外表面Sn位点的C=O键被活化。由中心Pt粒子活化的溢流氢通过Sn的吸附攻
鲁科版《有机化学基础》《醛酮的氧化反应和还原反应》【创新教案】
《第三节醛和酮糖类》 【课标研读】 1、认识醛、酮和糖类的组成和结构特点; 2、认识糖类的组成和性质特点,能举例说明糖类在食品加工和生物质能 源开发上的应用。 3、了解醛、酮对环境和健康可能产生的影响,关注有机化合物的安全使用问题。 【考纲解读】 1、了解醛、酮和糖类的组成和结构特点 2、了解醛的化学性质及确定醛基的化学方法 3、结合实际了解糖类的组成和性质特点,举例说明糖类在食品加工和生 物质能源开发上的应用。 【教材分析】 醛和酮是含有羰基的两类重要化合物,在官能团的转化和有机合成中占有核心地位,是有机合成的“中转站”。学生已对有机物结构与性质的关系有所了解,故要应用结构推测性质的思想方法研究醛和酮的化学性质。本节教材选取的反应依据两个方面:一与生产、生活相关;二与有机化合物的相互转化有关。糖类与生命现象、人类生活相关,而结构与醛、酮相关,故放在本节中介绍,这样可以使学生更深刻地认识糖,也加深对羰基的认识。 【学情分析】 通过前面的学习,对醛和酮的官能团、部分化学性质及乙醛和和丙酮的分子结构有了初步的认识;在必修2的学习过程中初步认识了糖的分类及葡萄糖的分子结构。 【教学重点、难点】 重点:1、醛和酮的主要化学性质; 2、醛、酮、羧酸、醇等烃的衍生物之间的相互转化; 难点:醛的化学性质,尤其是醛与弱氧化剂银氨溶液、新制氢氧化铜悬浊液的实验及化学方程式书写。 【教学计划】
第一课时:醛和酮的官能团及常见醛酮的分子组成与结构;醛酮的命名;醛酮的同分异构现象;羰基加成反应; 第二课时:醛酮的氧化反应和还原反应; 第三课时:糖类 【教学过程】 第二课时 [教学目标]: 知识与技能:1、掌握醛和酮的氧化反应和还原反应; 2、培养化学实验的基本技能; 过程与方法:分析醛和酮的分子结构的特点,判断官能团与主要化学性质的关系。情感态度与价值观:从在玻璃上镀银和检验糖尿病的方法,体验化学与生活的密切联系。 [重点、难点]: 醛和酮的化学性质-----氧化反应和还原反应 [课堂引入]通过化学2的学习,我们已经知道葡萄糖能与新制氢氧化铜悬浊液反应产生砖红色氧化亚铜沉淀,这其实就是葡萄糖分子中醛基上的氧化反应。 2、氧化反应和还原反应 [板书](1)氧化反应 ①与O2 [引导]醛酮都能发生氧化反应,空气中的氧气就能氧化醛。 [学生活动]写出乙醛催化氧化的化学方程式。 催化剂 [板书]2CH3CHO + O22CH3COOH ②与酸性高锰酸钾溶液等强氧化剂 [实验探究]在一支洁净的试管中加入2mL酸性高锰酸钾溶液,边振荡边滴加乙醛,观察现象,并作好实验记录。 现象:乙醛使酸性高锰酸钾溶液褪色。 [知识归纳]:能使酸性高锰酸钾溶液褪色的有机物有哪些? 能使酸性高锰酸钾溶液褪色的物质有:烯烃、炔烃、裂化汽油、裂解气、苯的同
醛酮总结
一.醛酮羰基上的亲核加成反应 影响因素:电子效应、空间效应和亲核试剂的亲核能力 1. 与氢氰酸的加成 反应条件:碱催化,醛、脂肪族甲基酮和8个碳以下的环酮。 应用:制备多一个C 的 -羟基酸 2.与NaHSO3 加成 产物:白色结晶物 反应物条件:醛(芳香醛、脂肪醛)脂肪族甲基酮8个碳以下的环酮。 应用:醛或甲基酮的分析 醛或甲基酮的纯化 鉴别醛脂肪族甲基酮8个碳以下的环酮 3. 与醇和水的加成 (1) 与醇的加成 注意:可逆反应 条件:干燥HCl 常用于:保护醛基,抗氧化、抗还原、抗碱 (2)与醛的加成 与醛相比,酮与醇反应生成缩酮的反应比较困难。但醇易于乙二醇作用,生成具有五元环状结构的缩酮。
条件:干燥HCl 应用:保护酮基或连二醇结构 4. 与Grignard试剂的加成 条件:乙醚 应用:制备各种醇(碳链增长) 5. 醛酮与胺类化合物的缩合 (1)与2, 4-二硝基苯肼反应(羰基化试剂)生成2, 4-二硝基苯腙(黄色固体) 注意:可逆反应 条件:所有醛类,酮类物质 酸性条件 应用:鉴别醛酮类物质 (2)羰基化合物与伯胺加成产生希夫碱 注意:可逆反应 可从羰基的正电性、试剂的亲核性、反应物的空间位阻分析亲核反应二、α-碳和α-氢的反应 醛、酮分子中,与羰基直接相连的碳原子称α-碳,α-碳上的氢成为α-氢。含α-H的醛、酮,其α-H受C=O影响,可发生离解。(①羰基的吸电子作用增大了C-H键的极性,α-氢易离去②α-氢离去后,醛,酮可通过形成负电荷离域化氧原子和α-碳上,趋于稳定)α-H 的反应主要有两种:卤代(醛酮合成羧酸)、缩合(醛酮合成醇)Ⅰ.卤代(卤仿)
