高等植物适应盐逆境研究进展_张金林

DOI :10.11686/cyxb2015233http ://cyxb.lzu.edu.cn
张金林,李惠茹,郭姝媛,王锁民,施华中,韩庆庆,包爱科,马清.高等植物适应盐逆境研究进展.草业学报,
2015,24(12):220-236.ZHANG Jin-Lin ,LI Hui-Ru ,GUO Shu-Yuan ,WANG Suo-Min ,SHI Hua-Zhong ,HAN Qing-Qing ,BAO Ai-Ke ,MA Qing.Research advances in higher plant adaptation to salt stress.Acta Prataculturae Sinica ,2015,24(12):220-236.
高等植物适应盐逆境研究进展
张金林1*,李惠茹1,郭姝媛1,王锁民1,施华中2,韩庆庆1,包爱科1,马清
1(1.草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃兰州730020;
2.美国德克萨斯理工大学化学与生物化学系,德克萨斯拉伯克TX79409,美国)
摘要:土壤盐碱化已经成为制约农作物生长及产量的重要因子之一,寻求将盐碱化对植物的危害降低到最小程度
的策略势在必行。关于植物对盐逆境适应能力的研究已成为全球关注的热点,如何提高植物的耐盐能力也已成为
研究的重中之重。深入探究高等植物适应盐逆境的机制,有助于提高植物耐盐性,增加作物产量和保护生态环境。
本文就高等植物适应盐逆境的重点研究进展,综述了盐胁迫对植物的危害;植物耐盐的生理机制,包括渗透调节、
营养元素平衡和增强抗氧化胁迫等;植物耐盐相关基因研究进展,包括离子转运蛋白基因、渗透调节相关基因、信
号传导相关基因和细胞抗氧化相关基因等;提高植物耐盐性的途径。最后针对今后植物适应盐逆境方面的研究方
向进行了展望。
关键词:高等植物;盐胁迫;耐盐性;耐盐基因
*Research advances in higher plant adaptation to salt stress
ZHANG Jin-Lin 1*,LI Hui-Ru 1,GUO Shu-Yuan 1,WANG Suo-Min 1,SHI Hua-Zhong 2,HAN Qing-Qing 1,BAO Ai-Ke 1,MA Qing 1
1.State Key Laboratory of Grassland Agro-ecosystems ,College of Pastoral Agriculture Science and Technology ,Lanzhou University ,Lanzhou 730020,China ;2.Department of Chemistry and Biochemistry ,Texas Tech University ,Lubbock TX 79409,USA
Abstract :Soil salinity is a serious worldwide problem causing reduction in crop growth and agricultural output potential.Consequently ,finding new ways to minimize the adverse effects of soil salinization on agriculture is globally important.Understanding the adaptation mechanisms of higher plants to salt stress is critical for enhancing salt tolerance and yields of crop plants as well as protecting ecological environments.In this paper ,we reviewed the key progresses in salt stress adaptation of higher plants ,including the effects of salt stress in plants ;physiological mechanism of plant salt tolerance (osmotic adjustment ,nutrient balance and the antioxidant system );the diversity of genes relevant to salt tolerance (ion transporting protein genes ,osmotic regulation-related genes ,signal transduction-related genes and cellular antioxidant-related genes and so on );and the approaches for crop improvement in salt tolerance.Prospects for developing crop plants tolerant to salinity are also discussed.
Key words :higher plants ;salt stress ;salt tolerance ;salt tolerant genes
地球表面70%的面积被海洋覆盖,海水中Na +浓度大约在500mmol /L 以上,而K +浓度仅为9mmol /L [1];地
壳当中钠元素含量为2.8%,而钾元素为2.6%
[2]。因此,地球被称为“咸行星”[1]。在中世纪,盐(氯化钠,NaCl )第24卷第12期
Vol.24,No.12
草业学报ACTA PRATACULTURAE SINICA 2015年12月Dec ,2015*收稿日期:2015-
05-07;改回日期:2015-07-14基金项目:国家自然科学基金项目(31222053,31170431和31172256),教育部
“长江学者和创新团队发展计划”(IRT13019)和中央高校基本科研业务费项目(lzujbky-
2014-m01和lzujbky-2015-194)资助。作者简介:张金林(1975-),男,甘肃泾川人,教授,博士生导师,博士。
*通信作者Corresponding author.E-mail :jlzhang@lzu.edu.cn
被称为“白色金子”,因为它是和黄金一样昂贵的商品[3]。盐碱土在陆地生态系统上分布广泛,全世界盐渍土面
积约l0亿hm 2[4]。在全球的干旱和半干旱地区,约有50%的灌溉土地受到盐碱化的影响,区域内的非灌溉土地
同样会发生盐碱化[4]。中国土地盐渍化大约占到全球盐渍土面积的1/10[5],从滨海到内陆,从低地到高原都分
布着不同类型的盐渍化土地
[6]。在长期的自然进化过程中,海洋植物保留了对高浓度盐分的耐受性,然而,大多数陆生高等植物在进化过程中丧失了这种耐受性而采取了一种甜土植物的生活方式[7]。土壤中可溶性盐分过多,会对植物造成伤害[4,8]。因此,土壤盐碱化已经成为影响农作物生长及产量的重要因子之一,关于植物对盐逆境适应能力的研究已成为全球关注的热点。如何提高植物的耐盐能力已成为研究的重中之重。高等植物对盐逆境的适应是一个综合的生物调节过程,需要各种生理生化过程的协同作用,而非某种单一的过程就能够使植物成功地抵御盐逆境。本文综述了盐胁迫对植物的危害,植物适应盐逆境的方式,提高植物耐盐性的途径和植物耐盐的相关基因研究进展,最后针对植物适应盐逆境方面的研究进行了展望。
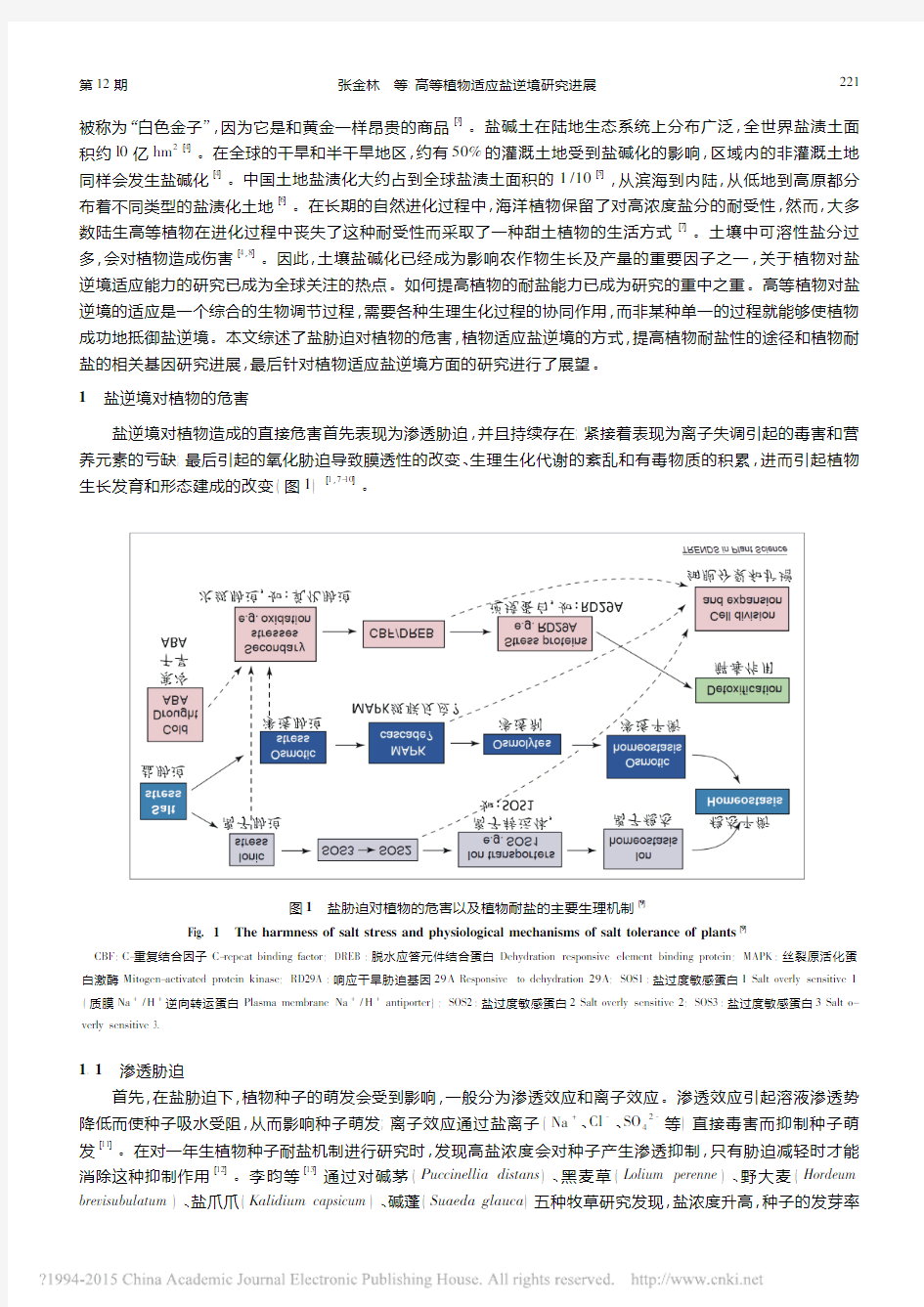
1盐逆境对植物的危害
盐逆境对植物造成的直接危害首先表现为渗透胁迫,并且持续存在;紧接着表现为离子失调引起的毒害和营
养元素的亏缺;最后引起的氧化胁迫导致膜透性的改变、
生理生化代谢的紊乱和有毒物质的积累,进而引起植物生长发育和形态建成的改变(图1)[1,7-10]
。
图1
盐胁迫对植物的危害以及植物耐盐的主要生理机制[9]Fig.1The harmness of salt stress and physiological mechanisms of salt tolerance of plants [9]
CBF :C-重复结合因子C-
repeat binding factor ;DREB :脱水应答元件结合蛋白Dehydration responsive element binding protein ;MAPK :丝裂原活化蛋白激酶Mitogen-
activated protein kinase ;RD29A :响应干旱胁迫基因29A Responsive to dehydration 29A ;SOS1:盐过度敏感蛋白1Salt overly sensitive 1(质膜Na +/H +逆向转运蛋白Plasma membrane Na +/H +antiporter );SOS2:盐过度敏感蛋白2Salt overly sensitive 2;SOS3:盐过度敏感蛋白3Salt o-verly sensitive 3.
1.1渗透胁迫
首先,在盐胁迫下,植物种子的萌发会受到影响,一般分为渗透效应和离子效应。渗透效应引起溶液渗透势
降低而使种子吸水受阻,
从而影响种子萌发;离子效应通过盐离子(Na +、Cl -、SO 42-等)直接毒害而抑制种子萌发[11]。在对一年生植物种子耐盐机制进行研究时,发现高盐浓度会对种子产生渗透抑制,只有胁迫减轻时才能
消除这种抑制作用[12]。李昀等[13]通过对碱茅(Puccinellia distans )、黑麦草(Lolium perenne )、野大麦(Hordeum
brevisubulatum )、盐爪爪(Kalidium capsicum )、碱蓬(Suaeda glauca )五种牧草研究发现,盐浓度升高,种子的发芽率
1
22第12期张金林等:高等植物适应盐逆境研究进展
222草业学报第24卷
会降低。其次,对于整株植物而言,若土壤中的盐分过多,则会导致土壤中的水势下降,植物细胞的水势相对过高,导致植物吸水困难,严重的还会引起植物失水,引起生理干旱[7]。
1.2离子失调
土壤中的盐分多以离子形式存在,虽然高等植物对土壤中的离子具有选择吸收作用,但是在吸水的同时,也必定会吸收大量的盐离子[1,7-10]。K+在细胞内可作为60多种酶的活化剂,能促进蛋白质的合成,促进糖类的合成与运输;K+也是构成细胞渗透势的重要成分[14]。而在根内K+可以从薄壁细胞转运至导管,从而降低导管中的水势,使水分能从根系表面转运到木质部中去[15]。K+对气孔开放有直接作用,有研究表明,K+可以维持细胞的渗透平衡,在气孔的关闭中起作用,还可以作为许多酶的辅助因子行使生理功效[16]。土壤中K+的浓度范围在0.2 10.0mmol/L之间,而K+和Na+的水合半径相似,因此高浓度的Na+会阻碍植物对K+的吸收,造成K+匮缺,从而抑制了以上提到的依赖于K+的生理生化反应的正常进行[4,7]。同时,大量Na+、Cl-进入细胞可以破坏Ca2+平衡,细胞质中游离Ca2+急剧增加,使Ca2+介导的钙调蛋白(calmodulin,CaM)调节系统和磷酸肌醇调节系统失调,细胞代谢紊乱甚至伤害死亡[17]。此外,土壤中高浓度的盐分还会抑制植物对NO3-和NH4+的吸收,而对NO3-吸收的抑制作用更大[18]。
1.3氧化胁迫
细胞膜是植物细胞重要的保护屏障,对物质运输、能量传递、信号转导有重要作用。细胞膜本身具有选择透过性,因而可以调节细胞内的离子平衡,同时满足植物生理活动的需要。然而,盐胁迫导致的氧化胁迫会使膜的透性发生改变,一方面对离子的选择性、流速、运输等产生影响;另一方面,也造成了磷和有机物质的外渗,从而使得细胞的生命活动受到影响[7]。丙二醛(malondialdehyde,MDA)含量的高低和细胞质膜的透性变化是反映膜脂过氧化作用强弱和质膜破坏程度的重要指标,其含量可说明植物遭受逆境伤害的程度[19]。活性氧的增加还会破坏细胞中具有膜结构细胞器的结构,如引起线粒体DNA的突变,造成细胞衰老,导致内质网部分膨胀、线粒体数目减少而体积膨胀、液泡膜破碎、胞质降解等。
1.4光合作用受挫
盐逆境会使得植物的光合速率下降,叶绿素是表征光合利用率的最重要的指标之一。随着盐浓度升高,叶绿素a、b和类胡萝卜素含量均显著降低,表明高盐胁迫抑制或破坏了光系统Ⅱ的部分功能,光合作用的能量及电子传递受到抑制[20]。同时,盐分过多可使磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)与1,5-二磷酸核酮糖羧化酶(ribulose-1,5-bisphosphate,Rubisco)活性降低,引起胁迫初期光合作用明显下降[21]。
1.5有毒物质的积累
盐胁迫下,由于植物细胞结构的损伤、活性氧的积累、生理代谢的破坏,植株体内蛋白质的合成速率降低,水解加速,造成植株体内氨基酸积累,会产生许多的有毒物质,如大量氮代谢的中间产物,包括NH3和某些游离氨基酸(异亮氨酸、鸟氨酸和精氨酸)转化成有一定毒性的腐胺(如丁二胺、戊二胺等),而腐胺又可被氧化成NH3和H2O2,当它们达到一定浓度时,细胞会中毒死亡[22]。这些物质的积累,会抑制植物内相关物质的合成,使得植物生长受抑。
2植物耐盐的生理机制
植物受到盐害胁迫时,会采取两种方式来减轻盐胁迫造成的危害:躲避盐离子的伤害和增强对盐胁迫的耐受性[6]。植物避盐的方式主要分为4种:泌盐、稀盐、积盐和拒盐。泌盐(salt excretion)是指植物在吸收盐分后,不在体内存储,而是通过体内的盐腺等器官或机制排出体外,再通过雨水冲刷等方式脱盐,从而维持植物体内的离子稳态。泌盐被认为是一个有助于盐生植物抗盐的重要机制[5,23-24]。稀盐(salt-dilution)是指植物通过吸收大量的水分、使细胞加速生长(增加薄壁细胞组织,使细胞质膨胀,增大细胞壁伸展度等)、改变形态等方法,稀释体内盐分,降低盐浓度[7,23]。积盐(salt-accumulation)是指植物体内的原生质特化后,将根部吸收的盐分区隔化至液泡,同时,抑制盐分从液泡内溢出,即将盐分储存在液泡内,作为廉价的渗透调节剂[7,23]。拒盐(salt-exclusion)是指植物本身排斥盐离子进入细胞,依靠其对盐的不透性,阻止盐分进入植物体;另一方面,植物根部通过阻止Na+
向木质部的装载和加大对Na +外排来减少植株对Na +积累。绝大多数栽培植物都属于拒盐能力弱的甜土植物,
拒盐能力强的盐生植物有芦苇、碱茅
[7,23,25]。除了通过以上4种方式来躲避盐离子的伤害,所有高等植物都可以通过以下几个方面的生理调节过程来增强对盐胁迫的耐受性,即渗透调节、营养元素平衡和增强抗氧化胁迫(图1)。
2.1渗透调节
在盐逆境胁迫下,高等植物通常会采用两种渗透调节方式,一是在植物体内合成有机调节物质;二是积累更多的无机离子。
通常有机溶质大体可分为3类:1)游离氨基酸(如脯氨酸),具有很大的水溶性,其疏水端可和蛋白质结合,亲水端可与水分子结合,蛋白质可借助脯氨酸束缚更多的水,从而防止渗透胁迫条件下蛋白质的脱水变性;它可以维持细胞内外渗透平衡,防止水分散失[26]。2)甜菜碱,作为一种无毒的渗透调节剂和酶的保护剂,它的积累使
植物细胞在盐胁迫下保持膜的完整性,在渗透胁迫下仍能保持正常的功能。许多高等植物,尤其是藜科和禾本科植物,在受到水/盐胁迫时积累大量甜菜碱[27]
。甜菜碱对类囊体膜也有稳定作用,并显著提高光系统Ⅱ光合放氧的稳定性;甜菜碱能保护抗氧化酶系统[超氧化物歧化酶(superoxide dismutase ,SOD )、抗坏血酸过氧化物酶(a-
scorbate peroxidase ,APX )、过氧化氢酶(catalase ,CAT )等]的活性[28];甜菜碱还可以稳定生物大分子的结构与功
能,
解除高浓度盐对酶的毒害作用,防止脱水诱导的蛋白质热动力学干扰[29]。3)可溶性糖和多元醇,也可以作为渗透调节物质,调节植物细胞的渗透势,从而增强植物的耐盐机制[30]。
无机离子(K +,Na +和Cl -)作为渗透调节剂具有很多优点,也日益受到重视。首先,由于离子的大量存在,
无需消耗物质和能量来大量合成,所以较为廉价;第二,无机离子的调节作用可以在短时间内迅速完成;第三,它们的作用也显著高效[31]。无机离子在整株植物渗透调节中的作用可以很简易地通过直接测量茎或根的渗透压
而容易的验证,并且可以与它们在组织液中的浓度进行比较。无机离子主要是K +、Na +、Cl -,无论是在盐生植物还是在非盐生双子叶植物中,这3种离子提供了80%至95%的细胞液渗透压
[31]。K +是循环丰富的离子,同时K +是植物生长的必需元素,在维持细胞的基本功能中扮演了重要角色,并且在保持低水平的蛋白酶和核酸内切酶活性以及防止植物在盐胁迫下细胞损伤和死亡中的作用也是不言而喻的
[32]。有研究表明,碱茅与更敏感的长穗偃麦草(Elytrigia elongata )相比,在严重的高盐或缺氧条件下,长穗偃麦草将更严重地丢失K +,从而证明了K +保留在根中对高盐缺氧土地耐受性的作用
[33]。而对积盐型盐生植物而言,对Na +的吸收远远大于K +的吸收[34]。绝大部分被植物细胞吸收的Na +并非存在于细胞质中,而是区隔化在液泡中作为廉价的渗透调节物质来
维持正常细胞膨压,从而增强植物抵御盐逆境的能力[35-37]。研究表明,在介质当中添加适量的NaCl 可以增强荒
漠植物霸王(Zygophyllum xanthoxylum )的抗旱性,
从而促进其生长[38-39];进一步分析表明,干旱胁迫下霸王叶中Na +浓度显著增加了64%,Na +对叶渗透势的贡献由8%增至13%;50mmol /L NaCl 处理使干旱胁迫下霸王叶中
Na +显著增加了2.3倍,Na +对叶渗透势的贡献增至28%,从而提高了植株的渗透调节能力[38]。
2.2营养元素平衡
在正常生理状态下,植物细胞内的离子保持均衡状态,而在盐胁迫下,细胞质中过多的离子尤其是Na +对植
物细胞的代谢活动会有伤害。大多数植物在盐胁迫下,组织内的K +含量会降低[4]。王锁民等[40]在对植物Na +、
K +的选择性吸收及运输的研究基础上,首次提出植物根系对土壤中Na +、
K +的选择性吸收(selective absorption ,SA )能力以及植株不同部位对Na +、K +选择性运输(selective transport ,ST )能力的计算公式。研究表明,小花碱茅
(Puccinellia tenuiflora )可以在高Na +环境下生存,且其体内维持很低的Na +浓度,主要依靠其对K +/Na +强大的
选择性吸收能力和限制Na +的吸收[25]。这一结果在对盐敏感和耐盐品种的长穗偃麦草的比较研究中得到了进
一步证实,即耐盐品种的SA 和ST 值均显著大于盐敏感品种
[41]。海滨碱蓬(Suaeda maritima )体内的K +含量变化是随NaCl 浓度的升高而呈升高趋势,这样既可以保持一定的K +营养,还可以保持相对稳定的K +/Na +,这对植物本身生长有利[42]。在盐胁迫的条件下,提供某些微量元素,可有效地提高植物的含水量,促进植物的光合作
用,
有利于植物生长。研究表明,在含有Na +的土壤中添加硅时,植株的含水量提高了7.3%,同时,植物的光合效322第12期
张金林等:高等植物适应盐逆境研究进展
422草业学报第24卷
率、CO2同化效率等也得到了显著地提高;在黄瓜(Cucumis sativus)[43]、大麦(Hordeum vulgare)[44]、水稻(Oryza sa-tiva)[45-46]、紫花苜蓿(Medicago sativa)[47]、小麦[48]和草地早熟禾(Poa pratensis)[49]等植物研究中也得到了同样的结果。
2.3增强抗氧化胁迫
在正常的生理条件下,植物体内的活性氧自由基和自身的抗氧化系统对活性氧的清除是动态平衡的,可以保持体内正常的代谢过程。在干旱、盐渍等胁迫下,膜脂过氧化作用加剧,植物体内活性氧含量上升,随之超氧化物歧化酶、过氧化物酶(peroxidase,POD)、过氧化氢酶和抗坏血酸(ascorbic acid,ASA)等保护酶的活性也相应增加,从而防止膜脂的过氧化作用,以此来增强植物对逆境的耐受性[50]。管博等[51]在盐地碱蓬(Suaeda salsa)的研究发现,随着盐胁迫的增强,SOD作为防御活性氧自由基(reactive oxygen species,ROS)的第一道防线,其活性显著增加,CAT活性变化趋势与SOD相似。此发现在对梭梭(Haloxylon ammodendron)[52]和沟叶结缕草(Zoysia ma-trella)[53]的研究中也得到证实。有研究表明,高盐和干旱处理下,西藏野生大麦(Hordeum vulgare var.trifurca-tum)体内的ROS水平会显著升高来抵御伤害[54]。然而在重度盐胁迫下,植物体内的这些活性氧去除剂的结构发生破坏,植物清除活性氧的防御能力下降,使膜脂的过氧化作用加剧,破坏细胞膜的透性[4,7,55]。
3高等植物耐盐相关基因研究进展
随着分子生物学的发展,人们能够在基因组成、表达调控及信号转导等分子水平上认识植物的耐盐机理;并且已经通过对植物耐盐相关基因的研究,来进一步提高植物的耐盐性。目前,高等植物耐盐相关基因的研究主要集中在离子转运蛋白基因、渗透调节相关基因、信号传导相关基因、细胞抗氧化相关基因等。
3.1离子转运蛋白基因
3.1.1质膜上离子转运蛋白基因有研究表明,环核苷酸调控通道(cyclic-nucleotide-gated channel,CNGCs)和非选择性阳离子通道/电压非依赖型通道(non-selective cation channel/voltage-independent channel,NSCCs/ VICs)是不同类型的通道蛋白,在一些植物中CNGCs涉及Ca2+的信号转导,而NSCCs/VICs涉及Na+的摄入[56]。而NSCCs/VICs[57]是根部Na+进入细胞膜的通道蛋白,当NSCCs通道被抑制时,就可缓解细胞的盐胁迫(图2)。Tyerman和Skerrett[58]在研究小麦根部的NSCCs通道时发现,涌入的Na+主要分布于根部的各个区室及表皮的原生质内。低亲和性阳离子转运体(low-affinity cation transporter,LCT1)是从小麦中发现的一类能够介导低亲和性阳离子吸收的蛋白[59]。研究表明,小麦中的LCT1不仅可以维持Rb+与Na+的浓度的平衡,吸收少量的Ca2+,也可维持Na+/K+的浓度[60];但由于受到土壤中Ca2+浓度的影响,LCT1并不是Na+流入的主要通道[4,61]。
高亲和K+转运载体(high-affinity K+transporter,HKT)是一种与植物耐盐性密切相关的Na+或Na+-K+转运蛋白,能将植物木质部中过多的Na+卸载到其周围薄壁细胞中,降低地上部Na+含量,并维持体内K+稳态平衡[4,62](图2)。根据在异源表达系统中对Na+和K+运输的不同,HKT蛋白可被分成两种[63]:HKT1作用于外部K+缺乏时,主要用于特异性Na+的运输和介导Na+的吸收[64];HKT2则是有K+-Na+协同转运蛋白及其同系物的功能[4]。Ren等[65]绘制了一个水稻SKC1基因的QTL图谱,并发现SKC1基因编码一种HKT型K+/Na+通道蛋白,在植物盐胁迫下调节K+/Na+离子平衡,维持细胞内外的渗透压,从而提高植物耐盐能力,后来证明SKC1为水稻HKT1;5基因。Laurie等[66]研究表明HKT2基因的低表达可以抑制Na+的进入,从而降低组织内Na+的浓度。作为高亲和性Na+转运的转运体,HKT转运蛋白在草类以及其他植物中可能都在控制整体植株中Na+的转运起重要作用[2]。Kader等[67]在研究水稻时发现,转运蛋白基因OsHKT1、OsHKT2和OsVHA在盐胁迫下诱导表达,可以通过调节Na+与K+的比例而降低Na+的浓度。研究表明,SsHKT1在盐地碱蓬的离子平衡和耐盐方面有重要作用[68]。
众多研究表明,高亲和K+转运载体(high-affinity K+transporter,HAK)基因对Na+的吸收也有重要作用[69]。盐对HvHAK1积累影响的分析结果表明,在转录水平上,一个强而短暂NaCl胁迫触发HvHAK1的上调,说明HvHAK1是一个高盐应答的快速反应基因。还有研究表明,在盐逆境胁迫下,HvHAK1mRNA的积累和对K+摄取的控制是高度相关的[70],对Na+吸收的控制则对维持细胞内的pH重要[71]。研究表明,PhaHAK5、PhaHAK2-n、
PhaHAK 2-e 、PhaHAK 2-u 等基因均可调节盐生植物中Na +的浓度[72]
。
图2植物细胞Na +运输机制及响应盐逆境的重要调控网络(在Deinlein 等
[62]基础上修订)Fig.2Na +transport mechanism and important regulation network of response to salt
stress in plant cell (Modified from Deinlein et al .[62])ABA :脱落酸Abscisic acid ;ATP :三磷酸腺苷Adenosine triphosphate ;CBLs :钙调磷酸酶B 类蛋白Calcineurin B-like proteins ;CDPKs :钙依赖蛋白激
酶Calcium-
dependent protein kinases ;CIPKs :CBL 互作蛋白激酶Cbl-interacting protein kinases ;HKT :高亲和性K +转运蛋白High-affinity K +transport-er ;KORC :K +外向整流电导K +outward rectifying conductance ;NHX :液泡膜Na +/H +逆向转运蛋白Vacuolar membrane Na +/H +antiporter ;NORC :
非选择性外向整流电导Nonselective outward-
rectifying conductance ;NSCC :非选择性阳离子通道Non-selective cation channels ;PM :质膜Plasma mem-brane ;ROS :活性氧Reactive oxygen species ;SOS1:盐过度敏感蛋白1Salt overly sensitive 1(质膜Na +/H +逆向转运蛋白Plasma membrane Na +/H +antiporter );SOS2:盐过度敏感蛋白2Salt overly sensitive 2;SOS3:盐过度敏感蛋白3Salt overly sensitive 3;VP :液泡膜H +磷酸化酶Vacuolar mem-brane H +pyrophosphatase ;NAC ,WRKY ,bHLH ,MYB ,AP2/ERF and Bzip :位于细胞核的转录因子,其中AP2/ERF 和bZIP 负调控HKT 基因的表达Transcription factors located in nucleus ,AP2/ERF and bZIP negatively regulate HKT gene expression.
拟南芥K +转运体(Arabidopsis K +transporter ,
AKT1)类的通道蛋白是在植物中广泛表达的一类内整流K +通道。作为一条对NH 4+不敏感的K +吸收途径,
AKT1的主要功能是与对NH 4+敏感的K +
吸收途径并行存在,使植物能够适应多样的外界环境。研究表明,小麦中K +缺乏时,
TaAKT1通道会增强对Na +的吸收。众多研究显示,OsAKT 1的表达并不影响植物中K +的浓度,但是Na +的积累却依靠此基因的表达[73]。KUP 基因家族对细胞内
K +浓度的调节有多种类型[74],它们的表达可以表现出对K +的高吸收性,但是在拟南芥(Arabidopsis thaliana )中,
NaCl 的加入会抑制K +的吸收[75]。Wang 等[34]研究表明,积盐型盐生植物海滨碱蓬存在两条低亲和性Na +吸收
途径,即在低浓度NaCl (25mmol /L )条件下主要由HKT 介导Na +的吸收,在高浓度NaCl (150mmol /L )条件下主要由AKT1介导Na +的吸收。Zhang 等
[76]进一步研究发现两条途径的外界Na +浓度介于95 100mmol /L NaCl
之间。盐敏感(salt overly sensitive ,SOS )基因是从一类超盐敏感突变体中发现的,遗传分析表明,这些突变体可分为
522第12期张金林等:高等植物适应盐逆境研究进展
622草业学报第24卷
5种,即sos1、sos2、sos3、sos4和sos5[77-78]。目前筛选出的一些SOS基因家族编码重要的植物离子载体蛋白、信号转导蛋白等,它们的存在对提高植物的耐盐性有重要作用。质膜Na+/H+逆向转运蛋白就是由SOS1编码的,该蛋白的主要功能就是将Na+排到细胞外部,从而减少细胞内Na+的积累[62,79-80](图2)。Guo等[81]研究表明,SOS1在小花碱茅拒Na+当中发挥着重要作用。Ma等[82]对霸王ZxSOS1的研究表明,ZxSOS1参与调控霸王体内Na+、K+转运和空间分配,进而影响植株生长。Feki等[83]将硬质小麦(Triticum durum)TdSOS1转入拟南芥显著提高了转基因植物的耐盐性。Nie等[84]通过将大豆(Glycine max)GmsSOS1基因转到缺失SOS1的拟南芥中,证明了其互补性,即验证了SOS1的功能。SOS2和SOS3都是编码信号转导途径中的蛋白,在信号转导过程中,彼此有着千丝万缕的联系。同时,有研究表明二者功能的行使与Ca2+有密切的关系[85]。目前研究的SOS信号通路就是:高浓度的Na+引起细胞内Ca2+浓度上升,Ca2+与SOS3结合,结合Ca2+后的SOS3与SOS2直接互作而激活了SOS2,之后通过SOS3氨基末端的酰化(amino terminus myristoylation)使SOS3-SOS2复合体会铆钉到细胞质薄膜上,该复合体中被激活的SOS2磷酸化质膜上的SOS1,从而提高SOS1对Na+的转运活性而促进高浓度Na+的外排[7]。但在拟南芥和水稻之间SOS信号通路似乎具有保守型,在水稻中,功能性同系物SOS1,SOS2,SOS3也构成一个重要的耐盐的信号通路[86]。SOS5则在细胞壁形成、细胞伸展、植物繁殖等过程中起重要作用[77]。这一系列研究表明,在盐胁迫下SOS基因家族对植物的耐盐性有重要作用。
3.1.2液泡膜上离子转运蛋白基因成熟植物细胞的液泡为Na+储存提供弄了一个很大的空间。将Na+区域化在液泡中是减少细胞溶质之中Na+的有效方式,从而减少胞液中Na+的毒害作用。钠和氯离子在细胞溶质中的浓度是由穿过质膜和液泡膜的净通量决定的。液泡膜蛋白中,Na+/H+逆向转运蛋白(Na+/H+transporters,NHX)参与运输Na+,该转运蛋白是由液泡膜H+-ATP酶和H+-焦磷酸酶的作用所形成的质子梯度来驱动的(图2)[34,62]。NHX基因被证明可以将细胞质中的Na+区域化在液泡中。第一个从拟南芥克隆出的NHX型转运体基因被命名为AtNHX1[87],它属于AtNHX1-6亚科六成员之一。这组转运体运用质子驱动力来运输Na+和K+[88-89]。除了在耐盐性中的作用,NHX转运体还涉及许多其他细胞过程,包括细胞内pH值调节[90],囊泡运输和蛋白定位[91]。从发现拟南芥中NHX转运体后,已在许多其他植物中发现了此类型的转运体,包括水稻OsNHX1[92]、细叶海滨藜(Atriplex gmelini)AgNHX1[93]、大麦HvNHX1[94]、棉花(Gossypium spp.)GhNHX1[95]、玉米ZmNHX[96]、小麦TaNHX1[97]和TaNHX2[98]、苜蓿MsNHX1[99]、大豆(Glycine max)GmNHX1[100]、长穗偃麦草(Elytrigia elongata)AeNHX1[101]、珍珠狼尾草(Pennisetum glaucum)PgNHX1[102]、灰绿藜(Chenopodium glaucum)CgNHX1[103]、胡杨(Populus euphratica)PeNHX1-6[104]、盐穗木(Halostachys caspica)HcNHX1[105]、霸王ZxNHX1[37]、海蓬子(Salicornia bigelovii)SbNHX1[106]和花花柴(Karelinia caspia)KcNHX1和KcNHX2[107]等。Wu等[37]发现在盐或干旱条件下,霸王ZxNHX的上调与Na+的积累呈正相关关系。进一步研究表明,霸王ZxNHX在控制Na+、K+的吸收,长距离运输和整株内离子稳态方面具有重要作用[108]。自从报道AtNHX基因超表达可以使拟南芥具有耐盐性后[87],AtNHX或其他NHX基因在植物中超表达以使之具有抗逆性的成功例子也越来越多。例如将拟南芥AtNHX1分别导入玉米[109]、小麦[110]、棉花[111]和花生(Arachis hypogaea)[112],将细叶海滨藜AgNHX1导入水稻[93],将棉花GhNHX1导入烟草[95],将短芒大麦草(Hordeum brevisubulatum)HbNHX1导入烟草[98],将狼尾草(Pennisetum alopecuroides)PgNHX1导入芥菜(Brassica juncea)[113]和水稻[102],将长穗冰草(Agropyron elongatum)AeNHX1导入拟南芥和高羊茅(Festuca elata)[101],将拟南芥AtNHX5导入兰猪耳(Torenia fournieri)[114],将獐茅(Aeluropus sinensis)AlNHX导入烟草[115],将小麦TaNHX1导入紫花苜蓿[116],将北美海蓬子(Salicornia Bigelovii)SbNHX1导入麻疯树(Jatropha curcas)[117],将绿豆(Vigna radiata)VrNHX1导入拟南芥[118],均显著提高了转基因植物的耐盐性。
NHX转运体通过跨液泡膜H+梯度驱动来转运Na+至液泡,因此通过H+-ATP酶和H+-焦磷酸酶的超表达增加H+驱动力,从而有可能提高抗盐性。然而,由于其多亚基的特征,液泡H-ATP酶并不是超表达的理想候选者,因为不大可能将所有的亚基在相似的水平过量表达而去创建一个功能性的超表达转基因植物。液泡膜H+-焦磷酸酶(vacuolar pyrophosphatase,VP)是用于此目的的一个更好的选择,因为它是一个单一的多肽蛋白[119-120],并且,它产生H+梯度的能力可与H-ATP酶相媲美(图2)[62,121]。H-焦磷酸酶基因也首先在拟南芥中被克隆出
来,命名为AVP 1
[119]。VP 基因也已从其他许多高等植物中克隆得到,如盐芥TsVP [121]和盐地碱蓬SsVP 等[122]。拟南芥AVP 1的过量表达赋予转基因植物耐旱和耐盐性,在许多植物中得到了证实,如拟南芥[120,123]、番茄[124]、紫花苜蓿[125]、匍匐翦股颖(Agrostis stolonifera )[126]、大麦[127]、甘蔗(Saccharum officinarum )[128]。同时,其他VP 基因
导入植物后,植物抗逆性也得到了提高,例如将盐地碱蓬SsVP 1转入拟南芥[122],将盐芥(Thellungiella halophila )
TsVP 转入烟草[129]、棉花[130]和玉米[130],将盐爪爪KfVP 1转入拟南芥[131],将小麦TaVP 1转入烟草[132],将小麦
TaVP 基因转入烟草[133]。
近年来,一些学者将NHX 和VP 两种转运蛋白基因构建双价表达载体同时超表达进行了转基因研究,如在水稻中超表达盐地碱蓬SsNHX 1和拟南芥AVP 1[134],水稻OsNHX 1和OsVP 1
[135];在拟南芥中超表达小麦TaNHX 1和TaTVP 1[136];在西红柿中超表达狼尾草PgNHX 1和拟南芥AVP 1[137];在烟草中超表达小麦TaNHX 1和TaTVP 1[138]
以及在百脉根(Lotus corniculatus )中超表达霸王ZxNHX 和ZxVP 1-
1[139]。3.2渗透调节相关基因
渗透胁迫是植物盐胁迫的主要方面,渗透调节相关基因在植物耐盐性中的作用也进行了较多研究。多元醇、脯氨酸、海藻糖、甜菜碱等均是植物耐盐的重要渗透调节物质,因而合成这些渗透调节物质的一些关键基因在耐
盐中起到重要作用。如mtlD 基因和gutD 基因,
它们分别编码合成甘露醇和山梨醇的酶。超表达mtlD 基因增加了甘露醇在毛白杨(Populus tomentosa )体内的积累从而增强了其耐盐性
[140];转gutD 基因可使转基因植株产生山梨醇,转基因玉米可耐受1.17%NaCl 的浓度
[141];在水稻中超表达mtlD 和gutD 基因提高了其耐盐性[142]。Kishor 等[143]对P 5CS 基因进行研究,获得P 5CS 转基因烟草,其中脯氨酸的含量明显提高,与对照相比,耐盐性有
提高。晚期胚胎发生富集蛋白(late embriogenesis abundant protein ,
LEA )是Dure 等[144]首次在棉花种子发育晚期胚胎中发现的一类蛋白。Xu 等
[145]将LEA 基因转入水稻悬浮细胞中,得到的转基因植株经过繁殖,在第二代中表现出耐盐的能力。张宁等[146]从菠菜(Spinacia oleracea )叶片中分离了甜菜碱醛脱氢酶(betaine-
aldehyde dehy-drogenase ,BADH )基因,并将该基因与其他植物的BADH 序列作了同源性分析,同时,证实了菠菜BADH 基因的转录与表达受干旱和盐胁迫的诱导。Jia 等[147]将山菠菜(Atriplex hortensis )的BADH 基因转入烟草,提高了烟草的
耐盐性。在水稻中过量表达缺失D 结构域的组成型活性突变形式OsbZIP 46CA 1可以显著增强耐旱性和抵抗渗透胁迫的能力,并可显著上调已知的逆境应答基因(包括ABF 或AREB 类成员的下游基因)的表达
[148]。
3.3信号传导相关基因
在盐胁迫下,植物可以关闭或开启某些基因的表达,从而维持自身的营养平衡。与植物耐盐性相关的信号转
导途径包括:SOS 途径(见3.1.1)、
脱落酸(abscisic acid ,ABA )信号和蛋白激酶途径。ABA 应答基因可分为ABA 依赖型和ABA 非依赖型。目前,已发现多种转录因子与盐胁迫有关,这些基因的
表达分为4条途径:两条依赖ABA 途径,两条不依赖ABA 途径[149]。十字花科植物盐芥是拟南芥的近亲,它耐盐,耐低温和氧化胁迫,盐芥基因组相对较小,因此成为研究植物耐受逆境分子机理的理想材料
[150]。在盐芥中研究发现,所有涉及ABA 生物合成途径的基因家族在盐胁迫下基因数目增加,这种增加会调节复杂的ABA 生物合成过程[45,151]。
蛋白激酶在调节植物对非生物胁迫的响应中发挥了重要作用。蛋白激酶是信号转导的重要元件,信号转导
中丝裂原活化蛋白激酶(mitogen-
activated protein kinase ,MAPK )途径是重要途径之一。目前已分离到多种能被逆境诱导的MAPK 基因:拟南芥AtMEKK 1、
AtMEK 1/AtMEK 2、ATMPK 3、AtMPK 4、ANP 1、AtMKK 2以及烟草NPK 1、AtMPK 3和AtMPK 6等[152-153]。III 型亚家族SnRK2蛋白(SnRK2.6/2.3/2.2)是拟南芥脱落酸信号转导过程中关键的正调控因子。这些激酶受脱落酸或渗透胁迫激活后,可磷酸化与胁迫相关的转录因子和离子通道,最终使植物免受高盐的危害[154]。有研究表明,野大麦的CIPK 蛋白(CBL-
interacting protein kinase ,CIPK )HbCIPK2对盐和渗透胁迫耐受性起正调节作用,HbCIPK2有助于阻止根中K +的丢失和Na +的积累,以便维持K +/Na +的动态平衡和细胞免于死亡[155]
。有研究结果表明,PLD α1(磷脂酶)D 衍生的磷脂酸(phosphatidic acid ,PA )与微管结合蛋白(microtubule-associated protein ,MAP )MAP65-1结合后,可调控微管的稳定及对盐胁迫的耐受性。MAP65-
1是PA 的一个靶蛋白,该研究揭示了在环境胁迫引起的信号转导过程中膜脂与细胞骨架之间的功能性联系
[156]。这722第12期张金林
等:高等植物适应盐逆境研究进展
822草业学报第24卷
一研究结果提出了植物中磷脂酸通过调控微管结合蛋白活性参与盐胁迫反应的新机制。
3.4细胞抗氧化相关基因
膜脂的过氧化导致细胞膜透性的增加是盐胁迫的主要危害之一。细胞膜本身具有选择透过性,表面具有多种离子运输与传递的蛋白,内部有多种抗氧化机制,因而可以抵制膜内不饱和脂肪酸的过氧化作用。目前发现,SOD、POD、GSH等是细胞内主要的抗氧化物质。它们本身可抑制氧自由基的产生,清除体内的活性氧。众多研究表明,植物体内某些基因的存在,对植物的抗氧化有重要作用。如:NtGST/GPX基因编码的酶既有谷胱苷肽-S-转移酶活性,又有谷光苷肽过氧化物酶活性,将该基因在烟草中过量表达,可以增强植物的耐盐性和耐寒性[157]。Kovtun等[158]将一种MAPKKK基因———ANP1基因转入烟草中发现,它可通过MAPK级联反应激活谷胱苷肽-S-转移酶基因(GST6)的表达,从而使植株表现出耐盐性。S-腺苷甲硫氨酸脱羧酶(S-adenosylmethionine decarboxy-lase,SAMDC)是多胺合成中的一个关键酶,SAMDC基因在烟草中过量表达可以增强植物对盐和其他非生物胁迫的抗性。维生素C是植物体必需的维生素之一,在光合电子传递、活性氧清除、氧化还原平衡调控、细胞分裂与生长、衰老与凋亡等生理过程中具有重要作用。在对拟南芥的研究中表明,拟南芥AtERF98是维生素C合成的关键转录调控因子,盐可以诱导AtERF98表达,而AtERF98突变显著抑制盐诱导的维生素C合成,并降低清除活性氧的能力,表现为盐敏感。这些结果表明,ERF类转录因子可通过调控抗氧化物质的合成来调节植物对盐胁迫的应答反应[159]。
4提高植物耐盐性的途径
提高植物耐盐性的途径有很多,其中包括抗盐锻炼,加入生长调节剂和培育耐盐新品种等。
4.1抗盐锻炼
植物耐盐能力常随生长发育时期的不同而异,且对盐分的抵抗力有一个适应锻炼过程。种子在一定浓度的盐溶液中吸水膨胀,然后再播种萌发,可提高作物生育期的耐盐能力。因此,在对植物进行抗盐锻炼时,可逐渐升高Na+浓度,从而提高植物的耐盐能力。用CaCl2浸种的玉米在盐胁迫下的叶绿素含量、细胞膜透性和根系活力的变化程度均小于水浸种,脯氨酸含量、干物质重高于水浸种,水势低于水浸种,提高了三叶期玉米的耐盐能力[160]。在低浓度钠盐处理下,夏枯草(Prunella vulgaris)种子的发芽率、发芽势、活力指数、根长、苗高以及鲜重都得到了显著提高[161]。
4.2加入生长调节剂
在很多情况下,植物对逆境胁迫的响应是通过改变内源激素的水平来实现的。如植物处于非生物逆境胁迫条件下会产生大量的ABA和乙烯(ethylene,Eth)等。生长素不仅调控植物的生长发育,也广泛参与逆境胁迫反应[162]。植物使用不同的策略来应对高盐土壤,植物可以调整自身的根系结构和根生长的方向来避免局部盐浓度过高的情况[163]。有一种模式就是通过盐度影响了植物激素在根系的分布,从而影响根生长。除了植物生长素(indole-3-acetic acid,IAA),细胞分裂素(cytokinin,CTK),乙烯和脱落酸也有相应的作用。植物生长素的运用可以通过促进侧根形成从而缓解渗透胁迫并不受ABA的影响,这表明这两种激素的行为独立地确定侧根原基的命运[164]。用植物激素处理植株,是常用的提高植物耐盐性的途径之一。例如,在含0.15%Na2SO4土壤中的小麦生长不良,但在播前用IAA浸种,可以抵消Na2SO4抑制小麦根系生长的作用,使小麦生长良好[165]。ABA是一种逆境激素,能诱导气孔关闭,减少蒸腾作用、减少盐的吸收,提高作物的耐盐能力,它普遍存在于高等植物中,在植物对逆境的适应中有着重要的作用[166]。此外,NO在植物耐受逆境中的作用尤其引人注意。如NO能显著缓解盐对盐地碱蓬种子萌发的抑制,外源NO供体硝普钠(sodium nitroprusside,SNP)能通过促进种子吸水以缓解盐的渗透胁迫来缓解盐胁迫下盐地碱蓬种子萌发[167]。并且SNP还可以缓解盐胁迫对蒺藜苜蓿(Medicago truncatu-la)种子萌发的抑制作用[168]。
4.3培育耐盐品种
随着植物分子生物学研究的深入、植物基因工程的发展、育种学的进步,培育耐盐的植物品种已经从普通的生理生化等表面的研究深入到了分子领域。现今,人们可以通过改造植物内部的基因、构建耐盐基因的载体和遗
传转化等方法进一步改良植株。如上文所述,利用高等植物耐盐相关基因培育耐盐作物品种将会成为未来研究的主要方向。此外有研究表明,植物的多倍体化同样可以使植物具有耐盐性,同时增强植物钾的积累
[169]。5展望
近年来对于作物的耐盐性研究发展迅速,但在很大程度上仍然停留在通过鉴定和利用拟南芥中已知的相应基因来进行耐盐性调控的水平。对水稻[64,170]和小麦[171-172]的研究已经指出了一条阐明作物特别是禾谷类作物
耐盐机制的研究方向,
但对作物的系统性研究仍然需要使用正向和反向遗传工具以及植物生理学、生物化学和分子生物学等手段。用正向遗传筛选作物盐敏感突变体从而确定作物中重要的耐盐基因仍然没有广泛开展,这种
方法将有助于找到新基因或特定的作物耐盐机制。可以相信,
拟南芥中未确定的某些机制,可能存在于作物中,特别是具有不同体系结构和组织构架的单子叶植物组织中。
由3种类型的Na +转运体调控的3种细胞水平耐盐机制(控制Na +吸收,增强Na +外排,提高Na +区域化)可以共同协调来提高植物的抗盐能力。然而,虽然在细胞水平上这3种Na +转运机制易于理解,但在整体植物中这些转运体在特定位置上的协调作用机制仍然没有完全搞清楚。因此,还需要在生理和分子水平上进一步研究来
确定这些转运体的组织和细胞定位以阐明其在抗盐中的相互协调功能。除此之外,
这些转运体在其他生物过程中的作用也有待于进一步研究。显而易见的是,这些转运体不仅仅对植物耐盐性很重要,而且还涉及其他的细胞
生理学过程,
这在拟南芥中已经得到证实;然而,除了耐盐性以外,这些转运体在作物中的其他作用还不是很清楚。对这些方面研究将会有助于我们估计过量表达这些转运体来增强植物耐盐性后所产生的潜在副作用。
盐生植物为阐明高等植物耐盐机制的研究提供了天然资源。利用亲缘关系密切的盐生植物和甜土植物以及比较基因组学研究方法将有助于阐明盐生植物耐盐性的遗传基础。Wu 等[150]的研究证明了这一结论,即利用比较基因组学方法来确定盐芥基因组和拟南芥基因组之间的差异以及其与盐胁迫反应和抗盐的关系,最终鉴定其
耐盐的分子机制。虽然比较基因组学的研究需要完整的基因组序列,
但可以预见的是,随着测序技术的迅速发展和相关成本的减少,
可供利用的基因组序列将会更加丰富。这种方法也可以用于鉴定自然变异种群中耐盐变种中的耐盐基因的变化,
这会在分子育种方面为作物的耐盐性遗传改良提供有价值的信息。此外,转录组学、蛋白质组学和表观遗传学等手段将加速盐生植物耐盐机制的研究和耐盐基因的大量挖掘。
References :
[1]Flowers T J.Improving crop salt tolerance.Journal of Experimental Botany ,2004,55:307-319.
[2]Kronzucker H J ,Coskun D ,Schulze L M ,et al .Sodium as nutrient and toxicant.Plant and Soil ,2013,369:1-23.
[3]Janz D ,Polle A.Harnessing salt for woody biomass production.Tree Physiology ,2012,32:1-3.
[4]Zhang J L ,Flowers T J ,Wang S M.Mechanisms of sodium uptake by roots of higher plants.Plant and Soil ,2010,326:45-60.[5]Zhao K F ,Li F Z ,Fan S J ,et al .Halophytes in China.Chinese Bulletin of Botany ,1999,16(3):201-207.
[6]Zhao K F.Plants adapt to salt adversity.Bulletin of Biology ,2002,37(6):7-10.
[7]Zhang J L ,Shi H Z.Physiological and molecular mechanisms of plant salt tolerance.Photosynthesis Research ,2013,115:1-22.[8]Munns R,Tester M.Mechanisms of salinity tolerance.Annual Review of Plant Biology ,2008,59:651-681.
[9]Zhu J K.Plant salt tolerance.Trends in Plant Science ,2001,6:66-71.
[10]Kronzucker H J ,Britto D T.Sodium transport in plants :a critical review.New Phytologist ,2011,189:54-81.
[11]Gorai M ,El A W ,Yang X ,et al .Toward understanding the ecological role of mucilage in seed germination of a desert shrub Heno-
phyton deserti :interactive effects of temperature ,salinity and osmotic stress.Plant and Soil ,
2014,374:727-738.[12]Wei Y ,Dong M ,Huang Z Y ,et al .Factors influencingseed germination of Salsola affinis (Chenopodiaceae ),a dominant annual
halophyte inhabiting the deserts of Xinjiang.Flora of China ,2008,203:134-140.
[13]Li Y ,Shen Y Y ,Yan S G.Comparative studies of effect of NaCl stress on the seed germination of 5forage species.Pratacultural
Science ,1997,14(2):50-53.
[14]Liang Y C.Effects of silicon on enzyme activity and sodium ,potassium and calcium concentration in barley under salt stress.Plant
and Soil ,1999,209:217-224.
[15]Trono D ,Flagella Z ,Laus M N ,et al .The uncoupling protein and the potassium channel are activated by hyperosmotic stress in mi-
tochondria from durum wheat seedlings.Plant Cell and Environment ,2004,27:437-448.
922第12期张金林等:高等植物适应盐逆境研究进展
[16]Becker D,Hoth S,Ache P,et al.Regulation of the ABA-sensitive Arabidopsis potassium channel gene GORK in response to water stress.Febs Letters,2003,554:119-126.
[17]Ottow E A,Brinker M,Teichmann T,et al.Populus euphratica displays apoplastic sodium accumulation,osmotic adjustment by de-creases in calcium and soluble carbohydrates,and develops leaf succulence under salt stress.Plant Physiology,2005,139:1762-1772.
[18]Song J,Ding X D,Feng G,et al.Nutritional and osmotic roles of nitrate in a euhalophyte and a xerophyte in saline conditions.New Phytologist,2006,171:357-366.
[19]Liu J,Cai H,Liu Y,et al.A study on physiological characteristics and cmparison of salt resistance of two Medicago sativa at the seeding stage.Acta Prataculturae Sinica,2013,22(2):250-256.
[20]Jarunee J,Kenjiusui,Hiroshi M.Differences in physiological responses to NaCl between salt-tolerant Sesbania rostrata Brem.and Obem.And non-tolerant Phaseolus vulgaris L.Weed Biology and Management,2003,3:21-27.
[21]Makela P,Karkkainen J,Somersalo S.Effect of glycinebetaine on chloroplast ultrastructure,chlorophyll and protein content,and RuBPCO activities in tomato grown under drought or salinity.Biologia Plantarum,2000,43:471-475.
[22]Leshem Y,Melamed B N,Cagnac O,et al.Suppression of Arabidopsis vesicle-SNARE expression inhibited fusion of H
2O
2
contai-
ning vesicles with tonoplast and increased salt tolerance.Proceedings of the National Academy of Sciences of the United States of A-merica,2006,103:18008-18013.
[23]Flowers T J,Colmer T D.Salinity tolerance in halophytes.New Phytologist,2008,179:945-963.
[24]Shabala S,Bose J,HedrichR.Salt bladders:do they matter.Trends in Plant Science,2014,19(11):687-691.
[25]Wang C M,Zhang J L,Liu X S,et al.Puccinellia tenuiflora maintains a low Na+level under salinity by limiting unidirectional Na+ influx resulting in a high selectivity for K+over Na+.Plant,Cell and Environment,2009,32:486-496.
[26]Ueda A,Yamamoto-Yamane Y,Takabe T.Salt stress enhances proline utilization in the apical region of barley roots.Biochemical and BiophysicalResearch Communications,2007,355:61-66.
[27]Wang C Q,Zhao J Q,Chen M,et al.Identification of betacyanin and effects of environmental factors on its accumulation in halo-phyte Suaeda salsa.Journal of Plant Physiology and Molecular Biology,2006,32(2):195-201.
[28]Md A H,Mst N A B,Yoshimasa N,et al.Proline and glycinebetaine enhance antioxidant defense and methylglyoxal detoxification systems and reduce NaCl-induced damage in cultured tobacco cells.Journal of Plant Physiology,2008,165:813-824.
[29]Incharoensakd A,Takabe T,A kazawa T.Effect of bteaine on enzyme activity and subunit internation of ribulose-1,5-bisphosphate carboxylase/oxygenas from Aphnothece halophytica.Plant Physiology,1986,81:1044-1049.
[30]DubeyRS,Singh A K.Salinity induces accumulation of soluble sugars and alters the activity of sugar metabolising enzymes in rice plants.Biologia Plantarum,1999,42:233-239.
[31]Shabala S,Shabala L.Ion transport and osmotic adjustment in plants and bacteria.Biomolecular Concepts,2011,2:407-419.[32]Demidchik V,Cuin T A,Svistunenko D,et al.Arabidopsis root K+-efflux conductance activated by hydroxyl radicals:single-chan-nel properties,genetic basis and involvement in stress-induced cell death.Journal of Cell Science,2010,123:1468-1479.[33]Teaklea N L,Bazihizina N,Shabala S,et al.Differential tolerance to combined salinity and O
2
deficiency in the halophytic grasses Puccinellia ciliata and Thinopyrum ponticum:The importance of K+retention in roots.Environmental and Experimental Botany,2013,87:69-78.
[34]Wang S M,Zhang J L,Flowers T J.Low-affinity Na+uptake in the halophyte Suaeda maritima.Plant Physiology,2007,145(2):559-571.
[35]Cuin T A,Bose J,Stefano G,et al.Assessing the role of root plasma membrane and tonoplast Na+/H+exchangers in salinity toler-ance in wheat:in planta quantification methods.Plant,Cell and Environment,2009,34:947-961.
[36]Schmidt U G,Endler A,Schelbert S,et al.Novel tonoplast transporters identified using a proteomic approach with vacuoles isolated from cauliflower buds.Plant Physiology,2007,145:216-229.
[37]Wu G Q,Xi J J,Wang Q,et al.The ZxNHX gene encoding tonoplast Na+/H+antiporter from the xerophyte Zygophyllum xanthox-ylum plays important roles in response to salt and drought.Journal of Plant Physiology,2011,168:758-767.
[38]Ma Q,Yue L J,Zhang J L,et al.Sodium chloride improves photosynthesis and water status in the succulent xerophyte Zygophyllum xanthoxylum.Tree Physiology,2012,32(1):4-13.
[39]Yue L J,Li S X,Ma Q,et al.NaCl stimulates growth and alleviates water stress in the xerophyte Zygophyllum xanthoxylum.Jour-nal of Arid Environments,2012,87:153-160.
[40]Wang S M,Zhu X Y,Shu X X.Studies on the characteristics of ion absorption anddistribution in Puccinellia tenuiflora.Acta Prat-aculturae Sinica,1994,3(1):39-43.
[41]Guo Q,Meng L,Mao P C,et al.Salt tolerance in two tall wheatgrass species is associated with selective capacity for K+over Na+.Acta Physiologiae Plantarum,2014,37:1708.
032草业学报第24卷
[42]Zhang J L ,Flowers T J ,Wang S M.Differentiation of low-affinity Na +uptake pathways and kinetics of the effects of K +on Na +up-
take in the halophyte Suaeda maritime .Plant and Soil ,
2013,368(1-2):629-640.[43]Zhu Z J ,Wei G Q ,Li J ,et al .Silicon alleviates salt stress and increases antioxidant enzymes activity in leaves of salt-stressed cu-
cumber (Cucumis sativus L.).Plant Science ,
2004,167:527-533.[44]Liang Y C ,Zhang W H ,Chen Q ,et al .Effects of silicon on H +-ATPase and H +-PPase activity ,fatty acid composition and fluidity
of tonoplast vesicles from roots of salt-stressed barley (Hordeum vulgare L.).Environmental and Experimental Botany ,2005,53:29-37.
[45]Gong H J ,Randall D P ,Flowers T J.Silicon deposition in the root reduces sodium uptake in rice (Oryza sativa L.)seedlings by re-
ducing bypass flow.Plant Cell and Environment ,
2006,29:1970-1979.[46]Ma J F ,Yamaji N ,Mitani N ,et al .An efflux transporter of silicon in rice.Nature ,2007,448:209-212.
[47]Wang X S ,Han J G.Effects of NaCl and silicon on ion distribution in the roots ,shoots and leaves of two alfalfa cultivars with differ-
ent salt tolerance.Soil Science and Plant Nutrition ,2007,53:278-285.
[48]Tuna A L ,Kaya C ,Higgs D ,et al .Silicon improves salinity tolerance in wheat plants.Environmental and Experimental Botany ,
2008,62:10-16.
[49]Chai Q ,Shao X ,Zhang J.Silicon effects on Poa pratensis responses to salinity.HortScience ,2010,45:1876-1881.
[50]Bose J ,Rodrigo-Moreno A ,Shabala S.ROS homeostasis in halophytes in the context of salinity stress tolerance.Journal of Experi-
mental Botany ,2014,65(5):1241-1257.
[51]Guan B ,Yv J B ,Lu Z H ,et al .Effects of water-salt stresses on seeding growth and activities of antioxidative enzyme of Suaeda salsa
in coastal wetlands of the yellow river delta.Environmental Science ,2011,32(8):2422-2429.
[52]Lu Y ,Lei J Q ,Zeng F J ,et al .Effects of salt treatments on the growth and ecophysiological characteristies.Acta Prataculturae Sini-
ca ,2014,23(3):152-159.
[53]Xue X D ,Dong X Y ,Duan Y X ,et al .A comparison of salt resistance of three kinds of Zoysia at different salt concentrations.Acta
Prataculturae Sinica ,2013,22(6):315-320.
[54]Ahmed I M ,Nadira U A ,Bibi N ,et al .Secondary metabolism and antioxidants are involved in the tolerance to drought and salinity ,
separately and combined ,in Tibetan wild barley.Environmental and Experimental Botany ,2015,111:1-12.
[55]Gao H J ,Yang H Y ,Bai J P ,et al .Ultrastructural and physiological responses of potato (Solanum tuberosum L.)plantlets to gradi-
ent saline stress.Frontiers in Plant Science ,2014,5:787.
[56]Talke I N ,Blaudez D ,Maathuis F J M ,et al .CNGCs :prime targets of plant cyclic nucleotide signalling.Trends in Plant Science ,
2003,8:286-293.
[57]Amtmann A ,Sanders D.Mechanism of Na +uptake by plant cells.Advances in Botanical Research ,1999,29:75-112.[58]Tyerman S D ,Skerrett I M.Root ion channels and salinity.Scientia Horticulturae ,1999,78:175-235.
[59]Zhang H F ,Wang S M.Advances in study of Na +uptake and transport in higher plants and Na +homeostasis in the cell.Chinese
Bulletin of Botany ,2007,24(5):561-571.
[60]Amtmann A ,Fischer M ,Marsh E L ,et al .The wheat cDNA LCT1generates hypersensitivity to sodium in a salt-sensitive yeast
strain.Plant Physiology ,
2001,126:1061-1071.[61]Kronzucker H J ,Szczerba M W ,Schulze L M ,et al .Non-reciprocal interactions between K +and Na +ions in barley (Hordeum vul-
gare L.).Journal of Experimental Botany ,2008,59:2793-2801.
[62]Deinlein U ,Stephan A B ,Horie T ,et al .Plant salt-tolerance mechanisms.Trends in Plant Science ,2014,19(6):371-379.[63]Zamani B M ,Ebrahimie E ,Niazi A.In silico analysis of high affinity potassium transporter (HKT )isoforms in different plants.A-
quatic Biosystems ,2014,10:9.
[64]Wang Q ,Guan C ,Wang P ,et al .AtHKT 1;1and AtHAK 5mediate low-affinity Na +uptake in Arabidopsis thaliana under mild salt
stress.Plant Growth Regulation ,
2015,75(3):615-623.[65]Ren Z H ,Gao J P ,Li L G ,et al .A rice quantitative trait locus for salt tolerance encodes a sodium transporter.Nature Genetics ,
2005,37:1141-1146.
[66]Laurie S ,Feeney K A ,Maathuis F J M ,et al .A role for HKT 1in sodium uptake by wheat roots.Plant Journal ,2002,32:139-
149.
[67]Kader M A ,Seidel T ,Golldack D ,et al .Expressions of OsHKT 1,OsHKT 2,and OsVHA are differentially regulated under NaCl
stress in salt-sensitive and salt-tolerant rice (Oryza sativa L.)cultivars.Journal of Experimental Botany ,2006,57(15):4257-4268.
[68]Shao Q ,Zhao C ,Han N ,et al .Cloning and expression pattern of SsHKT 1encoding a putative cation transporter from halophyte
Suaeda salsa .DNA sequence ,2008,19(2):106-114.
[69]Senn M E ,Rubio F ,Banuelos M A ,et al .Comparative functional features of plant potassium HvHAK 1and HvHAK 2transporters.132第12期张金林等:高等植物适应盐逆境研究进展
232草业学报第24卷
Journal of Biological Chemistry,2001,30:44563-44569.
[70]Fulgenzi FR,Peralta M L,Mangano S,et al.The ionic environment controls the contribution of the barley HvHAK1transporter to potassium acquisition.Plant Physiology,2008,147:252-262.
[71]Carden D E,Walker D J,Flowers T J,et al.Single-cell measurements of the contributions of cytosolic Na+and K+to salt toler-ance.Plant Physiology,2003,131:676-683.
[72]TakahashiR,Nishio T,Ichizen N,et al.Cloning and functional analysis of the K+transporter PhaHAK2from salt-sensitive and salt-tolerant reed plants.Biotechnol Letters,2007,29:501-506.
[73]Golldack D,Quigley F,Michalowski C B,et al.Salinity stress-tolerant and-sensitive rice(Oryza sativa L.)regulate AKT1-type po-tassium channel transcripts differently.Plant Molecular Biology,2003,51:71-81.
[74]Kim E J,Kwak J M,Uozumi N,et al.AtKUP1:An Arabidopsis gene encoding high-affinity potassium transport activity.Plant Cell,1998,10:51-62.
[75]Fu H H,Luan S.AtKUP1:a dual-affinity K+transporter from Arabidopsis.Plant Cell,1998,10:63-73.
[76]Zhang J L.Low-Affinity Na+Uptake and Accumulation in the Halophyte Suaeda maritina[D].Lanzhou:Lanzhou University,2008.[77]Shi H,Kim Y,Guo Y,et al.The Arabidopsis SOS5locus encodes a putative cell surface adhesion protein and is required for normal cell expansion.Plant Cell,2003,15(1):19-32.
[78]Shi H Z,Quintero F J,Pardo J M,et al.The putative plasma membrane Na+/H+antiporter SOS1controls long-distance Na+trans-port in plants.Plant Cell,2002,14:465-477.
[79]Wu G Q,Wang P,Ma Q,et al.Selective transport capacity for K+over Na+is linked to the expression levels of PtSOS1in halo-phyte Puccinellia tenuiflora.Functional Plant Biology,2012,39:1047-1057.
[80]Liu M,Wang T Z,Zhang W H.Sodium extrusion associated with enhanced expression of SOS1underlies different salt tolerance be-tween Medicago falcata and Medicago truncatula seedlings.Environmental and Experimental Botany,2015,110:46-55.
[81]Guo Q,Wang P,Ma Q,et al.Selective transport capacity for K+over Na+is linked to the expression levels of PtSOS1in halophyte Puccinellia tenuiflora.Functional Plant Biology,2012,39:1047-1057.
[82]Ma Q,Li Y X,Yuan H J,et al.ZxSOS1is essential for long-distance transport and spatial distribution of Na+and K+in the xero-phyte Zygophyllum xanthoxylum.Plant and Soil,2014,374:661-676.
[83]Feki K,Quintero F J,Khoudi H,et al.A constitutively active form of a durum wheat Na+/H+antiporter SOS1confers high salt tol-erance to transgenic Arabidopsis.Plant CellReports,2014,33(2):277-288.
[84]Nie W X,Xu L,Yu B J.A putative soybean GmsSOS1confers enhanced salt tolerance to transgenic Arabidopsis sos1-1mutant.Pro-toplasma,2015,252(1):127-134.
[85]Ishitani M,Liu J,Halfter U,et al.SOS3function in plant salt tolerance requires N-myristoylation and calcium binding.Plant Cell,2000,12(9):1667-1678.
[86]Martinez-Atienza J,Jiang X,Garciadeblas B,et al.Conservation of the salt overly sensitive pathway in rice.Plant Physiology,2007,143:1001-1012.
[87]GaxiolaRA,RaoR,Sherman A,et al.The Arabidopsis thaliana proton transporters,AtNHX1and AVP1,can function in cation detoxification in yeast.Proceedings of the National Academy of Sciences of the United States of America,1999,96:1480-1485.[88]Apse M P,Aharon G S,Snedden W A,et al.Salt tolerance confermi by over expression of a vacuolar NaCMC antiport in Arabidop-sis.Science,1999,285(12):1256-1258.
[89]Venema K,Quintero F J,Pardo J M,et al.The Arabidopsis Na+/H+exchanger catalyzes low affinity Na+and K+transport in re-constituted vesicles.Journal of Biological Chemistry,2002,277:2413-2418.
[90]Yamaguchi T,Fukuda-Tanaka S,Inagaki Y,et al.Genes encoding the vacuolar Na+/H+exchanger and flower coloration.Plant Cell Physiology,2001,142:451-461.
[91]Sottosanto J B,Gelli A,Blumwald E.DNA array analyses of Arabidopsis thaliana lacking a vacuolar Na+/H+antiporter:impact of AtNHX1on gene expression.Plant Journal,2004,40:752-771.
[92]Fukuda A,Nakamura A,Tanaka Y.Molecular cloning and expression of the Na+/H+exchanger gene in Oryza sativa.BBA-Gene Structure and Expression,1999,1446:149-155.
[93]Ohta M,Hayashi Y,Nakashima A,et al.Introduction of a Na+/H+antiporter gene from Atriplex gmelini confers salt tolerance to rice.FEBS Letters,2002,532:279-282.
[94]Fukuda A,Chiba K,Maeda M,et al.Effect of salt and osmotic stresses on the expression of genes for the vacuolar H+-pyrophos-phatase,H+-ATPase subunitA,and Na+/H+antiporter from barley.Journal of Experimental Botany,2004,55:585-594.
[95]Wu C A,Yang G D,Meng Q W,et al.The cotton GhNHX1gene encoding a novel putative tonoplast Na+/H+antiporter plays an important role in salt stress.Plant Cell Physiology,2004,45:600-607.
[96]Zorb C,Noll A,Karl S,et al.Molecular characterization of Na+/H+antiporters(ZmNHX)of maize(Zea mays L.)and their ex-
pression under salt stress.Journal of Plant Physiology ,2005,162:55-66.
[97]Brini F ,Gaxiola RA ,Berkowitz G A ,et al .Cloning and characterization of a wheat vacuolar cation /proton antiporter and pyrophos-
phatase proton pump.Plant Physiology and Biochemistry ,2005,43:347-354.
[98]Yu J N ,Huang J ,Wang Z M ,et al .An Na +/H +antiporter gene from wheat plays an important role in stress tolerance.Journal of
Biosciences ,
2007,32:1153-1161.[99]Yang Q C ,Wu M S ,Wang P Q ,et al .Cloning and expression analysis of a vacuolar Na +/H +antiporter gene from alfalfa.DNA se-
quece ,2005,16:352-357.
[100]Li W Y ,Wong F L ,Tsai S N ,et al .Tonoplast-located GmCLC 1and GmNHX 1from soybean enhance NaCl tolerance in transgenic
bright yellow (BY )-
2cells.Plant ,Cell and Environment ,2006,29:1122-1137.[101]Qiao W H ,Zhao X Y ,Li W ,et al .Overexpression of AeNHX 1,a root-specific vacuolar Na +/H +antiporter from Agropyron elon-
gatum ,confers salt tolerance to Arabidopsis and Festuca plants.Plant Cell Reports ,2007,26:1663-1672.
[102]Verma D ,Singla-Pareek S L ,Rajagopal D ,et al .Functional validation of a novel isoform of Na +/H +antiporter from Pennisetum
glaucum for enhancing salinity tolerance in rice.Journal of Biosciences ,
2007,32:621-628.[103]Li J Y ,He X W ,Xu L ,et al .Molecular and functional comparisons of the vacuolar Na +/H +exchangers originated from glyco-
phytic and halophytic species.Journal of Zhejiang University Science ,2008,9:132-140.
[104]Ye C Y ,Zhang H C ,Chen J H ,et al .Molecular characterization of putative vacuolar NHX-type Na +/H +exchanger genes from
the salt-resistant tree Populus euphratica .Physiologia Plantarum ,2009,137:166-174.
[105]Guan B ,Hu Y ,Zeng Y ,et al .Molecular characterization and functional analysis of a vacuolar Na +/H +antiporter gene
(HcNHX 1)from Halostachys caspica .Molecular Biology Reports ,2010,38:1889-1899.
[106]Jha A ,Joshi M ,Yadav N ,et al .Cloning and characterization of the Salicornia brachiata Na +/H +antiporter gene SbNHX 1and its
expression by abiotic stress.Molecular Biology Reports ,
2011,38:1965-1973.[107]Liu L ,Zeng Y ,Pan X ,et al .Isolation ,molecular characterization ,and functional analysis of the vacuolar Na +/H +antiporter
genes from the halophyte Karelinia caspica .Molecular Biology Reports ,2012,39:7193-7202.
[108]Yuan H J ,Ma Q ,Wu G Q ,et al .ZxNHX controls Na +and K +homeostasis at the whole-plant level in Zygophyllum xanthoxylum
through feedbackregulation of the expression of genes involved in their transport.Annals of Botany ,2015,115(3):495-507.
[109]Yin X Y ,Yang A F ,Zhang K W ,et al .Production and analysis of transgenic maize with improved salt tolerance by the introduc-
tion of AtNHX 1gene.Acta Botanica Sinica ,2004,46:854-861.
[110]Xue Z Y ,Zhi D Y ,Xue G ,et al .Enhanced salt tolerance of transgenic wheat (Tritivum aestivum L.)expressing a vacuolar Na +/
H +antiporter gene with improved grain yields in saline soils in the field and a reduced level of leaf Na +.Plant Science ,2004,167:849-859.
[111]He C ,Yan J ,Shen G ,et al .Expression of an Arabidopsis vacuolar sodium /proton antiporter gene in cotton improves photosynthetic
performance under salt conditions and increases fiber yield in the field.Plant Cell Physiology ,2005,46:1848-1854.
[112]Banjara M ,Zhu L ,Shen G ,et al .Expression of an Arabidopsis sodium /proton antiporter gene (AtNHX 1)in peanut to improve salt
tolerance.Plant Biotechnology Reports ,
2012,6:59-67.[113]Rajagopal D ,Agarwal P ,Tyagi W ,et al .Pennisetum glaucum Na +/H +antiporter confers high level of salinity tolerance in trans-
genic Brassica Juncea .Molecular Breeding ,2007,19:137-151.
[114]Shi L Y ,Li H Q ,Pan X P ,et al .Improvement of Torenia fournieri salinity tolerance by expression of Arabidopsis AtNHX 5.Func-
tional Plant Biology ,2008,35:185-192.
[115]Zhang G H ,Su Q ,An L J ,et al .Characterization and expression of a vacuolar Na +/H +antiporter gene from the monocot halo-
phyte Aeluropus littoralis .Plant Physiology and Biochemistry ,2008,46:117-126.
[116]Zhang Y M ,Liu Z H ,Wen Z Y ,et al .The vacuolar Na +-H +antiport gene TaNHX 2confers salt tolerance on transgenic alfalfa
(Medicago sativa ).Functional Plant Biology ,2012,39:708-716.
[117]Joshi M ,Jha A ,Mishra A ,et al .Developing transgenic Jatropha using the SbNHX 1gene from an extreme halophyte for cultivation
in saline wasteland.PLoS One ,
2013,8(8):e71136.[118]Mishra S ,Alavilli H ,Lee B H ,et al .Cloning and functional characterization of a vacuolar Na +/H +antiporter gene from mung-
bean (VrNHX 1)and its ectopic expression enhanced salt tolerance in Arabidopsis thaliana .PLoS One ,2014,9(10):e106678.
[119]Sarafian V ,Kim Y ,Poole RJ ,et al .Molecular cloning and sequence of cDNA encoding the pyrophosphate-energized vacuolar
membrance proton pump of Arabidopsis thaliana .Proceedings of the National Academy of Sciences of the United States of America ,1992,89:1775-1779.
[120]Gaxiola RA ,Palmgren M G ,Schumacher K.Plant proton pumps.FEBS Letters ,2007,581:2204-2214.
[121]Gao F ,Gao Q ,Duan X G ,et al .Cloning of an H +-PPase gene from Thellungiella halophila and its heterologous expression to im-
prove tobacco salt tolerance.Journal of Experimental Botany ,2006,57:3259-3270.
3
32第12期张金林等:高等植物适应盐逆境研究进展
432草业学报第24卷
[122]Guo S L,Yin H B,Zhang X,et al.Molecular cloning and characterization of a vacuolar H+-pyrophosphatase gene,SsVP,from the halophyte Suaeda salsa and its overexpression increases salt and drought tolerance of Arabidopsis.Plant Molecular Biology,2006,60:41-50.
[123]Li J,Yang H,Peer W A,et al.Arabidopsis H+-PPase AVP1regulates auxin-mediated organ development.Science,2005,310:121-125.
[124]Park S,Li J,Pittman J K,et al.Up-regulation of a H+-pyrophosphatase(H+-PPase)as a strategy to engineer drought-resistant crop plants.Proceedings of the National Academy of Sciences of the United States of America,2005,102:18830-18835.[125]Bao A K,Wang S M,Wu G Q,et al.Overexpression of the Arabidopsis H+-PPase enhanced resistance to salt and drought stress in transgenic alfalfa(Medicago sativa L.).Plant Science,2009,176:232-240.
[126]Li Z G,Baldwin M,Hu Q,et al.Heterologous expression of Arabidopsis H+-pyrophosphatase enhances salt tolerance in transgenic creeping bentgrass(Agrostis stolonifera L.).Plant Cell Environment,2010,33:272-289.
[127]SchillingRK,Marschner P,Shavrukov Y,et al.Expression of the Arabidopsis vacuolar H+-pyrophosphatase gene(AVP1)im-proves the shoot biomass of transgenic barley and increases grain yield in a saline field.Plant Biotechnology Journal,2014,12(3):378-386.
[128]Kumar T,Uzma,Khan MR,et al.Genetic improvement of sugarcane for drought and salinity stress tolerance using Arabidopsis vacuolar pyrophosphatase(AVP1)gene.Molecular Biotechnology,2014,56(3):199-209.
[129]Lv S L,Lian L J,Tao P L,et al.Overexpression of Thellungiella halophila H+-PPase(TsVP)in cotton enhances drought stress resistance of plants.Planta,2009,229:899-910.
[130]Pei L,Wang J,Li K,et al.Overexpression of Thellungiella halophila H+-pyrophosphatase gene improves low phosphate tolerance in maize.PLOS One,2012,7(8):e43501.
[131]Yao M,Zeng Y,Liu L,et al.Overexpression of the halophyte Kalidium foliatum H+-pyrophosphatase gene confers salt and drought tolerance in Arabidopsis thaliana.Molecular BiologyReports,2012,39:7989-7996.
[132]Khoudi H,Maatar Y,Gouiaa S,et al.Transgenic tobacco plants expressing ectopically wheat H+-pyrophosphatase(H+-PPase)gene TaVP1show enhanced accumulation and tolerance to cadmium.Journal of Plant Physiology,2012,169:98-103.
[133]Li X,Guo C,Gu J,et al.Overexpression of VP,a vacuolar H+-pyrophosphatase gene in wheat(Triticum aestivum L.),improves tobacco plant growth under Pi and N deprivation,high salinity,and drought.The Journal of Experimental Botany,2014,65(2):683-696.
[134]Zhao F Y,Zhang X J,Li P H,et al.Co-expression of the Suaeda salsa SsNHX1and Arabidopsis AVP1confer greater salt tolerance to transgenic rice than the single SsNHX1.Molecular Breeding,2006,17:341-353.
[135]Liu S P,Zheng L Q,Xue Y H,et al.Overexpression of OsVP1and OsNHX1increases tolerance to drought and salinity in rice.Journal of Integrative Plant Biology,2010,53:444-452.
[136]Brini F,Hanin M,Mezghani I,et al.Overexpression of wheat Na+/H+antiporter TNHX1and H+-pyrophosphatase TVP1improve salt-and drought-stress tolerance in Arabidopsis thaliana plants.Journal of Experimental Botany,2007,58:301-308.
[137]Bhaskaran S,Savithramma D L.Co-expression of Pennisetum glaucum vacuolar Na+/H+antiporter and Arabidopsis H+-pyrophos-phatase enhances salt tolerance in transgenic tomato.Journal of Experimental Botany,2011,62:5561-5570.
[138]Gouiaa S,Khoudi H,Leidi E O,et al.Expression of wheat Na+/H+antiporter TNHXS1and H+-pyrophosphatase TVP1genes in tobacco from a bicistronictranscriptional unit improves salt tolerance.Plant Molecular Biology,2012,79:137-155.
[139]Bao A K,Wang Y W,Xi J J,et al.Co-expression of xerophyte Zygophyllum xanthoxylum ZxNHX and ZxVP1-1enhances salt and drought tolerance in transgenic Lotus corniculatus by increasing cations accumulation.Functional Plant Biology,2014,41:203-214.
[140]Hu L,Lu H,Liu Q L,et al.Overexpression of mtlD gene in transgenic Populus tomentosa improves salt tolerance through accumu-lation of mannitol.Tree Physiology,2005,25:1273-1281.
[141]Liu Y,Wang G Y,Liu J J,et al.Transfer of E.coli gutD gene into maize and regeneration of salt-tolerant transgenic plants.Sci-ence in China Series C-Life Science,1999,42(1):90-95.
[142]Wang H Z,Huang D N,LuRF,et al.Salt tolerance of transgenic rice(Oryza sativa L.)with mtlD gene and gutD gene.Chinese Science Bulletin,2000,45:1685-1690.
[143]Kishor P B K,Hong Z,Mian G H.Over expression of△’-pyrroline-5-carboxylate synthetase increases proline production and con-fers osmotolerance in transgenic plants.Plant Physiology,1995,108:1387-1394.
[144]Dure L,Greenway S C,Galau G A.Developmental biochemistry of cottonseed embryogenesis and germination-changing messenger ribonucleic-acid populations as shown by in vitro and in vivo protein-synthesis.Biochemistry,1981,20(14):4162-4168.[145]Xu D,Duan X,Wang B,et al.Expression of a late embryogenesis abundant protein gene HVA1,from barley confers tolerance to water deficit and salt stress in transgenic rice.Plant Physiology,1996,110:249-257.
[146]Zhang N ,Wang D ,Si H J.Isolation and induced expression of betaine aldehyde dehydrogenase genefrom spinach.Journal of Agri-
cultural Biotechnology ,
2004,12(5):612-613.[147]Jia G X ,Zhu Z Q ,Chang F Q ,et al .Transformation of tomato with the BADH gene from Atriplex improves salt tolerance.Plant
Cell Reports ,
2002,21(2):141-146.[148]Tang N ,Zhang H ,Li X H ,et al .Constitutive activation of transcription factor OsbZIP46improves drought tolerance in rice.Plant
Physiology ,2012,158:1755-1768.
[149]Shinozaki K ,Yamaguchi-Shinozaki K.Gene expression and signal transduction in water stress response.Plant Physiology ,1997,
115:327-334.
[150]Wu H J ,Zhang Z H ,Wang J Y ,et al .Insights into salt tolerance from the genome of Thellungiella salsuginea .Proceedings of the
National Academy of Sciences ,2012,109(30):12219-12224.
[151]Taji T ,Seki M ,Satou M ,et al .Comparative genomics in salt tolerance between Arabidopsis and a Rabidopsis-related halophyte salt
cress using Arabidopsis microarray.Plant Physiology ,2004,135:1697-1709.
[152]Sheen J.Signal transduction in maize and Arabidopsis mesophyll protoplasts.Plant Physiology ,2001,127:1466-1475.
[153]Moon H ,Lee B ,Choi G ,et al .NDP kinase 2interacts with two oxidative stress-activated MAPKs to regulate cellular reduxstate
and enhances multiple stress tolerance in transgenic plants.Proceedings of the National Academy of Sciences ,2003,100(1):358-363.
[154]Xie T ,Ren R,Zhang Y Y ,et al .Molecular mechanism for inhibition of a critical component in the Arabidopsis thaliana abscisic
acid signal transduction pathways ,SnRK2.6,by protein phosphatase ABI 1.Journal of Biological Chemistry ,
2012,287:794-802.[155]Li RF ,Zhang J W ,Wu G Y ,et al .HbCIPK2,a novel CBL-interacting protein kinase from halophyte Hordeum brevisubulatum ,
confers salt and osmotic stress tolerance.Plant ,Cell and Environment ,2012,35:1582-1600.
[156]Zhang Q ,Lin F ,Mao T ,et al .Phosphatidic acid regulates microtubule organization by interacting with MAP65-1in response to salt
stress in Arabidopsis .Plant Cell ,
2012,24:4555-4576.[157]Roxas V P ,Lodhi S A ,Garrett D K ,et al .Stress tolerance in transgenic tobacco seedlings that overexpress glutathione S-transfer-
ase /glutathione peroxidase.Plant &Cell Physiology ,2000,41(11):1229-1234.
[158]Kovtun Y ,Chiu W L ,Tena G ,et al .Functional analysis of oxidative stress-activated mitogen-activated protein kinase cascade in
plants.Proceedings of the National Academy of Sciences of the United States of America ,2000,97:2940-2945.
[159]Zhang Z ,Wang J ,Zhang RX ,et al .The ethylene response factor AtERF98enhances tolerance to salt through the transcriptional
activation of ascorbic acid synthesis in Arabidopsis .The Plant Journal ,
2012,71:273-287.[160]Ge Y ,Gao P ,Xia J Z ,et al .The effects of calcium chloride on improving te salt resistance of Zea mays L.Journal of Northeast
Agicultural University ,
2004,35(3):281-284.[161]Zhang L X ,Chang Q S ,Hou X G ,et al .Effects of sodium salt stress on seed germination of Prunella vulgaris .Acta Prataculturae
Sinica ,
2015,24(3):177-186.[162]Qian Q ,Qu L J ,Yuan M ,et al .Research advances on plant science in China in 2012.Chinese Bulletin of Botany ,2013,48:
231-287.
[163]Galvan-Ampudia C S ,Testerink C.Salt stress signals shape the plant root.Current Opinion in Plant Biology ,2011,14:296-302.[164]Brady S M ,Sarkar S F ,Bonetta D ,et al .The abscisic acid insensitive 3(ABI 3)gene is modulated by farnesylation and is involved
in auxin signaling and lateral root development in Arabidopsis .Plant Journal ,2003,34:67-75.
[165]An J P ,Chen K S.The relations between the injury of plasma membrane and the increase of aba content in wheat leaves.Journal
of Lanzhou University (Natural Science ),
1994,3:127-131.[166]Iraudat J ,Parcy F ,Gosti F.Current advances in abseisic acid action and signaling.Plant Molecular Biology ,1994,26:1557-
1577.
[167]Yuan F ,Yang J C ,Chen M ,et al .Effect of no donor sodium nitroprusside (SNP )on seed germination of Suaeda salsa L.under
NaCl Stress.Plant Physiology Journa ,2010,46(1):24-28.
[168]Liu W Y ,Yang H W ,Wei X H ,et al .Effects of exogenous nitric oxide on seed germination ,physiological characteristics and ac-
tive oxygen metabolism of Medicago truncatula .Acta Prataculturae Sinica ,2015,24(2):85-95.
[169]Chao D Y ,Dilkes B ,Luo H ,et al .Polyploids exhibit higher potassium uptake and salinity tolerance in Arabidopsis .Science ,
2013,341:658-659.
[170]Horie T ,Costa A ,Kim T H ,et al .Rice OsHKT 2;1transporter mediates large Na +influx component into K +-starved roots for
growth.EMBO Journal ,
2007,26(12):3013-3014.[171]James RA ,Blake C ,Byrt C S ,et al .Major genes for Na +exclusion ,Nax 1and Nax 2(wheat HKT 1;4and HKT 1;5),decrease
Na +accumulation in bread wheat leaves under saline and waterlogged conditions.Journal of Experimental Botany ,
2011,62:2939-2947.
532第12期张金林等:高等植物适应盐逆境研究进展
632草业学报第24卷
[172]Byrt C S,Platten J D,Spielmeyer W,et al.HKT1;5-like cation transporter linked to Na+exclusion loci in wheat,Nax2and Kna1.Plant Physiology,2007,143:1918-1928.
参考文献:
[5]赵可夫,李法曾,樊守金,等.中国的盐生植物.植物学通报,1999,16(3):201-207.
[6]赵可夫.植物对盐渍逆境的适应.生物学通报,2002,37(6):7-10.
[13]李昀,沈禹颖,阎顺国.NaCl胁迫下5种牧草种子萌发的比较研究.草业科学,1997,14(2):50-53.
[19]刘晶,才华,刘莹,等.两种紫花苜蓿苗期耐盐生理特性的初步研究及其耐盐性比较.草业学报,2013,22(2):250-256.[40]王锁民,朱兴运,舒孝喜.碱茅离子吸收与分配特性研究.草业学报,1994,3(1):39-43.
[51]管博,于君宝,陆兆华,等.黄河三角洲滨海湿地水盐胁迫对盐地碱蓬幼苗生长和抗氧化酶活性的影响.环境科学,2011,32(8):2422-2429.
[52]鲁艳,雷加强,曾凡江,等.NaCl处理对梭梭生长及生理生态特征的影响.草业学报,2014,23(3):152-159.
[53]薛秀栋,董晓颖,段艳欣,等.不同盐浓度下3种结缕草的耐盐性比较研究.草业学报,2013,22(6):315-320.
[59]张宏飞,王锁民.高等植物Na+吸收、转运及细胞内Na+稳态平衡研究进展.植物学通报,2007,24(5):561-571.
[76]张金林.盐生植物海滨碱蓬Na+吸收和积累的研究[D].兰州:兰州大学,2008.
[146]张宁,王蒂,司怀军.菠菜甜菜碱醛脱氢酶基因的分离和诱导表达.农业生物技术学报,2004,12(5):612-613.
[160]葛瑛,高鹏,夏激宗,等.氯化钙在提高玉米抗盐性方面的作用.东北农业大学学报,2004,35(3):281-284.
[161]张利霞,常青山,侯小改,等.不同钠盐胁迫对夏枯草种子萌发特性的影响.草业学报,2015,24(3):177-186.
[162]钱前,瞿礼嘉,袁明,等.2012年中国植物科学若干领域重要研究进展.植物学报,2013,48:231-287.
[165]安建平,陈靠山.渗透胁迫下小麦的膜损伤与ABA增高的关系.兰州大学学报,1994,(3):127-131.
[167]袁芳,杨剑超,陈敏,等.NaCl胁迫下外源NO供体硝普钠(SNP)对盐地碱蓬种子萌发的影响.植物生理学通讯,2010,46(1):24-28.
[168]刘文瑜,杨宏伟,魏小红,等.外源NO调控盐胁迫下蒺藜苜蓿种子萌发生理特性及抗氧化酶的研究.草业学报,2015,24(2):85-95.
果树耐盐性研究进展
果树耐盐性研究进展 摘要:果树在长期的进化过程中,形成了丰富的遗传多样性,存在大量特异的 资源,蕴藏着珍贵的特有基因。加强对这些资源遗传多样性研究,挖掘有价值基因,阐明果树耐盐蛋白的功能及调控机制在科学研究上具有重要的意义。植物耐 盐性是一个受多基因控制的数量性状,克隆耐盐相关基因,通过遗传工程手段提 高果树的抗盐性,培育耐盐碱果树品种还有待进一步的努力。 关键词:果树;耐盐性;研究;进展 1 果树耐盐机制 1.1 渗透调节 盐胁迫下,果树的渗透调节主要通过积累无机离子和小分子有机物质实现的,特别是轻度和中度盐胁迫条件下主要由渗透调节作出响应,从而降低根际区土壤 水势。对积累无机离子获得渗透调节的果树来讲,排盐越有效,其主动渗透调节 的能力越差。参与果树渗透调节的无机离子主要有Na+、K+和Cl-,但这几种离子 在不同的果树中是不同的。有些果树选择K+而排除Na+,有些果树选择Na+而排 除K+。虽然盐胁迫可引起Cl-含量的增加,但有人认为Cl-是作为平衡Na+或K+电 荷的物质被动进入细胞内,对植物的渗透调节作用不大。果树体内积累更多的无 机离子将影响果实的品质,有机物质的积累显得更为重要。在果树中发现有多种 相溶性有机物质,如含N化合物(脯氨酸、甜菜碱、氨基酸、多胺)和糖类及其 衍生化合物等。这些相溶性物质可以维持细胞膨压,而且能稳定细胞中酶分子的 活性构象,保护酶免受盐离子的直接伤害,以及能量和N的利用库。 1.2 离子的选择 吸收盐土植物和淡土植物根系细胞质都不能忍受高浓度的盐,因此在盐条件 下这些植物或者是限制过多的盐进入(即拒盐),或者是把Na+离子分配到各个 不同组织中从而便利代谢功能(即分配原理)。限制过多的Na+进入到根系细胞 或者木质部的一种途径是维持一个最佳的细胞质K+/Na+比值。一般地,在轻度或 中度盐害条件下,拒盐是十分有效的,但是高盐条件下盐土植物通过分配原理抵 抗盐胁迫。拒盐是相对的,无论是耐盐还是盐敏感的果树,细胞内都含有一定浓 度的Na+。与植物拒盐性非常相关的是果树对离子的选择吸收。由Na+引起的K+ 吸收减少是众所周知的竞争过程。较高的K+/Na+选择性与柑橘的耐盐性有关。除 了离子的选择还可对离子比进行选择运输。盐胁迫下耐盐的油橄榄品种具有较高 的K+/Na+比,梢K+/Na+高于根K+/Na+。 1.3 离子区域化 盐胁迫下,果树吸收Na+、Cl-等离子必须累积于液泡中,否则会干扰细胞质 及叶绿体等细胞器中的生理生化代谢。盐分积累于液泡中是维持细胞质中高 K+/Na+的最有效机理之一。一个盐敏感的大麦品种细胞质中Na+离子水平是耐盐 品种的10倍。中度盐胁迫条件下,一些植物似乎对主要的离子(如K+、Ca2+、Mg2+和NO-3)产生选择性,将其分配到幼叶;在重度盐胁迫条件下,对NO-3没有吸收。盐离子区域化依赖离子的跨膜运输。 2 果树对盐胁迫的生理应答 2.1 细胞膜透性 膜系统是植物盐害的主要部位,细胞膜是感受逆境胁迫最敏感的部位之一。 葡萄、枣和苹果叶片的细胞膜透性均随NaCl胁迫浓度的升高而增大。发现水杨酸可以降低NaCl胁迫下阿月浑子叶片的电解质渗漏率,降低相对含水量以减轻盐害。
【优质文档】高级植物生理学专题复习题
2014 高级植物生理学专题复习题 一、将下列英文名词翻译成中文并用中文简要解释 phytochrome polyamines calmodulin Rubisico elicitor phytoalexin lectins systemin oligosaccharinaquaporin Phosphotidylinositol Osmotin 二、问答题 1. 举例说明突变体在植物生理学研究中的应用。2. 简述由茉莉酸介导的植物伤信号转导过程。3. 植物体内产生NO 形成途径主要有哪些?NO 在植物体内的生理作用怎样?4. 简述由水杨酸介导的植物抗病信号转导过程。5. 试论述在逆境中,植物体内积累脯氨酸的作用。6. 简述激光扫描共聚焦显微术在生物学领域的应用7. 什么是活性氧?简述植物体内活性氧的产生和消除机制。8. 植物抗旱的生理基础有哪些?植物如何感受干旱信号?9.盐胁迫的生理学基础有哪些?如何提高植物的抗盐性? 10.说明干旱引起气孔关闭的信号转导机制。 11.为什么在植物生理分子研究中选拟南芥、蚕豆、番茄作为模式植物? 12.试述植物对逆境的反应和适应机理(阐述1-2 种逆境即可) 13.简述高等植物乙烯生物合成途径与调节 (文字详述与详细图解均可14.以乙烯为例说明激素的信号转导过程。 15.什么是光呼吸与光抑制?简要阐明光合作用的限制因素(包括外界环境因素与植物本身 calcium messenger systym late embryogenesis abundent protein hypersensitive response pathogenesis-related protein induced systemic resistance heat shock protein calcium-dependent protein kinases mitogen-activated protein kinase laser scanning confocal microscopy Partial rootzone irrigation Original fluorescence yield Maximal fluoreseence yield photoihibition photooxidation photoinactivation photodamage photobleaching solarization
植物对盐胁迫的反应
植物对盐胁迫的反应 植物对盐胁迫的反应及其抗盐机理研究进展 杨晓慧1,2,蒋卫杰1*,魏珉2,余宏军1 (1.中国农业科学院蔬菜花卉研究所,北京100081;2.山东农业大学园艺科学与工程学院,山东泰安271018) REVIEW ON PLANT RESPONSE AND RESISTANCE MECHANISM TO SALT STRESS YANG Xiao-hui1,2,JIANG Wei-jie1*,WEI Min2,YU Hong-jun1( 1.Institute of Vegetables and Flowers,Chinese Academy of Agricultural Science,Beijing100081,China;2.College of Horticulture Science and Engineering,Shandong Agriculture University,Taian 271018,China) Key words:Iron stress,Osmotic stress,Salt resistant mechanism,Plant 摘要:本文从植物形态发育、质膜透性、光合和呼吸作用以及能量代谢等方面概述了盐胁迫下植物的生理生化反应,分析了盐害条件下离子胁迫和渗透胁迫作用机理以及植物的耐盐机制:植物小分子物质的积累、离子摄入和区域化、基因表达和大分子蛋白质的合成等,并简要综述了植物抗盐的分子生物学研究进展。 关键词:离子胁迫;渗透胁迫;耐盐机制;植物 中图分类号:S601文献标识码:A文章编号:1000-2324(2006)
盐胁迫对植物的影响
盐胁迫对植物的影响 植物的抗盐性: 我国长江以北以及沿海许多地区,土壤中盐碱含量往往过高,对植物造成危害。这种由于土壤盐碱含量过高对植物造成的危害称为盐害,植物对盐害的适应能力叫抗盐性。根据许多研究报道,土壤含盐量超过0.2%~0.25%时就会造成危害。钠盐是形成盐分过多的主要盐类,习惯上把硫酸钠与碳酸钠含量较高的土壤叫盐土,但二者同时存在,不能绝对划分,实际上把盐分过多的土壤统称为碱土。世界上盐碱土面积很大,估计占灌溉农田的1/3,约4×107ha,而且随着灌溉农业的发展,盐碱面积将继续扩大。我国盐碱土主要分布于西北、华北、东北和海滨地区,盐碱土总面积约2~7×107ha,而且这些地区都属平原,盐地土层深厚,如能改良盐碱危害,发展农业的潜力很大,特别应值得重视。 土壤盐分过多对植物的危害: 1.生理干旱:土壤中可溶性盐类过多,由于渗透势增高而使土壤水势降低,根据水从高水势向低水势流动的原理,根细胞的水势必须低于周围介质的水势才能吸水,所以土壤盐分愈多根吸水愈困难,甚至植株体内水分有外渗的危险。因而盐害的通常表现实际上是旱害,尤其在大气相对湿度低的情况下,随蒸腾作用加强,盐害更为严重,一般作物在湿季耐盐性增强。 2.离子的毒害作用:在盐分过多的土壤中植物生长不良的原因,不完全是生理干旱或吸水困难,而是由于吸收某种盐类过多而排斥了对另一些营养元素的吸收,产生了类似单盐毒害的作用。 3.破坏正常代谢:盐分过多对光合作用、呼吸作用和蛋白质代谢影响很大。盐分过多会抑制叶绿素生物合成和各种酶的产生,尤其是影响叶绿素-蛋白复合体的形成。盐分过多还会使PEP羧化酶与RuBP 羧化酶活性降低,使光呼吸加强。生长在盐分过多的土壤中的作物(棉花、蚕豆、番茄等),其净光合速率一般低于淡土的植物,不过盐分过多对光合作用的影响是初期明显降低,而后又逐渐恢复,这似乎是一种适应性变化。盐分过多对呼吸的影响,多数情况下表现为呼吸作用降低,也有些植物增加盐分具有提高呼吸的效应,如小麦的根。呼吸增高是由于Na+活化了离子转移系统,尤其是对质膜上的Na+、K+与A TP活化,刺激了呼吸作用。盐分过多对植物的光合与呼吸的影响尽管不一致,但总的趋势是呼吸消耗增多,净光合速度降低,不利于生长。 一、实验目的 盐胁迫对植物生长发育的各个阶段都有不同程度的影响,如种子萌发、幼苗生长、成株生长等。不同种类的植物受盐胁迫影响的程度也各不相同。本实验主要观察Na2CO3对小麦种子萌发过程的影响,探讨小麦种子在盐胁迫下的萌发特性,对小麦的耐盐能力做出了初步评价。通过实验了解盐胁迫对植物(种子萌发)的影响;掌握种子萌发过程中发芽率、发芽势、发芽指数、芽长、总长、芽重、总重等各项指标的观察和计算方法;各项指标在盐胁迫条件下的变化趋势,绘制盐浓度与生长指标相关曲线,并分析盐胁迫对种子萌发的影响。 二、仪器设备和材料 电子天平;培养皿(直径120mm),滤纸(直径125mm定量滤纸若干),500ml、200ml烧杯,250ml 容量瓶,10ml移液管,玻璃棒,镊子,毫米刻度尺,剪刀;次氯酸钠、碳酸钠;小麦种子等。 三、实验方法和步骤 1.预处理 (1)种子的预处理:用10%的次氯酸钠消毒10min,蒸馏水冲洗数次后,于培养皿中做发芽实验。
植物耐盐性研究进展3
第5卷第3期北华大学学报(自然科学版)Vol.5No.3 2004年6月JOURNAL OF BEIHUA UN IV ERSIT Y(Natural Science)J un.2004 文章编号:100924822(2004)0320257207 植物耐盐性研究进展 于海武1,李 莹2 (1.北京林业大学生物科学与技术学院,北京 100083;2.北华大学林学院,吉林吉林 132013) 摘要:综述了植物的耐盐机理和植物耐盐育种的研究情况,讨论了耐盐基因工程研究中存在的一些问题,并重点对现有植物的耐盐性筛选和抗渗透胁迫基因工程中的诱导渗透调节剂合成做了论述. 关键词:耐盐性;耐盐机理;基因工程;渗透调节剂 中图分类号:S332.6 文献标识码:A 盐碱土是陆地上分布广泛的一种土壤类型,约占陆地总面积的25%.在我国,从滨海到内陆,从低地到高原都分布着不同类型的盐碱土壤[1],我国盐碱土的总面积约有3000多万hm2,其中已开垦的有600多万hm2,还有2000多万hm2盐荒地等待开垦利用[1].此外,全国约有600多万hm2,约占耕地总面积10%的次生盐渍化土壤.盐碱土主要分布在平原地区,地形平坦,土层深厚,一般都有较丰富的地下水源,对发展农业生产,尤其对于实现农业机械化、水利化极为有利,是一类潜力很大的土壤资源.目前,人们主要通过2种方式来利用盐碱地:1是通过合理的排灌、淡水洗涤、施用化学改良药剂来改造土壤[2],为植物创造有利的生长环境.实践证明,这种方法成本高,效果也不理想;2是选育和培育耐盐植物品种来适应盐渍环境并最终达到改善环境的目的,此方法更加具有应用前景. 1 植物的耐盐机理 植物耐盐性差别很大.根据植物耐盐能力的不同,可将植物分成非盐生和盐生植物2类.赵可夫等又将盐生植物分为3类:真盐生植物、泌盐盐生植物和假盐生植物[1].目前大部分的耐盐性研究工作都是以真盐生植物为基础开展的,所以对它的耐盐机理也就研究得比较多.近年来,在筛选和培育耐盐细胞系、转移渗透调节剂合成基因、合理利用盐诱导基因等方面都开展了许多研究工作,并取得了一些成果.许多研究表明:植物要适应盐渍化的生境,必须具备克服盐离子毒害(离子胁迫)和抵抗低水势(渗透胁迫)的能力,否则就无法生存[3,4].马建华等认为:植物在高盐土壤中主要先受到水分胁迫,而后就是离子胁迫[5].所以在耐盐机理中人们对离子区隔化和渗透调节做了相对较多的研究. 1.1 离子区隔化 许多真盐生植物通过调节离子的吸收和区隔化来抵抗或减轻盐胁迫.在植物体内积累过多的盐离子就会给细胞内的酶类造成伤害,干扰细胞的正常代谢.研究表明,盐胁迫条件下,植物细胞中积累的大部分无机离子被运输并贮藏在液泡中,使得植物因为渗透势降低而吸收水分,同时,避免了过量的无机离子对代谢造成的伤害,这就是离子的区隔化.在耐盐植物和非耐盐植物中都存在离子区隔化,这说明离子区隔化可能是植物所普遍具有的能力[6].盐的区隔化作用主要是依赖位于膜上的“泵”实现离子跨膜运输完成的[7,8].这种运输系统需要A TP酶,A TP水解产生能量将H+“泵”到液泡膜外,造成质子电化学梯度,驱动钠离子的跨膜运输,从而实现盐离子的区隔化.Na+积累于液泡维持了细胞质中较低的Na+/K+比例也是植物耐盐的特点之一[9]. 收稿日期:2003212204 基金项目:国家“973”计划项目(G1999016005) 作者简介:于海武(1977-),男,在读硕士,主要从事杨树抗逆性育种研究.
高级植物生理学复习资料
1、共振传递:一个色素分子吸收光能被激发后,其中高能电子的振动会引起附近另一个分子中某个电子的振动(共振)。 2、激子传递:激子通常是指非金属晶体中由电子激发的量子,它能转移能量,但不能转移电荷。在由相同分子组成的聚光色素系统中,其中一个色素分子受光激发后,高能电子在返回原来轨道时也能释放出激子,此激子同样能使相邻色素分子激发,即把激发能传递给相邻色素分子。激发的电子可以相同的方式再放出激子,依次传递激发能。 3、受体:狭义概念:是细胞表面或亚细胞组分中的一种天然分子,可以识别并特异地与有生物活性的化学信号—配基结合,从而激活或启动一系列生物化学反应。广义概念:是指能够接受任何刺激(包括生物和非生物环境刺激等),并能产生一定细胞反应的生物大分子物质均称为受体。 4、它感作用:植物群生在一起,相互之间存在对环境生长因素,如光照、水肥的竞争和通过向周围环境释放有机化学物质,影响周围植物称为它感作用,也成为相生相克或异株克生作用。 5、它感化合物:也称克生物质,它感作用中把生物体产生的、能影响其它植物生长、健康、行为或群系关系的所有非营养物质统称为它感化合物。 6、量子产额:吸收一个光量子后所所释放的O 2的分子数或固定CO 2 的分子数,或光化学产物数。 7、花熟状态:当植物营养生长达到一定程度,即体内一些特殊物质积累达到一定量时,即产生对开花诱导条件能够发生反应状态,即为花熟状态。 8、光周期诱导:一定适宜的日照条件(光周期)诱导花熟状态的植物启动开花反应的现象。 9、光周期反应:植物能够接受一定适宜的日照条件(光周期)后体内进行花反应的生理现象。 10、开花:成花反应完成(叶原基转向花原茎),植物开花的现象。 11、临界夜长:昼夜周期中短日植物能开花的最小暗期长度或长日照植物能够开花的最大暗期长度。 12、临界日长:指昼夜周期中能诱导植物开花所需的最低或最高的极限日照长度。 13、根系提水作用:是指土壤表层干旱的条件下,当植物蒸腾作用降低时,处于深层湿润土壤中的根系吸收水分,并通过输导组织运至浅层根系进而释放到周围干燥土壤中的现象。 14、被动吸水:常称为“蒸腾拉力吸水”,是指叶片因蒸腾失水而造成与维管束系统一个连续的水势差而产生的使导管中水分上升的一种吸水形式,是植物水分吸收的主要形式。 15、协助扩散:是小分子物质经膜转运蛋白,顺浓度梯度或电化势梯度跨膜的转运,不需要细胞提供代谢能量。 16、空化现象:虽然水分子之间存在内聚力,但木质部中的水柱也有可能被其间的气泡所阻塞,导致水流中断的现象。 17、源:指制造营养并向其它器官提供营养的部位或器官,主要是指成熟的叶片。 18、库:指消耗养料和贮藏养料的器官,如生殖器官、干物质贮藏器官等。 19、活性氧:是指氧在还原过程中产生的、氧化性极强的一类中间产物的统称。 20、呼吸链电子漏:当电子由呼吸链的辅酶Q裂解出来,在细胞色素系统进行传递过程中,部分电子也会发生“泄露”现象,泄露的电子并使氧的单价还原的形式生成超氧阴离子自由基,这种现象称为呼吸链电子漏。 21、伤呼吸:植物在受伤后,伤处细胞呼吸均明显的增强,把这种呼吸习惯称为伤呼吸。 22、信号转导:植物细胞通过膜上的受体细胞感受和接受外界的各种刺激,并将这种刺激通过胞内各种转导
植物盐胁迫及其抗性生理研究进展解读
植物盐胁迫及其抗性生理研究进展 李艺华1罗丽2 (1、漳州华安县科技局华安 363800 2、福建农林大学园艺学院福州 350002 摘要:盐胁迫是制约农作物产量的主要逆境因素之一。本文综合了几年来植物盐胁迫研究的报道,对盐胁迫下植物生理生化和生长发育变化、植物自身生理系统的响应以及增强植物抗盐胁迫的方法进行综述和讨论。 关键词:植物抗盐胁迫生理 中图分类号:Q945.7 文献标识码:A 文章编号:1006—2327—(200603—0046—04 盐胁迫是目前制约农作物产量的主要逆境因素之一[1],既有渗透胁迫又有离子胁迫[2]。随着土壤盐渍化面积的扩展,许多非盐生植物因受盐胁迫而导致产量和品质的快速下降,已成为中国西北部和沿海地区迫切解决的难题。迄今,植物盐胁迫这方面有较多的研究报道,多数侧重于某一植物或是植物某一生长阶段耐盐胁迫性与抗盐胁迫性的研究,缺少对植物抗盐胁迫有一个较为系统的综合阐述。鉴于植物抗盐胁迫的研究面的广泛性和分散性,本文综合了几年来抗盐胁迫研究报道,对植物抗盐胁迫的生理机制做一个综合阐述,为阐明植物对盐胁迫的反应机制提供一个较系统的理论依据。 1 盐胁迫对植物生理生化和生长发育的影响 盐胁迫对植物生理生化的影响可分为三方面:离子毒害、渗透胁迫和营养亏缺。离子毒害作用包括过量的有毒离子钠和氯对细胞膜系统的伤害,导致细胞膜透性的增大,电解质的外渗以及由此而引起的细胞代谢失调;渗透胁迫是由于根系环境中盐分浓度的提高、水势下降而引起的植物吸水困难;营养亏缺则是由于根系吸收过程中高浓度Na和Cl 离子存在,干扰了植物对营养元素K、Ca和N的吸收,造成植物体内营养元素的缺乏,影响植物生长发育[1]。大量试验结果表明,盐胁迫不同程度地影响植物的光合作用、呼吸作用和渗透作用,影响植物的同、异化功能[3],当盐
盐碱土现状及植物耐盐性研究的意义
1 盐碱土现状及植物耐盐性研究的意义 盐碱土是民间对盐土和碱土的统称。土壤含盐量在0.1%-0.2%以上,或者土壤胶体吸附一定数量的交换性钠,碱化度在15%-20%以上,对作物的正常生长产生严重影响,这样的土属于盐碱土,盐碱土又称盐渍土。在亚洲、非洲和北美西部地区有不同程度的分布,是一种重要的土地资源。按照形成原因,盐碱土包括原生盐渍化土地和次生盐渍土。据不完全统计,全世界大约有9.5亿公顷盐碱地[1-2]。由于世界范围内环境问题日益加剧,未经处理的工业废水乱排,工业垃圾废料不规范的堆积,世界范围内乱砍滥伐普遍存在,原始森林和原始湿地破坏严重,全球气候日趋异常;在农业生产中,节水农业尚未普及,大水漫灌等浇灌方式依然流行,在许多发展中国家,为了增加片面增加土地的单位面积产量,不合理的使用化肥,诸多自然或人为因素,导致世界范围内的次生盐渍土地日益增多,农业的可持续发展受到严重抑制[3-6]。中国的盐碱地主要分布在华北、东北和西北的内陆干旱、半干旱地区,东部沿海的滨海地区也有分布。世界人口逐年增多,可供耕地则因人为的不合理利用以及自然灾害频发而日渐减少,人均可耕地面积更是呈直线下降。然而,与此同时,世界范围内大面积的盐碱地仍未得到有效的利用。对盐碱地的综合开发利用日益走入人们的视野,人们试图从农业、化学、生物等方向对盐碱土地进行开发利用。依据改良措施的不同,对于盐碱地的开发利用可以取得不同的效果。改良盐土可以通过排水、洗盐等措施,或用种植绿肥、施有机肥或种水稻等农作物对其盐进行改良。这些方法对盐碱土的改良虽然有一定的效果,但是效果不稳定,并且在实践应用中,大量的人力、物力以及财力的投入无形中极大增加了该项措施的成本[7]。这种方法治标却不能治本。通过引种盐土植物,培育新的耐盐品种,利用盐生植物对盐碱土壤的改良作用,这种方式称为生物措施。生物措施可以将盐碱土中的盐分、离子富集在植物体中,从而从根本上解决盐碱土上植物无法正常生长的现状,选择适当的经济作物,既可以获得可观的经济效益,还能绿化环境,获得生态效益。 由于盐渍化会降低作物的发芽率,普通作物在盐碱条件下难以生长存活,因此耐盐碱作物的引进及品种的培育,成为当前研究的热点[8]。种植植物可以增加盐碱地的植被覆盖面积,减少土壤水分蒸发,降低土壤盐分;另外利用某些植物
高级植物生理学03温度胁迫
低温胁迫 低温程度和植物受害情况,可分为冷害(chilling),指作物在它生长所需的适温以下至冰点以上温度范围内所发生的生长停滞或发育障碍现象;冻害(freezing),指冰点以下低温对植物生长发育的影响。 一、低温的伤害: 膜伤害:目前普遍认为细胞膜(特别是质膜和类囊体膜)系统是植物受低温伤害的初始部位,低温处理后膜相对透性以及膜上各组分的变化, 是衡量植物抗冷性的一个指标。若温度缓慢降至零下,能引起细胞外冰晶积累,造成机械性胁迫和细胞内次生干旱等复杂变化。 膜脂相变:细胞膜系统是低温冷害作用的首要部位, 温度逆境不可逆伤害的原初反应发生在生物膜系统类脂分子的相变上。膜脂从液晶相变成凝胶相,膜脂上的脂肪酸链由无序排列变为有序排列,膜的外形和厚度发生变化,膜上产生皲裂,因而膜的透性增大,离子大量外泻,因而电导率有不同程度的增大。脂脂肪酸的不饱和度或膜流动性与植物抗寒性密切相关。膜脂肪酸成份(饱和和非饱和脂肪)酸和膜透性 膜脂过氧化:植物在低温胁迫下细胞膜系统的损伤可能与自由基和活性氧引起的膜脂过氧化和蛋白质破坏有关。MDA含量可以作为低温伤害程度以及植物抗冷性的一个生理指标。 乙烷。植物在正常条件下几乎不产生乙烷,在逆境条件下细胞遭到破坏时乙烷大量产生。一般认为乙烷是由不饱和脂肪酸(亚麻酸)及其过氧化物通过自由基反应生成的,所以乙烷的产生与膜脂过氧化密切相关,其产量与膜透性呈正相关,可作为膜破坏的指标。 乙烯???当植物处于逆境条件时,乙烯生成增加,被称为逆境乙烯或应激乙烯,其量比正常条件下的乙烯量高2~50倍。乙烯主要由受刺激而未死亡的细胞产生,其生物合成也是遵循:蛋氨酸→腺苷蛋氨酸(SAM)→ACC→乙烯途径。也有人报道逆境乙烯也可由亚麻酸过氧化作用产生。但在植物体内很难将各种途径产生的乙烯区分开来,因此乙烯的释放不能作为一种表示膜脂过氧化的指标。 细胞骨架是(植物中主要是指微管和微丝)。与细胞运动、能量转换、信息传递、细胞分裂、基因表达及细胞分化等生命活动都密切相关。低温直接毁坏了细胞骨架,使细胞质基质结构紊乱,进而破坏细胞的代谢系统及其中物质的运输。不同耐寒性植物的微管对低温的反应有着显著差异。不耐寒植物的微管对低温敏感,而抗寒植物其微管具有抗寒性,其冷稳定性与植物种类抗寒性成正相关,抗寒锻炼后,抗寒植物的微管其冷稳定性提高。 光合作用:温胁迫对植物光合色素含量、叶绿体亚显微结构、光合能量代谢及PS活性等一系列重要的生理生化过程都有明显影响。对于亚热带起源的低温敏感植物,当温度稍低于其最适生长温度时,即表现出净光合速率的下降。当温度降至引起冷害的临界温度时,光合作用显示出强烈的抑制。光合机构的光破坏在很多情况下是由过剩光能产生的活性氧引发的(引发光氧化损害的两类活性氧是米勒反应产生的超氧阴离子O和单线态氧’O2。
植物对盐胁迫的反应及其抗盐机理研究进展
山东农业大学学报(自然科学版),2006,37(2):302~305 Journa l of Shandong Agricu lt ura lUn i versity(Natura l Sc i ence) 文#献#综#述 植物对盐胁迫的反应及其抗盐机理研究进展 杨晓慧1,2,蒋卫杰1*,魏珉2,余宏军1 (1.中国农业科学院蔬菜花卉研究所,北京100081;2.山东农业大学园艺科学与工程学院,山东泰安271018) REV IE W ON PLANT RESPONSE AND RE SISTANCE M ECHAN IS M TO S ALT STRESS YANG X i a o-hu i1,2,JI A NG We i-jie1*,WE IM i n2,Y U H ong-jun1 (1.I n stitute ofV egetab l es and Flo wers,Ch inese A cade m y ofAgricu l tural Sci ence,Beijing100081,Ch i na; 2.Coll ege ofH orti cu lt u re Science and Engi n eeri ng,Shandong Agricu l tureU n i versit y,Ta i an271018,Ch i na) K ey words:Iron stress,Os motic stress,Salt resistantm echan i s m,Plant 摘要:本文从植物形态发育、质膜透性、光合和呼吸作用以及能量代谢等方面概述了盐胁迫下植物的生理生化反应,分析了盐害条件下离子胁迫和渗透胁迫作用机理以及植物的耐盐机制:植物小分子物质的积累、离子摄入和区域化、基因表达和大分子蛋白质的合成等,并简要综述了植物抗盐的分子生物学研究进展。 关键词:离子胁迫;渗透胁迫;耐盐机制;植物 中图分类号:S601文献标识码:A文章编号:1000-2324(2006)02-0302-04 1植物对盐胁迫的反应 1.1盐胁迫对植物形态发育的影响 盐胁迫对植物个体形态发育的整体表现为抑制组织和器官的生长,加速发育过程,缩短营养生长和开花期。P laut等(1985)研究发现,90mmol/L NaC l胁迫抑制甜菜块根的干物质积累,但低浓度NaC l可增加叶面积。Nunes(1984)认为这主要是细胞体积增加而不是细胞分裂的结果。盐分对佛手瓜的生长及腋芽的萌动均有抑制作用,幼苗的生长速度与中期细胞指数的变化具有一致性,说明盐分影响植物生长的途径是通过细胞的有丝分裂来完成的[2]。在NaC l胁迫(0.1%、0. 2%、0.3%、0.4%)条件下,马铃薯试管苗生长受到显著抑制,且随着盐浓度的增加,各处理间差异加大[3]。戴伟民等[4]研究发现,随盐浓度的增加,番茄幼苗的下胚轴粗度、侧根数逐渐减少,根干重逐渐降低。根据牟永花的研究,50、100mm ol/L NaC l使番茄株高和干物质积累均有不同程度的降低,但对根冠比无影响[5]。用25、50mmol/L NaC l处理黄瓜幼苗,发现植株株高、鲜重和干重均降低[6]。杨秀玲等[7]也发现,随着N aC l浓度(75、100、125、150mm ol/L)的增高,黄瓜幼苗地上和地下部鲜重以及根冠比(R/T)也均表现为下降。 1.2盐胁迫对植物生理生化代谢的影响 1.2.1水分平衡与质膜透性Levltt在1980年即指出,不同环境胁迫作用于植物时都会发生水胁迫。在盐胁迫下,植物细胞脱水,膜系统破坏,位于膜上的酶功能紊乱,各种代谢无序进行,导致质膜透性的改变。而且,高浓度NaC l可置换细胞膜结合的Ca2+,使膜结合Na+增加,膜结构和功能破坏,细胞内的K+、磷和有机溶质外渗。 1.2.2光合作用盐胁迫下,植物组织因缺水而引起气孔关闭,叶绿体受损,光合相关酶失活或变性,光合速率下降,同化产物合成减少。叶绿体是植物光合作用的主要场所,而类囊体膜是光能吸收、传递和转换的结构基础,植物进行光能吸收、传递和转换的各种色素蛋白复合体都分布在类囊体膜上。盐胁迫下,过量盐离子积累使类囊体膜糖脂含量显著下降,不饱和脂肪酸含量降低,而饱和脂肪酸含量升高,从而影响细胞膜的光合特性。叶绿素是类囊体膜上色素蛋白复合体的重要组成部分,所以盐胁迫下叶绿素含量的降低必将影响色素蛋白复合体的功能,使垛叠状态的类囊体膜比例减小,叶绿体中基粒数量和质量下降,光合强度降低[8]。 R ub isco(核酮糖-1,5-二磷酸羧化酶)和PEP(磷酸烯醇式丙酮酸)羧化酶是光合作用的两种重要酶。盐胁迫下,收稿日期:2005-06-25 基金项目:基金项目:国家863项目(2004AA247030,2004AA247010);国家科技攻关项目(2004BA521B01);农业部蔬菜遗传与生理重点开放实验室项目. 作者简介:杨晓慧(1980-),女,硕士研究生,从事设施园艺与无土栽培. *通讯作者:Aut hor f or correspo ndence.E-m a i:l ji ang w@j m ai.l https://www.wendangku.net/doc/d517865616.html,
作物耐盐性研究
作物耐盐性研究 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
作物耐盐性状研究进展 l 耐盐性含义和耐盐机制种类 由于土壤中可溶性盐类过量对作物造成的盐害,称为盐害或盐胁迫,包括渗透胁迫和离子效应两种类型。前者由于土壤中可溶性盐过多,土壤渗透势增高而水势降低,造成作物的吸水困难,即生理干旱;后者由于离子的拮抗作用,吸收盐类过多而排斥了对另一些营养元素的吸收,影响正常的代谢作用。作物对盐害的耐性称为耐盐性,把碳酸钠与碳酸氢钠为主的土壤称为碱土,把氯化钠与硫酸钠为主的土壤称为盐土,实际上难以绝对划分,把盐分过多的土壤称为盐碱土,简称盐土,相应的对耐盐碱性称为耐盐性[1]。 耐盐机制可分为6种:拒盐型、聚盐型、泌盐型、稀盐型、避盐型、活性氧清除等[2]。⑥有活性氧清除系统的植物通过SOD(超氧化物歧化酶)、POD(过氧化物酶)、CAT (过氧化氢酶)将活性氧清除出去,免受盐胁迫 一般盐土含盐量在%~%时就已对植物生长不利,而盐土表层含盐量往往可达%~10%。 丙二醛时植物器官在逆境条件下发生膜脂过氧化作用的产物,可用于表示植物对逆境条件反应的强弱,从实验中也可证明小麦幼
苗叶片中MDA含量随NaCl浓度的增加而增加,说明高浓度盐对植物生长产生了严重的伤害。 。 2 耐盐性的鉴定技术和指标 耐盐鉴定技术有直接鉴定法,如发芽鉴定(发芽率、发芽势)、形态鉴定(出苗率、盐害级别、苗期死叶率、相对生长量)和产量鉴定等;间接法有脯氨酸、甜菜碱、糖醇、多胺物质、钠钾离子含量的测定和酶活性的测定以及花粉萌发试验等。按照耐盐试验的地点分为水培、盐池、重盐碱大田。耐盐实验的对象又可分为群体、个体和单株和细胞。品种耐盐指标:耐盐系数、耐盐力(生物耐盐力、农业耐盐力)[4]。 群体耐盐指标:发芽率、发芽势、盐害指数、成活苗率、相对成活苗率。目前,国内学术界一般把土壤基质含盐量达0.4%作为棉花耐盐鉴定的通用浓度[5]。叶武威等[6]采用盐池鉴定法,统计各材料在施盐10 d后(3叶期)的相对成活苗率(以生长点活为标准)来判断棉花的耐盐性,将棉花的耐盐性分为4级,即不耐(0-49.9%)、耐(50.0%一74.9%)、抗(75.0%一89.9%)、高抗(>90%)。 3 对耐盐机制的研究
盐分胁迫对植物生长和生理影响
盐分胁迫对植物生长生理的影响 张华新,刘正祥等研究了光叶漆、银水牛果等11种树种后发现,盐胁迫后,各树种的苗高生长量下降、生物量累积减少,且随着处理浓度的增加均呈下降趋势,,各树种的根冠比值增大1 王润贤,周兴元,葛晋纲等人对草的研究后发现,在草坪草适应范围之内,根系活力和蛋白质含量呈先升后降的趋势,如超过忍受范围则持续下降。随盐分胁迫强度的增加和胁迫时间的延长,草坪草叶片的WSD上升,脯氮酸含量均表现为先升后降的趋势,但因胁迫程度和草种的不同,其峰值和下降幅度有较大差异。各项生理指标变化的趋势因草种的不同而有较大的差异,与其耐盐性有关,可以作为判定草坪草抗盐能力的评定依据。2 孙方行,李国雷对刺槐进行3天和17天盐胁迫处理后发现,MDA含量和细胞膜透性存在极显著正相关。叶绿素浓度和可溶性蛋白含量也存在极显著关。SOD活性和叶绿素浓度成负相关。从逐步回归分析可以看出细胞膜透性是影响高生长的主要指标3 张金香,钱金娥等人发现,经过前处理的1/2海水区中生长的苗木其叶、茎、根的生长量均超过淡水区中生长的苗木。说明一定程度的耐盐锻炼能够增强苗木对盐碱、干旱环境的适应能力4 张士功,高吉寅,宋景芝发现,6-苄基腺嘌呤、水杨酸、阿斯匹林,硝酸钙能够在一定程度上限制幼苗对Na+的吸收,阻滞其向地上部分运输的数量和速度。提高体内K+含量、向上运输效率,降低地上部分对Na+、K+的选择性(SNa+、K+>,同时6-苄基腺嘌呤还能够促进幼苗根系对Cl-的吸收,并有效地将Cl-限制在根部,阻滞Cl-向上运输,相对降低地上部分的Cl,这些都有利于
提高小麦幼苗抗盐性和对盐分胁迫的适应性5 王强,石伟勇,符建荣,指出,叶面喷施海藻液肥能提高黄瓜根冠比和干物质含量,提高根系总吸收面积和活跃吸收面积。不同浓度的海藻液肥均能降低盐胁迫对叶片质膜的伤害,提高SOD、POD等酶的活性,降低膜脂过氧化产物MDA的积累,提高脯氨酸、可溶性糖、可溶性蛋白等渗透调节物质的含量6 许兴,郑国琦.等指出,在等渗条件下,NaCl胁迫引起的小麦叶片组织含水量的下降、胁迫伤害率的增大及叶片和根部的脯氨酸、可溶性糖、Na+、K+含量的增加,均大于PEG胁迫引起的变化7 郑国琦,许兴,徐兆桢研究了盐分胁迫对植物的伤害和探讨了植物的耐盐的生物学机理以及通过基于改良作物耐盐性的研究进程。8 吴忠东,王全九.研究发现,在不同的生育期降水量条件下,冬小麦对盐分胁迫有着不同的响应。生育期一般年和湿润年可以采用的最高矿化度为3 g/L,而在生育期偏旱年,如果不采取其他措施的条件下,可以采用的最高矿化度为2 g/L,该结果为合理开发利用当地的地下咸水资源提供了一定的依据。9 郭淑霞,龚元石在研究盐分胁迫对菠菜生长和吸氮量的影响后发现,对菠菜进行盐分胁迫,前 44 天,随着盐分胁迫程度增加,菠菜相对生长速率 第十一章植物的逆境生理 一、名词解释 1.CaM 2.渗透调节与逆境蛋白 3.耐逆性与御逆性 4.植物对逆境的耐性与御性 5.逆境蛋白 6.活性氧清除系统 7.膜脂相变 8.热激反应与热激蛋白 9.活性氧 10.交叉适应 二、填空 1.用来解释干旱伤害机理的假说主要是__________和_________。 2.根据所含金属元素的不同,SOD可以分三种类型:______、______和____。 3.干旱条件下,植物为了维持体内水分平衡,一方面要________,另一方面要_______。 4.干旱条件下,植物体内大量积累的氨基酸是________,大量产生的激素是______;低温锻炼后,植物体内________脂肪酸和_______水的含量增 多。 5.植物体活性氧清除系统包括________和________两种系统。 6.植物受到干旱等逆境胁迫时,渗透调节能力增强,细胞主动合成的有机溶剂是_________、________和__________。 7.在逆境下,植物体内主要有_______、_______、_______、_____等渗透调节物质。 8.经过抗寒锻炼的植物会发生的变化有: A 双硫键增加 B 自由水增加 C 膜脂双键增加 三、选择题 1.冬季植物体内可溶性糖的含量()。 A.增多 B. 减少 C.变化不大 D. 不确定 2.干旱条件下,植物体内哪一种氨基酸显著增加?() A. 丙氨酸 B.脯氨酸 C. 天冬氨酸 D. 甘氨酸 3.植物细胞中属于相容性物质的是: A、Ca B、ABA C、Pro 4. 植物抗盐的SOS途径中,与Na+外排和区域化实现不直接相关的是: A. Ca+-CaM B. Na+/H+ symporter C. Na+/H+ antiporter 三、问答 1.水稻幼苗经过0.1mol/L NaCI预处理24h后,再转移到8~10℃环境中,能表现出良好的抗冷性。试分析其原因。 作物耐盐性状研究进展 l 耐盐性含义和耐盐机制种类 由于土壤中可溶性盐类过量对作物造成的盐害,称为盐害或盐胁迫,包括渗透胁迫和离子效应两种类型。前者由于土壤中可溶性盐过多,土壤渗透势增高而水势降低,造成作物的吸水困难,即生理干旱;后者由于离子的拮抗作用,吸收盐类过多而排斥了对另一些营养元素的吸收,影响正常的代谢作用。作物对盐害的耐性称为耐盐性,把碳酸钠与碳酸氢钠为主的土壤称为碱土,把氯化钠与硫酸钠为主的土壤称为盐土,实际上难以绝对划分,把盐分过多的土壤称为盐碱土,简称盐土,相应的对耐盐碱性称为耐盐性[1]。 耐盐机制可分为6种:拒盐型、聚盐型、泌盐型、稀盐型、避盐型、活性氧清除等[2]。⑥有活性氧清除系统的植物通过SOD(超氧化物歧化酶)、POD(过氧化物酶)、CAT (过氧化氢酶)将活性氧清除出去,免受盐胁迫 一般盐土含盐量在0.2%~0.5%时就已对植物生长不利,而盐土表层含盐量往往可达0.6%~10%。 丙二醛时植物器官在逆境条件下发生膜脂过氧化作用的产物,可用于表示植物对逆境条件反应的强弱,从实验中也可证明小麦幼苗叶片中MDA含量随NaCl浓度的增加而增加,说明高浓度盐对植物生长产生了严重的伤害。 2 耐盐性的鉴定技术和指标 耐盐鉴定技术有直接鉴定法,如发芽鉴定(发芽率、发芽势)、形态鉴定(出苗率、盐害级别、苗期死叶率、相对生长量)和产量鉴定等;间接法有脯氨酸、甜菜碱、糖醇、多胺物质、钠钾离子含量的测定和酶活性的测定以及花粉萌发试验等。按照耐盐试验的地点分为水培、盐池、重盐碱大田。耐盐实验的对象又可分为群体、个体和单株和细胞。品种耐盐指标:耐盐系数、耐盐力(生物耐盐力、农业耐盐力)[4]。群体耐盐指标:发芽率、发芽势、盐害指数、成活苗率、相对成活苗率。目前,国内学术界一般把土壤基质含盐量达0.4%作为棉花耐盐鉴定的通用浓度[5]。叶武威等[6]采用盐池鉴定法,统计各材料在施盐10 d后(3叶期)的相对成活苗率(以生长点活为标准)来判断棉花的耐盐性,将棉花的耐盐性分为4级,即不耐(0-49.9%)、耐(50.0%一74.9%)、抗(75.0%一89.9%)、高抗(>90%)。 3 对耐盐机制的研究 泌盐是盐生植物适应盐渍环境的一条重要途径----滨藜、柽柳.盐腺的泌盐机理,是一个主动的生理过程。此类植物的叶片和茎部的表皮细胞在发育过程中分化成盐腺,通过盐腺把吸收到体内的盐分排出体 盐胁迫 全世界约有1/3的盐渍化土壤,我国约有250 多万公顷的各种盐渍土壤,主要分布在沿海地区或内陆新疆、甘肃等西北干旱、半干旱地区。随着工业污染加剧、灌溉农业的发展和化肥使用不当等原因, 次生盐碱化土壤面积有不断加剧的趋势。这些地区由于土壤中含有较多的盐类植物常受盐害而不能正常生长和存活,给农业生产造成重大损失。植物耐盐机理和耐盐作物品种的培育已成为当前的研究热点之一。综合治理盐渍土、提高植物的耐盐性、开发利用盐水资源已成为未来农业发展及环境治理所亟待解决的问题。 钠盐是形成盐分过多的主要盐类,NaCl和Na2SO4含量较多称为盐土,Na2CO3与NaHCO3含量过多称为碱土。自然界这两种情况常常同时出现统称为盐碱土。 一、盐胁迫对植物的伤害机理 盐害包括原初盐害和次生盐害。原初盐害是指盐离子的直接作用,对细胞膜的伤害极大;次生盐害是指盐离子的间接作用导致渗透胁迫,从而造成水分和营养的亏缺。 1、生理干旱。土壤盐分过多使植物根际土壤溶液渗透势降低,植物要吸收水分必须形成一个比土壤溶液更低的水势,否则植物将受到与水分胁迫相类似的危害,处于生理干旱状态。如一般植物在土壤盐分超过0. 2 %~0.5 %时出现吸水困难,盐分高于0. 4 %时植物体内水分易外渗,生长速率显著下降,甚至导致植物死亡。 2、直接盐害。(1)细胞内许多酶只能在很窄的离子浓度范围内才有活性,从而导致酶的变性和失活,以致于影响了植物正常的生理功能和代谢。高浓度盐分影响原生质膜,改变其透性,盐分胁迫对植物的伤害作用,在很大程度上是通过破坏生物膜的生理功能引起的。盐胁迫还可影响膜的组分用NaCl 和NaCO3溶液处理玉米幼苗发现膜脂中不饱和脂肪酸指数降低,饱和脂肪酸指数相对增多,这也证明了盐离子能影响膜脂成分的组成。(2)植物吸收某种盐类过多而排斥了对另一些营养元素的吸收,导致不平衡吸收,产生单盐毒害作用,还造成营养胁迫。如Na+浓度过高时,减少对K+的吸收,同时也易发生PO43-和Ca2+的缺乏症,盐胁迫下造成养分不平衡的另一方面在于Cl-抑制植物对NO3-及H2PO4 -的吸收。 3、光合作用。众多实验证明,盐分胁迫对盐生植物和非盐生植物的光合作用都是抑制的,并且降低程度与盐浓度呈正相关。 (1)盐胁迫使叶绿体中类囊体膜成分与超微结构发生改变 (2)盐胁迫对光能吸收和转换的影响 (3)盐胁迫对电子传递的影响随着盐浓度的提高PSⅡ电子传递速度明显下降能与盐胁迫损害了PSⅡ氧化侧的放氧复合物的功能,使它向PSⅡ反应中心提供的电子数量减少,阻断了PSⅡ还原侧从QA 向QB 的电子传递。 (4)盐胁迫对光合碳同化的影响光合作用碳同化过程中最重要的酶1,5—二磷酸核酮糖羧化酶(RUBPCase),在盐胁迫下会使RUBPCase 的活性和含量降低,结果酶的羧化效率下降,导致植物固定CO2 的能力减弱,与此同时,RUBPCase 还限制RUBP 和无机磷(Pi)的再生,而这两种物质再生能力的大小对C3 循环至关重要。此外,盐胁迫还会降低磷酸甘油酸、磷酸三糖和磷酸甘油醛的含量。这些物质均是C3循环的中间产物,其含量减少不利于碳同化的正常 毕业论文开题报告 生物技术 6种木本植物耐盐性研究 一、选题的背景与意义 植物对土壤盐度的反应因树种而异,即使同一种内,也存在着明显差异。植物的耐盐性是指在盐胁迫下维持生长、形成经济产量或完成生活史的能力。植物耐盐能力评价是耐盐植物引种、育种和筛选的基础,是植物形态适应和生理适应的综合体现。 土壤盐渍化是一个世界性的资源与生态问题,据联合国粮农组织和教科文组织统计,全球有各种盐渍化土地约10亿hm2,占全球陆地面积的10%,广泛分布于100多个国家和地区。我国各种类型的盐渍土总面积为14.87亿亩。其中,现代盐渍化土壤约5.54亿亩;残余盐渍化土壤约6.73亿亩;潜在盐渍化土壤约为2.6亿亩。我国沿海各省、市、自治区约18,000km的滨海地带和岛屿沿岸,广泛分布着各种滨海盐土,总面积可达5×106hm2,主要包括长江以北的山东、河北、辽宁等省和江苏北部的海滨冲积平原及长江以南的浙江、福建、广东等省沿海一带的部分地区。随着国民经济和社会的迅速发展,人口增长与耕地减少的矛盾日益突出,各类盐土资源,特别是我国海岸带盐土作为一种重要的土地后备资源,亟待我们去开发、利用和保护。 国内外研究已经证明,利用生物措施对盐碱地进行改良是缓解土壤盐渍化问题。最切实可行的办法。培育和引种能适应高盐环境的优良耐盐碱植物对改善我国广大滨海及内陆盐碱地生态系统,丰富盐碱地景观,增加树种多样性,提高土地生产力,增加经济收益无疑具有现实而深远的意义。引进国外优良耐盐碱树种及配套栽培技术,不失为一条迅速提升我国沿海防护林建设和盐碱地治理水平的有效途径,一方面可以提高沿海防护林的生态稳定性、防护功能和综合效应,另一方面还能改善沿海发达地区的生态环境和投资环境,为我国东部沿海发达地区率先实现农业和林业现代化提供重要保障。 二、研究的基本内容与拟解决的主要问题: (1)研究的基本内容: 1、盐胁迫下6个树种的生长情况: 测定6种植物在盐胁迫处理后的存活率、株高及形态变化情况 2、盐胁迫下6个树种的生理变化: 测定6种植物在盐胁迫处理后脯氨酸,叶绿素,可溶性糖,丙二醛含量以及电导率等相关生理生化指标的变化情况。第十一章 植物的逆境生理 复习参考 植物生理学复习题(推荐文档)
作物耐盐性研究
高级植物生理学04盐胁迫及其它
6种木本植物耐盐性研究【开题报告】
